Лабораторная работа. Определение константы калориметра
 Скачать 89.55 Kb. Скачать 89.55 Kb.
|
|
Лабораторная работа ОПРЕДЕЛЕНИЕ КОНСТАНТЫ КАЛОРИМЕТРА Цель работы: ознакомление с методикой определения константы калориметра по понижению температуры раствора при растворении хлоридов калия или аммония в воде. Задание: определить значение константы калориметра. Приборы и материалы: термостат, калориметр, термометр Бекмана, мешалка, секундомер, весы, мерная колба на 250 см3. Реактивы: соли KCl в порошке; дистиллированная вода. Теоритическое введение Учение о процессах выделения или поглощения теплоты при протекании химических реакций называется термохимией. Термохимией называется раздел химической термодинамики, занимающийся изучением тепловых эффектов химических реакций и различных физико-химических процессов. Основным законом термохимии является закон Гесса, вытекающий из первого начала термодинамики. Закон Гесса читается: тепловой эффект химической реакции не зависит от пути проведения реакции, а определяется родом веществ и начальным и конечным состоянием этих веществ. Тепловой эффект равен количеству теплоты, которая выделяется или поглощается в результате протекания химической реакции или физико-химического процесса при соблюдении следующих условий: давление или объем постоянные (р = const, V = const); температура постоянная (Т = const); совершается только работа расширения (рΔV). Знание тепловых эффектов необходимо для составления тепловых балансов при разработке технологических процессов в химической, пищевой, металлургической и других отраслях промышленности. Если химическая реакция или процесс проводится при постоянном объеме, тепловой эффект равен изменению внутренней энергии системы (QV = ΔU). Многие технологические процессы протекают при постоянном давлении; в этом случае тепловой эффект равен изменению энтальпии системы (Qр = ΔH). Если теплота в результате реакции или процесса выделяется, то тепловой эффект имеет отрицательное значение (ΔU < 0, ΔН < 0). В случае поглощения теплоты знаки тепловых эффектов будут обратные. Тепловые эффекты определяют экспериментально калориметрическим методом. Для этого используют прибор, называемый калориметром. Простейший калориметр показан на рис. 1. Опыт проводится в сосуде Дьюара 1, помещенном в водяной термостат 2. В сосуде Дьюара находится термометр Бекмана 3 и мешалка 4. Навеска исследуемого вещества вводится в калориметр через отверстие 5 в крышке калориметра.
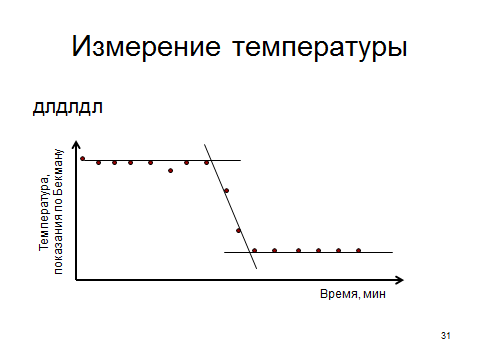
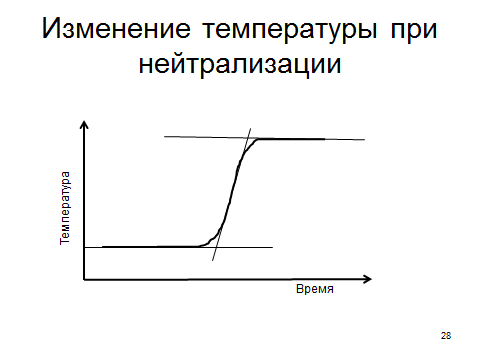
Для повышения точности измерения тепловых эффектов теплообмен между калориметром и окружающей средой должен быть сведен до минимума. В ходе опыта через определенные промежутки времени (обычно через минуту) фиксируют показания термометра Бекмана и после этого строят график (рис. 2). Все точки на графике соединяют плавной линией, она проводится между точками, если они несколько «разбросаны». Вся линия состоит из трех участков: начального, соответствующего измерениям температуры воды или кислоты (при нейтрализации), основного, с ориентацией, близкой к вертикальной, когда протекает реакция, и конечного (завершающего), когда система приходит к тепловому равновесию. К каждому участку нужно провести касательные так, чтобы это соответствовало их названию – они должны касаться линий. За величину ΔТ принимается разность ординат точек пересечения касательных ΔТ = Т2 – Т1.
Эндотермический процесс (рис. 1 a) сопровождается снижением температуры, для него ΔТ < 0 и в расчетах надо учитывать знак «минус» у ΔТ. Эндотермический процесс (рис. 2 b) сопровождается снижением температуры, для него ΔТ>0 и в расчетах надо учитывать знак «минус» у ΔТ. В уравнении теплового баланса необходимо учитывать количество тепла, которое принимает на себя реакционный сосуд и другие части калориметрической установки, поэтому уравнение принимает вид 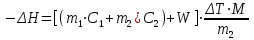 , (1) , (1)где ΔН – молярная интегральная теплота растворения хлорида калия или хлорида аммония; 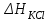 = 18,828∙106 Дж/кмоль, m1 – масса залитой в калориметр воды, кг; m2 – масса соли, кг; С1 – удельная теплоемкость воды 4,18∙103 Дж/(кг∙К); С2 − удельная теплоемкость соли, 0,07 Дж/(кг∙К); W – константа калориметра, Дж/К; ΔТ – изменение температуры в результате растворения соли (находят из графика), К; М – молярная масса соли, кг/кмоль. = 18,828∙106 Дж/кмоль, m1 – масса залитой в калориметр воды, кг; m2 – масса соли, кг; С1 – удельная теплоемкость воды 4,18∙103 Дж/(кг∙К); С2 − удельная теплоемкость соли, 0,07 Дж/(кг∙К); W – константа калориметра, Дж/К; ΔТ – изменение температуры в результате растворения соли (находят из графика), К; М – молярная масса соли, кг/кмоль.Выразить величину константы калориметра из уравнения теплового баланса не составляет труда. Константа калориметра показывает, сколько надо затратить тепла, чтобы температура всех частей установки, участвующих в теплообмене, повысилась на один градус. Определение Wосновано на проведении такого опыта, для которого в уравнении (1) все остальные величины были бы известными. Чаще всего таким опытом является растворение соли, к которой в лабораторном практикуме предъявляются требования доступности и безвредности. Порядок выполнения работы: 1. Получить от преподавателя задание формулу и массу соли. 2. Налить в мерную колбу дистиллированной воды и перелить ее в рабочий стакан калориметра, опустить в него термометр Бекмана. Термометр Бекмана закрепить так, чтобы ртутный резервуар находился полностью в воде и не касался стенок и дна стакана. 3. Взять навеску соли с точностью ± 0,01 г и записать ее массу. Не прерывая отсчета времени (и не вынимая термометр Бекмана из раствора), на 11 минуте от начала опыта всыпать навеску соли в воду через отверстие в крышке калориметра. Продолжить измерения температуры до наступления теплового равновесия, которое проявляется неизменностью показаний термометра. Как правило, за это время соль полностью растворяется. 4. Результаты экспериментов представить в следующей форме: формула соли и ее масса, г. Значения измеренной температуры записать в виде табл. 1 Таблица 1 Экспериментальные результаты
5. Построить график изменения показаний температуры термометра Бекмана во времени и определить величину ΔТ руководствуясь введением к лабораторным работам 6. Рассчитать константу калориметра, выразив ее из уравнения (1). Контрольные вопросы Что изучает термохимия? Основной закон термохимии. Что называется калориметрией? Что называется константой калориметра? Назначение термометра Бекмана. Устройство термометра Бекмана. За счет чего изменяется температура раствора? В чем заключается различие физических и химических процессов? Сделать отчет по лабораторной работе Титульный лист Теор. Введение Таблица График Расчеты Ответить на вопросы | |||||||||||||