Элементы химической термодинамики.
Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме.
Термодинамика – наука о взаимопревращениях теплоты и энергии.
Термодинамический метод основан на 2х законах термодинамики. 1й закон - это всеобщий закон природы, закон сохранения и превращения энергии.
2й закон определяет направленность и пределы протекания самопроизвольных процессов.
Процессы жизнедеятельности на Земле обусловлены накоплением солнечной энергии в биогенных веществах – белках, жирах, углеводах и последующим превращением этих веществ в живых организмах с выделением энергии. С развитием термодинамики стало возможным количественно рассчитывать превращение энергии в биохимических реакциях и предсказывать их направление.
Химическая термодинамика как теоретическая основа биоэнергетики. ХТ изучает превращения энергии и энергетические эффекты, сопровождающие химические и физические процессы, а также возможность и направление самопроизвольного протекания процесса. Химическая термодинамика является основой современной химии.
Химическая реакция - процесс, при котором одни связи заменяются другими, образуются одни соединения, разлагаются другие.
Следствие - энергетические эффекты, т.е. изменение внутренней энергии системы.
Система - тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее (вода в стакане). Если такая система не обменивается веществом со средой (стакан покрыт крышкой), она называется закрытой. Если же система имеет постоянный объем и рассматривается как лишенная возможности обмена веществом и энергией с окружающей средой (вода в термосе), такая система называется изолированной.
Внутренняя энергия U - общий запас энергии, включая движение молекул, колебания связей, движение электронов, ядер и. д., т.е. все виды энергии кроме кинетической и потенциальной энергии системы в целом.
|
Основные понятия термодинамики:
Система – любой объект природы, состоящий из большого числа молекул (структурных единиц) и отделённый от других объектов природы реальной или воображаемой граничной поверхностью (границей раздела).
Состояние системы – совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики. (равновесное, стационарное, переходное)
Равновесное – постоянство всех св-в в любой точке системы и отсутствие потоков в-ва и энергии в системе.
Стационарное – постоянство св-в во времени, ктр поддерживается за счет непрерывного обмена
в-вом, энергией и инф-ей м/д с-мой и окр-й средой.
Переходное - изменение св-в с-мы во времени.
Состояние системы характеризуется Параметрами системы (экстенсивные и интенсивные) и Функциями состояния (это всегда экстенсивные величины)
Экстенсивные пар-ры – их значения пропорциональны числу частиц в р-ре (масса, объем, кол-во в-ва)
Интенсивные пар-ры – их значения не зависят от числа частиц в с-ме (темп-ра, давление, концентрация)
Внутренняя энергия системы – сумма потенциальной и кинетической энергии всех частиц этой с-мы: U=Eкин+Eпотен
Внутреннюю энергию нельзя определить, поскольку у системы нельзя отнять всю энергию.
Работа и теплота - две формы передачи энергии.
Работа - энергет-я мера направленных форм движения частиц в пр-се взаим-я с-мы с окр-й ср-й.
Теплота - энергет-я мера хаотических форм движения частиц в пр-се взаим-я с-мы с окр-й ср-й.
Типы термодинамических систем и процессов. по характеру обмена веществом и энергией с окружающей средой)
Изолированная система – не обменивается со средой ни веществом, ни энергией (Δm = 0; ΔE = 0)
Закрытая система – не обменивается со средой как веществом, но может обмениваться энергией
Открытая система – может обмениваться со средой как веществом, так и энергией.
(по агрегатному состоянию)
Гомогенная – отсутствие резких изменений физических и химических свойств при переходе от одних областей системы к другим.
Гетерогенная – две или более гомогенные системы в одной.
Типы ТД процессов.
Изотермические - T=const, ΔT=0
Изобарические - P= const, ΔP=0
Изохорные - V=const, ΔV=0
Химическое равновесие. Обратимые и необратимые по направлению реакции. Понятие о буферном действии, гомеостазе и стационарном состоянии живого организма.
Химическое равновесие - состояние обратимого
пр-са, при ктр скорости прямой и обратной р-ций =
Обратимые – пр-сы в ктр одновременно протекают 2 взаимно против-е р-ции – прямая и обратная.
Необратимые – р-ции, ктр протекают только в одном направлении до полного израсходования одного из реагир-х в-в.
Константа химического равновесия обратимого пр-са = отношению произведений концентраций продуктов к произведению концентрации реагентов, возведенных в степень = стехиометрическим коэф-там.
[P]p [Q]q
Kc = [A]a [B]b = const при p, T = const
Прогнозирование смещения химического равновесия. Если Кр>1, то положение равновесия смещается вправо (в сторону кон-х продуктов)
Если Кр<1, то положение рав-я смещается влево
(в сторону исходных в-в)
Гомеостаз- относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т.д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими.
Основная функция буферных систем - предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот.
В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток.
Организм можно определить, как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов - от морфологически самых простых до наиболее сложных - выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели - сохранению постоянства внутренней среды. Первое начало термодинамики: энергия не исчезает и не возникает из ничего, а только превращается из одного виды в другой в строго эквивалентных соотношениях.
Энтальпия: термодинамическая ф-я, харак-щая энергетическое состояние с-мы при изобарно-изотермических условиях.
Стандартная энтальпия образования вещества (ΔH0в-ва) = энтальпии р-ции получения 1 моль этого в-ва из простых в-в при стандартных условиях.
Стандартная энтальпия реакции – кол-во теплоты, ктр выделяется или поглощается при проведении хим-х р-ций в изобарно-изотермических процессах.
Закон Гесса: энтальпия р-ции (т.е. тепловой эффект р-ции) зависит только от природы и состояния исходных в-в и конечных продуктов и не зависит от пути, по ктр протекает р-ция.
Следствия из закона Гесса
1. Энтальпия р-ции = разности суммы энтальпий обр-я всех продуктов р-ции и суммы энтальпий обр-я всех исходных в-в.
2. энтальпия прямой р-ции, численно = энтальпии обратной р-ции, но с против-м знаком
Особенности каталитической активности ферментов.
Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так, время полупревращения для реакции разложения мочевины при температуре 25 °С составляет 109 с, а в присутствии фермента уреазы оно снижается до 104 с, т. е. уменьшается в 1013 раз. Каталитическая активность ферментов во много раз превосходит активность обычных катализаторов.
|
Термохимические процессы:
Экзотермические – реакции, при протекании которых происходит уменьшение энтальпии системы (ΔН < 0) и во внешнюю среду выделяется теплота
Эндотермические – реакции, в результате которых энтальпия возрастает (ΔН > 0) и система поглощает теплоту Q извне.
Первый закон термодинамикиполностью применим к живыморганизмам и может быть сформулирован для живых систем следующим образом: Все виды работ в организме совершаются за счет эквивалентного кол-ва энергии, выделяющейся при окис-ии пит-х в-в.
В медицине энергетическую хар-ку продуктов питания принято выражать в калориях.
Калорийность пит-х в-в - энергия, выделяемая при полном окислении (сгорании) 1г пит-х в-в.
1 калория = 4,18кДж
Предмет и основные понятия химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции в интервале, истинная скорость.
Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций.
Гомогенные р-ции - отсутствие пов-ти раздела м/д реагентами, их взаимодействие протекает по всему объему с-мы.
Гетерогенные р-ции – наличие пов-ти раздела м/д реагентами, где и протекает их взаим-е.
По механизму различают простые и сложные реакции. Простые реакции – р-ции протекающие в 1 стадию. (I2=2I-)
Сложные р-ции – р-ции, протекающие в несколько стадий, каждая из ктр явл-ся простой р-цией. Стадии сложных р-ций могут протекать: последовательно, параллельно, последовательно- парал-но, циклически.
Скорость химической реакции (v) определяется изменением концентрации реагирующих веществ в единицу времени.
Наиболее употребляемая единица измерения — моль на литр-секунду (моль/л*с)
Скорость химической реакции в общем случае не является постоянной в течение всего времени ее протекания.
Истинная скорость характеризует скорость в данный момент времени.( )
Скорость химической реакции зависит в первую очередь от природы реагирующих веществ.
Средняя скорость хим-й р-ции по данному компоненту явл-ся усредненной скоростью за данный промежуток времени.
Кинетические уравнения. Кинетическое уравнение реакции — уравнение, описывающее зависимость скорости хим-й р-ции от [] реагентов. Подчиняется закону действующих масс ( скорость х-кой р-ции пропорциональна произведению [] реагентов в степенях, равных стехиометрическим коэф-там в
ур-нии р-ции).
Зависимость скорости р-ции от конц-ции.
Выражается законом действующих масс.
Зависимость скорости р-ции от температуры. Влияние Т отражено в правиле Вант-Гоффа: с увеличением Т на каждые 10К скорость хи-й р-ции возрастает в 2-4 раза:
 , где , где  – температурный коэф-т. – температурный коэф-т.
Температурный коэф-т скорости реакции и его особенности для биохимических процессов. Температурный коэф-т показывает, во сколько раз увел-ся скорость р-ции при увеличении температуры на каждый 10К. для обычных хим-х р-ций он равен 2 – 4, а для ферментативных р-ций может достигать 7 – 9. Именно поэтому колебания Т человека в пределах даже 10С сильно сказывается на его самочувствии.
Понятие о теории активных соударений.
Сильное влияние Т на скорость хим-й р-ции объясняет теория активных столкновений. Основные положения:
- не каждое столкновение приводит к акту хим-го взаим-я; - к хим-му взаим-ю приводят только те столкновения, в ктр участвуют частицы, обладающие энергией, необходимой для данного взаим-я;
- при соударении частицы должны быть определенными образом сориентированы относительно друг друга.
Энергетический профиль реакции: энергия активации; уравнение Аррениуса.
Энергия активации – минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в хим-ю р-цию. Связана с константой скорости р-ции уравнением Аррениуса:
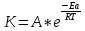 , где К – константа ск-ти р-ции при температуре Т; А – коэф-т Аррениуса; Еа – энергия активации р-ции. , где К – константа ск-ти р-ции при температуре Т; А – коэф-т Аррениуса; Еа – энергия активации р-ции.
Роль стерического фактора. Стерический фактор - фактор, учитывающий необходимость определения взаимной ориентации реагирующих частиц при их столкновении для осуществления химической реакции. Стерический фактор служит ориентирующим фактором, причем безусловно его действие подкрепляется электронными влияниями.Понятие о теории переходного состояния. Основные положения этой теории: 1) Взаимодействие молекул не сразу приводит к образованию молекул продуктов. Вначале образуется т. н. “переходное состояние” или активированный комплекс. 2) Активированный комплекс представляет собой неустойчивое образование, в которое входят все атомы столкнувшихся и вступивших во взаимодействие молекул. 3) Энергия активации в связи с этим рассматривается как энергия, необходимая для образования активированного комплекса.
4) Через какое-то время после возникновения активированный комплекс распадается с образованием молекул продуктов; при этом выделяется энергия.
Катализ. явление изменения скорости химической реакции под воздействием катализаторов. Катализатор – в-во, участвующее в р-ции и увеличивающее ее скорость, но остающееся химически неизменным в р-те р-ции.
Гомогенный и гетерогенный катализ.
Гомогенный - катализатор и реакционная смесь в одной фазе. В таких р-циях скорость пропорциональна кол-ву катализатора. В р-рах и биосредах может вызываться ионами водорода (кислотный катализ) и гидроксида (основной).
Гетерогенный – катализатор обычно твердый, а р-ция протекает на его пов-ти. Скорость р-ции сильно зависит от площади и состояния пов-ти катализатора.
Энергетический профиль каталитической реакции.
Стр107
|
Обратимые и необратимые в термодинамическом смысле процессы. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах. Термодинамические условия равновесия. Роль энтальпийного и энтропийного факторов.
Второе начало термодинамики: в с-ме при постоянной T и P самопроизвольно могут совершаться только такие пр-сы, в рез-ту ктр G уменьшается (ΔG<0)
Обратимый процесс – если при переходе из начального состояния в конечное все промежуточные состояния оказываются равновесными
Необратимый процесс – если хоть одно из промежуточных состояний неравновесное.
Энтропия –термодинамическая ф-я, харак-щая меру неупорядоченности с-мы, т.е. неоднородности расположения и движения ее частиц. ΔS = Q/ T (отношение передаваемой теплоты к абсолютной температуре)
Энергия Гиббса – функция состояния, учитывающая энергетику и неупорядоченность с-мы при изобарно-изотермических условиях.
Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG < 0 (для закрытых систем), ΔS > 0 (для изолированных систем)
В ходе самопроизвольного процесса в закрытых системах G уменьшается до определенной величины, принимая минимально возможное для данной системы значение. Система переходит в состояние химического равновесия (ΔG = 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔH), так и энтропийным (TΔS) фактором. Для реакций, у которых ΔH < 0 и ΔS > 0, энергия Гиббса всегда будет убывать, т.е. ΔG < 0, и такие реакции могут протекать самопроизвольно при любых температурах
В изолированных системах энтропия принимает максимально возможное для данной системы значение (Smax); в состоянии равновесия ΔS = 0
Стандартная энергия Гиббса G:
ΔG = ΣG0кон-ΣG0нач
Стандартная энергия Гиббса (G) биологического окисления:
ΔG = ΔH - TΔS
Экзерогонические р-ии – G уменьшается (G<0) и могут совершаться самопроизвольно (окисление глюкозы)
Эндерогонические – G увеличивается (G > 0) и возможны без внешнего подвода энергии(фотосинтез)
Принцип энергетического сопряжения. В сопряженной системе определяющим фактором будет сумма разностей потенциалов двух процессов (ΔРЭФФ = ΔP1 + ΔP2). Суммарный процесс возможен при условии, если ΔРЭФФ — величина отрицательная. Благодаря энергетическому сопряжению возможно взаимопревращение одних форм работы и энергии в другие
|
2. Растворы. Коллигативные св-ва растворов.
Растворы электролитов. . Раствор – частный случай понятия смесь. Электролиты – вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда.
Роль воды и растворов в жизнедеятельности. Организм человека на 60% сост из воды. Вода является средой и активным участником процессов жиз-ти. Благодаря высокой теплоемкости и большой теплоты испарения вода обеспечивает термостатирование нашего организма. Высокая диэлектрическая проницаемость – растворение солей, кислот, оснований. Вода способна образовывать 4 водородные связи: 2-донор протонов, 2–акцептор протонов. Все эти особ-ти воды и ее низкая вязкость способствуют выполнению ею тран-ных ф-й.
Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя.
Вода – уникальный растворитель, что объясняется след-ми ее особенностями:
1) Высокая диэлектрическая проницаемость (78,5)
2) Способностью проявлять протодонорные и протоакцепторные св-ва, так как воды – амфолит.
3) Способностью проявлять электронодонорные и электроноакцепторные св-ва.
4) Наличием внутренних пустот в жидкой воде из-за ажурности ее структуры.
Принцип «подобное с подобным»; в воде хорошо раст-ся в-ва, молекулы ктр содержат ионные связи и полярные функциональные группы и поэтому хорошо сольватируются с водой. В зав-ти от сродства к воде функцион-е группы: гидрофильные (любящие) и гидрофобные (боящиеся). К гидрофильным отн-ся ионы и полярные группы: гидроксильная - OH-, амино - NH2, карбоксильная - COOH, нитро - NO2. К гидрофобным отн-ся неполярные группы: углеводородные радикалы предельных, непредельных и ароматических соединений. Существуют в-ва, которые содержат и гидрофильный и гидрофобный фрагменты, их называют дифильными вещ-вами (мыло, белки).
Автопротолиз воды.
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
КН2О -константа автопротолиза воды
КН2О = (Н3О+)(ОН-) Константа автопротолиза воды зависит от температуры. Экспериментально установлено, что при 25°С константа автопротолиза воды = 10–14 моль2/л2
Зависимость растворения в-в в воде от соотношения гидрофильных и гидрофобных групп; влияние внешних условий на растворимость. 1. Можно рассказать на примере жирных кислот. Растворимость в воде органических соединений определяется соотношением полярных или неполярных групп. Это положение хорошо иллюстрируется на примере жирных кислот. Карбоксильная группа жирных кислот ионизирована и способна образовывать водородные связи. Однако по мере увеличения длины углеводородной цепи растворимость жирных кислот заметно снижается.
2. Количественно растворимость характеризуется концентрацией насыщенного раствора при определенных температуре и давлении, выражается граммах вещества на 100 г. растворителя. Растворимостью называют способность данного вещества растворяться в том или ином растворителе.
Растворимость вещества.
Процесс растворения протекает самопроизвольно до тех пор, пока в системе устанавливается состояние равновесия и дельта G = O, такой раствор называется насыщенным, и в нем влияние температуры и давления пользуется принципом Ле – Шателье
|
Термодинамика растворения. В-во может растворяться в ж-ти самопроизвольно при р,Т=const, если в рез-те этого процесса энергия Гиббса с-мы уменьшается, т.е дельта G<0. Изменение энергии Гиббса в пр-се растворения
в-ва равно . Влияние энтальпийного ( ) и энтропийного ( ) факторов на процесс растворения в-ва:
1) энтальпия. При эндотермических процессах, энтальпия увел-ся ( ) (соль NH4NO3)
При экзотермических процессах ( раств-е H2SO4) энтальпия уменьшается
( ).
2) энтропия. При раств-ии жидких и твердых в-в происходит переход из более упорядоченного в менее упорядоченное состояние, т.е энтропия возрастает ( ). При растворении газов в жидкости происходит переход в более упорядоченное состояние, поэтому энтропия уменьшается ( ).
Коллигативные св-ва разбавленных растворов неэлектролитов. Коллигативными св-ми называют св-ва растворов, не зависящие от природы растворенного вещ-ва, а зависящие только от концентрации частиц в растворе. К ним относятся: скорость диффузии, осмотическое давление, давление насыщенного пара раст-ля над раствором, температура кристаллизации р-ра, температура кипения р-ра. Диффузия – процесс проникновение одного вещества в другое при их соприкосновении, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму. Давление насыщенного пара раст-ля над раствором – это давление, ктр возникает при установлении равновесия м/д скоростью испарения и скоростью конденсации молекул.
Закон Рауля. Таким образом Рауль сформировал свой первый закон, ктр был характерен для идеальных растворов: относительное понижение давления насыщ-го пара р-ля над р-ром = мольной доле раст-го в-ва. ( ) Идеальный р-р – предельно – разбавленный р-р неэлектролитов нелетучего в-ва. Следствия:
1) понижение t замерзания р-ра. Повышение t кипения или понижение t замерзания для идеальных р-ров прямо пропорционально моляльной контр-ии р-ра. Это t, при ктр давление насыщ-го пара над жидкостью становится равным давлению насыщ-го пара над кристаллами этой ж-ти. Tзам= Kкр*Cm ( криоскопическая = 1,86 К*кг/моль)
2) повышение t кипения. Это t,при ктр давление нас-го пара над жидкостью становится равным внешнему давлению. Tкип=E*Cm (эбуллиоскопическая = 0,52 К*кг/моль)
3) осмос – это самопроизвольная диффузия молекул р-ля сквозь мембрану с избирательной проницаемостью.
Осмотическое давление – это то давление, ктр нужно приложить, чтобы остановить осмос. Оно подчиняется закону Менделеева – Клапейрона: - для идеальных растворов,
а для реальных , где
Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля
статистическая теория плазмы и разбавленных растворов сильных электролитов, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемое ионное облако.
Роль осмоса в биологических системах.
Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Онкотическое давление – это осмотическое давление, создаваемое за счет наличия белков в биожидкостях орг-ма. Играет важную роль в обмене водой м/д кровью и тканями.
| |
 Скачать 117.95 Kb.
Скачать 117.95 Kb.