3. Основные типы хим-х равновесий и процессов в функционировании живых систем.
Протолитические р-ции. Ионизация слабых кислот и оснований. Константа кислотности и основности. Конкуренция за протон: Гидролиз солей. Амфолиты.
Протолитическое или кислотно-основное равновесие устанавливается в ре-те конкуренции за протон (Н+) м/д основаниями взаимодействующих сопряженных кислотно-основных пар. Протолитическое равн-е всегда смещается в сторону обр-я более слабой к-ты.
Ионизация слабых кислот и оснований.
Ионизация - превращение нейтральных атомов или молекул в ионы под влиянием химических процессов.
Кислота – молекула или ион, способная отдавать катион водорода. (донор протонов)
Основание – молекула или ион, способная присоединять катион водорода (акцептор протона)
Слабые кислоты: H2S, HF, CH3COOH, HNO2 т.д.
Слабые основания: NH4OH, Me(OH)n (Me- 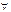 , кроме щелочных и щелочноземельных) + Ве и Мg. , кроме щелочных и щелочноземельных) + Ве и Мg.
Слабые кислоты и основания диссоциируют обратимо, равновесно, по ступеням, причём каждая последующая ступень протекает слабее предыдущей.
Конкуренция за обладание протоном делает кислотно-оснoвную реакцию обратимой и приводит ее к состоянию протолитического равновесия с определенным значением константы равновесия
Константа кислотности(Ka) — константа равновесия реакции диссоциации кислоты на катион водорода и анион кислотного остатка. Чем больше значение Ka, тем сильнее кислота.
Константа основности, определяет полноту протекания протолиза слабого основания при данной температуре
Гидролиз солей – протолитический пр-с взаим-я ионов солей с молекулами воды, в рез-те ктр обр-ся малодиссоциирующие молекулы или ионы.
варианта гидролиза ионов солей:
1. По аниону – катион сил осн-я и анион сл к-ты.
2. По катиону – катион сл осн-я и сил к-ты.
3. По катиону и аниону – катион сл осн-я и анион сл к-ты.
Амфолиты. Нектр в-ва в одних соединениях могут быть в роли донора протона, а в других в роли акцептора. Такие соединения наз-ся Амфолитами. Они проявляют св-ва как кислот, так и оснований. (н-р: вода)
Буферное действие – основной механизм протолитического баланса орг-ма. Механизм действия буферных с-м. Буферная емкость. Расчет рН протолитических с-м.
Буферная система — это равновесная система, способная поддерживать примерно на постоянном уровне какой-либо параметр при определенных внешних воздействиях. Протолитические буферные системы поддерживают постоянство рН при добавлении небольших количеств кислот и оснований.
Раствор, содержащий одну или несколько буферных систем, называется буферным раствором.
Механизм действия буферных с-м. Добавление небольших кол-в сил к-ты или щелочи в буферный р-р вызывает защитную р-цию протолит-й буф-й
с-мы по поддержанию постоянного значения рН среды. Это происходит за счет связывания ионов Н+ или ОН- соответствующими компонентами буф-й с-мы с обр-ем малодиссоциируемых соед-й.
Буферная емкость(В) – число моль-эквивалентов сил к-ты или щелочи, ктр нужно добавить к 1 литру буф-го р-ра, чтобы изменить величину рН на единицу.
Расчет рН протолитических с-м.
Уравнением Гендерсона – Хассельбаха:
|
Буферные с-мы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая. Понятие о кислотно-основном состоянии организма. Применение реакции нейтрализации в фармакотерапии: ЛС с кислотными и основными св-ми (гидрокарбонат Na, оксид и пероксид Mg, трисамин и др).
Буферные системы крови обеспечивают поддержание относительного постоянства активной реакции крови, т. е. осуществляют регуляцию кислотно-щелочного состояния.
1. Гидрокарбонатная. Образована СО2, взаим-е ктр с Н2О приводит к равновесной с-ме.
СО2+Н2О=Н2СО3=Н++НСО3-
главное назначение – нейтрализации кислот
2. Фосфатная. В клетках представлена K2HPO4,KH2PO4, в плазме крови и межклеточной ж-ти – Na2HPO4, NaH2PO4
3. Гемоглобиновая. Сложная буф-я с-ма эритроцитов. В качестве протона 2 сл к-ты: гемоглобин HHb и оксигемоглобин HHbO2. Акцептор протона – их анионы. Роль в процессах орг-ма: дыхание, транспорт кислорода в ткани и поддержание постоянства рН внутри эритроцитов.
4. Протеиновая. Бывают анионного и катионного типа. Анионный белковый буфер работает при рН>HIбелка. Состоит из донора протона – молекулы белка HProt. И акцептора протона – аниона белка (Prot)-
Катионный белковый буфер работает при рНбелка, Донор – катион белка (H2Prot)+ и акцептор – молекула белка HProt.
Кислотно-основное состояние– это соотношение кислот и оснований в биологических средах организма. Одним из основных показателей кислотно-основного состояния является рН – это отрицательный десятичный логарифм концентрации ионов водорода в растворе. Во внеклеточных жидкостях организма человека
рН – 7,35-7,45; Снижение рН ниже 7,35 свидетельствует о закислении (ацидоз), тогда как увеличение выше 7,45 — о защелачивании (алкалоз).
Реакция нейтрализации – протолитическое взаим-е кислот и оснований в ре-те ктр обр-ся соль и вода. HA+KtOH=KtA+H2O.
В фармации применяют для количественного анализа неорганических кислот — соляной, серной, борной и органических кислот — уксусной, бензойной, винной, лимонной, салициловой. В биофармацевтических исследованиях методом нейтрализации определяют рКа кислот и рКbоснований, так как по значению этих величин можно прогнозировать способность лекарственных препаратов проходить через биологические мембраны.
Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Р-ции, лежащие в основе обр-я конкрементов: уратов, аксалатов, карбонатов. Применение хлорид кальция и сульфата магния в качестве антидотов.
Изоморфизм - свойство химически и геометрически близких атомов, ионов и их сочетаний замещать друг друга в кристаллической решетке, образуя кристаллы переменного состава; т.е. изоморфизм – это изменение химического состава минерала при сохранении его кристаллической структуры.
Замена гидроксид-аниона на фторид-анион значительно повышает твердость и устойчивость зубной эмали к растворению.
Ионы стронция замещая ионы кальция, приводят к ломкости костей и вызывают стронциевый рахит.
|
Гетерогенные пр-сы и равновесия в р-рах электролитов. Константа растворимости. Условия обр-я и растворения осадков. Р-ции, лежащие в основе обр-я неорг-го в-ва костной ткани гидроксидфосфата кальция. Механизм функционирования кальций-фосфатного буфера.
Гетерогенная с-ма - разнородная с-ма,в ктр м/д частями присутствует граница раздела фаз. Насыщенный р-р – термодинамически устойчивая равновесная с-ма, в ктр скорость раств-я в-ва = скорости его выведения
Ненасыщенный р-р – термодинамически устойчивая неравновесная с-ма, в ктр скорость раств-я больше скорости выведения
Перенасыщенный р-р – термодинамически неустойчивая псевдоравновесная с-ма, в ктр скорость раств-я меньше скорости выведения.
Константа растворимости (Ks) определяется стехиометрическим произведением концентрации ионов, посылаемых в раствор данным электролитом KtnAnm=nKtm++mAnn-
Условия обр-я и растворения осадков.
Осадок малорастворимого электролита выпадает в осадок из перенасыщенного р-ра.
Осадок малорастворимого сильного электролита обр-ся, если стехиометрическое произведение концентрации его ионов в р-ре станет больше константы растворимости.
Осадок малорастворимого электролита начнет растворяться в том случае, если р-р над ним станет ненасыщенным.
Осадок малорастворимого сильного электролита растворится, если стехиометрическое произведение концентрации его ионов в р-ре станет меньше константы растворимости.
Р-ции, лежащие в основе обр-я неорг-го в-ва костной ткани гидроксифосфата кальция.
Основным минеральным компонентом кстной ткани явл-ся гидроксифосфат кальция Ca5(PO4)3OH. Обр-е этой соли можно выразить общим уравнением:
Это ур-е не передает все промежуточные стадии, но показывает, что щелочность среды
(в остеобластах рН=8,3) и повышенная концентрация фосфат ионов способствуют образованию соли.
Механизм функционирования кальций-фосфатного буфера.
Поддержание концентрации ионов кальция на постоянном уровне обеспечивает костная ткань и плазма крови; эту систему можно рассматривать как кальциевый буфер. При увеличении концентрации ионов Са2+ в плазме крови согласно принципу Ле - Шателье наблюдается сдвиг равновесия, приводящий к отложению кальция в костной ткани. Наоборот, снижение концентрации ионов Са2+ в плазме крови приводит к смещению равновесия в сторону растворения минеральных компонентов костной ткани, ее обызвествлению.
Конкремент — камни, плотного образования, встречающиеся в полостных органах и выводных протоках желёз человека. Их образование происходит из коллоидных частиц в рез-те пр-са коагуляции. При повышении [мочевой к-ты] обр-ся ее малорастворимые соли – ураты кальция. Их обр-ю способствует кислая среда мочи (рН<5). В щелочной среде (рН>7) обр-ся малорастворимые фосфаты кальция. Малораст-е оксалаты кальция могут встречаться как в кислой, так и в щелочной моче.
Антидоты – лекарственные препараты, применяемые для лечения при отравлениях.
Н-р: при попадании в организм щавелевой кислоты или ее солей, а также фторид-ионов назначают 5-10% водный раствор кальция хлорида. А при отравлении растворимыми солями бария или свинца желудок промывают 1% раствором сульфата магния.
|
Металло-лигандный баланс. 1. Константа нестойкости комплексного иона.
2. Конкуренция за лиганд или комплексообразователь: инертные и лабильные комплексы. 3. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы).
В р-рах компл-е соед-я могут подвергаться первичной и сторичной диссоциации. Первичная – распад к-го соед-я на комплексный ион внутренней сферы и ионы внешней сферы.
Вторичная - распад внутренней сферы комплекса на составляющие ее компоненты.
Количественную хар-ку устойчивости внутр-е среды описывает константа нестойкости, и для
К. иона [Ag(NH3)2]+ имеет вид
Чем меньше Кнест., тем стабильнее внутренняя сфера комплекса, т.е. тем меньше она диссоциирует в водном р-ре.
2. Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом способных к образованию комплексных соединений, то наблюдаются конкурирующие процессы: в первом случае лигандообменное равновесие - конкуренция между лигандами за ион металла, во втором случае металлообменное равновесие - конкуренция между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса.
Комплексы, в которых лиганды быстро замещаются на другие, называются лабильными комплексами, те, у которых такое замещение проходит медленно, называются инертными.
3. Главную роль в жизнедеятельности живых организмов играют бионеорганические соединения с макроциклическими лигандами. В таких лигандах донорные атомы связаны в единое кольцо – цикл.
Наиболее распространены тетрадентатные макроциклы – порфирины. Лигандами являются атомы азота, которые располагаются по углам квадрата и жестко скоординированы в пространстве. Поэтому они образуют прочные координационные соединения. Например, если используются ионы Fe2+, образуется активный центр гемоглобина.
Порфириновые комплексы железа входят в состав гемоглобина, цитохромов. Все эти комплексы имеют октаэдрическую конфигурацию. Дефицит этих веществ в организме приводит к серьезным заболеваниям.
Физико-химические принципы транспорта кислороа гемоглобином. Атом (Fe (II)) (один из компонентов гемоглобина) способен образовывать 6 координационных связей. Из них четыре используются для закрепления самого атома Fe(II) в геме, пятая связь - для связывания гема с белковой субъединицей, а с помощью шестой связи происходит связывание молекулы О2 или СО2.
Реакция, лежащая в основе переноса кислорода гемоглобином.
HHb+ + O2 <=> HbO2 + H+
Металло-лигандный баланс и причины его нарушения.
В орг-ме постоянно проис-т обр-е и разрушение жизненно необходимый биокмплексов, ктр сост из катионов «металлов жизни», или боиметаллов и биолигандов. Поддерживается концентрация указанных в-в, обеспечивая состояние металло-лигандного баланса. Нарушения происходит по разным причинам: - долговременное непоступление в орг-м катионов биометаллов или постпуление их в значительно меньших кол-х, чем необходимо для жиз-ти; - поступление катионов биометаллов в кол-вах заметно больших, чем необходимо для жиз-ти. Эти нарушения приводят к изменениям в метаболизме орг-ма вплоть до патологических.
|
Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО).
Принцип ЖМКО касается взаимодействий, рассматриваемых в теории кислот и оснований Льюиса. Согласно этой теории, основание Льюиса B отдаёт электронную пару на образование ковалентной связи с кислотой Льюиса A, которая имеет вакантную орбиталь. Эффективность такого взаимодействия зависит от химического состава и электронного строения реагирующих кислоты и основания. Данные параметры учтены Пирсоном при классификации кислот и оснований на мягкие и жёсткие.
Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять транспорт кислорода.
Термодинамические принципы хелатотерапии.
Хелатотерапия – это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s–элементов.
I - биоКО, необходимый организму;
Е - биоЛ, необходимый организму;
Т - КО-токсикант из окружающей среды;
D - Л-детоксикант.
Основные принципы
1. связать токсикант: принцип выполняется, если Кн(ТD) < Кн(ТЕ);
2. не навредить организму: принцип выполняется, если Кн(ID) > Кн(IЕ)
Механизм цитотоксического действия соед-я платины.
Известно, что именно соединения платины являются одними из наиболее эффективных противоопухолевых препаратов. Механизм противоопухолевого действия комплексов платины заключается во взаимодействии с ДНК, что приводит к остановке пролиферации и гибели опухолевых клеток. Токсическое действие комплексов платины в значительной степени связано с их накоплением в почках, где они могут взаимодействовать с белками. Кроме того, существенным недостатком таких препаратов является их низкая растворимость в воде.
Окислительно-восстановительные (редокс) р-ции и равновесия. Механизм возникновения электродного и редокс-потенциалов. Уравнение Нернста.
ОВР – хим-е р-ции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов м/д ними.
Окислитель – акцептор электронов
Восстановитель – донор электронов.
 Окислитель + е- сопряженный восст-ль Окислитель + е- сопряженный восст-ль
 Восстановитель +е- сопряженный ок-ль. Восстановитель +е- сопряженный ок-ль.
2. количественно окис-но-восст-ю сп-ть редок пары харак-ют редокс потенциалом (ᵩ0), его измеряют при [Ок-ля и вос-ля] = 1 моль/л, Т=298К, Р=1ат. Чем выше потенциал, тем выше окилит-я сп-ть редокс пары. Потенциал, возникающий на границе раздела металл — раствор соли этого металла при активности потенциалопределяющих ионов в р-ре = 1 моль/л, Т=298К, называют электродным. Расчитывается по ур-ю Нернста
- потенциал хар-ет хим-ю активность редокс пары в нестандартных условиях
- состав продуктов в ОВР зависит от рН.
|
Сравнительна сила сравнения ок-лей и вос-лей.
В ходе реакции обр-ся 2 окислительно-восстановительные пары. В гальваническом элементе окислительно-восстановительная пара создает окислительно-восстановительный потенциал Е. В стандартном состоянии, когда концентрации окислителя, сопряженного восстановителя и среды (Н+ или ОН-) равны 1 моль/л, потенциал принимает значение стандартного потенциала Е°. Это количественная характеристика свойств данной окислительно-восстановительной пары: чем выше Е°, тем сильнее окислитель, чем ниже Е°, тем сильнее восстановитель.
Е°=Ф0ок - Ф0восст.
Прогнозирование направления редокс-процессов по величинам редокс-потенциалов.
Е°(ЭДС)=Ф0ок - Ф0восст.
ЭДС>0 – прямая р-ция
ЭДС<0 – обратная р-ция
ЭДС=0 – окислительно-восст-ное равновесие
Константа ОВ процесса.

К = 10ЭДС*n/0,059,
где n – число принятых или отданных е-.
К(овр) > 1 – прямая р-ция
К(овр) < 1 – обратная реакция
К(овр) = 1 – ОВР (р-равновесие)
Физико-химические принципы транспорта е- в электротранспортной цепи (ЭТЦ) митохондрий.
Важнейший процесс биологического окисления (или тканевого дыхания), проходящий в митохондриях, осуществляется при помощи определенного ряда промежуточных ферментов (белков) - переносчиков электронов. Этот процесс представляет собой цепь окислительновосстановительных реакций. Переносчики расположены по своему окислительно-восстановительному потенциалу, транспорт электрона на всём протяжении цепи протекает самопроизвольно.
Пр-с передачи е- по ЭТЦ – экзэргонический ( G<0)
Общие представления о механизме действия редокс – буферных с-м.
Поддерживают потенциал. Противодействуют увел-ю редокс-потенциала, так как орг-м функционирует в среде, обладающей ок-ми св-ми.
К числу редокс - буферных систем относятся система глутотиона, цистин- цистеина. Система глутотиона представляет собой трипептид из аминокислот: глутаминовая кислота - цистиин + глицин. Буферное действие сводится к тому, что "удар" окислителя принимает глутатион - окисляется - затем восстанавливается глутатион.
Токсическое действие окислителей (нитраты, нитриты, оксиды азота).
Токсическое действие оксидов азота связано с их высокой окислительно-восстановительной способностью.
Токсическое действие нитратов связано с восстановлением их до нитритов, аммиака, гидроксиламина под влиянием микрофлоры пищеварительного тракта и тканевых ферментов. Если в организм человека поступают высокие дозы нитратов, через 4–6 ч появляются тошнота, одышка, посинение кожных покровов, диарея.
В зависимости от дозы нитратов, поступающих в организм, отмечают патоморфологические изменения разной степени: некроз или зернистая дистрофия в сильной степени в печени, почках, миокарде.
Обезвреживание кислорода, пероксида водорода и супероксид-иона.
В организме в результате окислительно-восстановительных реакций постоянно происходит генерация активных форм кислорода (АФК) (свободных радикалов). В орг-ме свободнорадикальное окисление сдерживается антиоксидантной буф-й с-мой, ктр превращает радикалы в малоактивные соед-я.
Антиоксиданты – в-ва, ктр обратимо реагиуруют со свободными радикалами и ок-ми и предох-ют от их воздействия жизненные метаболиты.
Н-р: Снижение [H2O2] в клетках осущт-ся с помощью ферментов каталазы и глутатион-пероксидазы.
| |
 Скачать 117.95 Kb.
Скачать 117.95 Kb.