Применение редокс-реакций для детоксикации.
Детоксикация — естественное и искусственное удаление токсинов из организма. Реакции окисления и восстановления применяются для перевода токсичных и вредных примесей в нетоксичные или нерастворимые. На этих реакциях основаны, например, удаление железа и марганца из природных вод, детоксикация цианидов и хроматов при очистке сточных вод. Окислителями могут быть хлор и хлорсодержащие реагенты, а восс-ми – антиоксиданты. Н-р: аскорбиновая к-та (витамин В)
|
Совмещенные равновесия и конкурирующие пр-сы разных типов, протекающие в орг-ме в норме, при патологии и при коррекции патологических состояний.
Равновесия (процессы), в которых принимают участие конкурирующие между собой частицы, называются совмещенными равновесиями.
.
|
4. биологически активные низкомолекулярные неорганические и органические в-ва (строение, св-ва, участие в функционировании живых систем)
Понятие биогенности химических элементов.
Биогенные эл-ты - эл-ты, необходимые для построения и жиз-ти различных клеток организмов. О (составляет ок. 70% массы организмов), C (18%), H (10%). А) По их функциональной роли:
1) органогены, в организме их 97,4% (С, Н, О, N, Р, S)
2) элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме;
3) Микроэлементы – это биологически активные атомы центров ферментов, гормонов
Б) По концентрации элементов в организме биогенные элементы делят:
1) макроэлементы;
2) микроэлементы;
3) ультрамикроэлементы.
Химия биогенных элементов s-блока.
К блоку S-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня.
Химические св-ва: s-элементы легко отдают валентные s-электроны, т.е. они представляют собой сильные восстановители. Они имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило они образуют соединения с ионным типом связи, исключение – водород, для него характерна ковалентная связь
Биологическая роль Na – содержание в организме - 0,08%. Около 40% натрия, содержащегося в костной ткани, участвует в обменных процессах. Натрий является основным внеклеточным ионом. В организме человека находится натрий в виде его растворимых солей (NaCl, NaHCO3, Na3PO4)
Биологическая роль К – содержание в организме-0,23%. 98% находится внутри клеток. Играет важную роль в сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, отдельных реакциях.
Биологический антагонизм. За счёт энергии гидролиз 1 молекулы АТФ три иона Na+ выводятся из клетки, два иона К+ поступают внутрь клетки, что и служит причиной возникновения разности потенциалов.
Биологическая роль Mg: его соединения участвуют в формировании костей, в регуляции работы нервной ткани, обмене веществ. Ежедневно человеку требуется примерено 300 – 400 мг Mg.
|
Химия биогенных элементов d-блока.
К блоку d-элементов относятся 32 элемента периодической системы. У d-элементов – непропорционально медленное возрастание атомного радиуса с возрастанием числа электронов. В результате наблюдается незначительное изменение атомных и химических свойств d-элементов с увеличением атомного номера. Есть переменная валентность и разнообразие степеней окисления. Это связано с незавершённостью предвнешнего d-электронного слоя. С увеличением атомного номера в группах металлические свойства закономерно уменьшаются. В промежуточной степени окисления проявляют амфотерные свойства.
Изменение окислительно-восстановительных свойств: В периоде с увеличением заряда ядра наблюдается уменьшение устойчивости соединений элементов в высших степенях окисления. Параллельно возрастают окислительно-восстановительные потенциалы этих соединений.
Наиболее прочные комплексы образуют
d - элементы. Для жизнедеят-ти человека важны комплексные соединения Mn,Co,Cu,Zn.
Комплексные соед-я – устойчивые хим-е соед-я сложного состава, в ктр обязательно присутствует хотя бы одна связь, по донорно- акцепторному механизму.
Среди элементов d-блока есть биогенные элементы. К ним относятся марганец, железо, кобальт, медь, цинк, молибден, а также, возможно, ванадий, хром и никель. Это микроэлементы, содержание которых в живых организмах менее сотых долей процента. Они входят в состав ферментов. Ферменты, молекулы которых постоянно содержат ион называются металлоферментами. Очень много ферментов, которые активируются ионами металлов, но не связаны с ними постоянно. Во многих случаях атомы металла, изменяя степень окисления, играют роль переносчиков электронов. Такие ферменты ускоряют биохимические реакции окисления-восстановления.
Биологическая роль Ca: в организме человека в среднем около 1 кг. Ca. Входит в состав костной ткани в форме ортофосфата.
Биологический антагонизм: наблюдается при сокращении мышцы. Ионы Ca2+ принимают участие в сокращении мышцы, а ионы Mg2+ принимают участие в расслаблении мышцы.
|
Химия биогенных элементов p-блока.
р-блок – 30 элементов IIIА – VIIIА-групп периодической системы. В группах радиусы атомов и однотипных ионов увеличиваются. Энергия ионизации при переходе от 2p элементов к 6p-элементам уменьшается. С увеличением порядкового номера неметаллические свойства ослабевают. Вдоль периода у этих элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы. В группах наблюдается склонность элементов образовывать комплексные соединения и повышаются координационные числа, однако уменьшается устойчивость максимальной положительной степени окисления и возрастает устойчивость низших степеней окисления.
Св-ва: Окислительно-восстановительные реакции, в которых участвуют р-элементы, лежат в основе их токсического действия на организм.
Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N, Р, О, S, Si, Cl) образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений – это соединения р-элементов. Пять главных (макробиогенных) р-элементов жизни – О, Р, С, N и S – это основной строительный материал, из которого сложены молекулы белков, жиров, углеводов и нуклеиновых кислот. р-Элементы имеют много валентных электронов, обладающих различной энергией. Поэтому в соединениях проявляют различную степень окисления. Например, углерод проявляет различные степени окисления от – 4 до +4. Азот – от -3 до +5, хлор – от -1 до +7.
|
5. Физико – химия поверхностных явлений в функционировании живых систем.
Сорбция – гетерогенный пр-сс самопроизвольного поглощения твердым телом или жид-тью в-в из окр-й среды. Сорбат+сорбент =сорбционный пр-сс.
Сорбат – поглощаемое в-во.
Сорбент - тв-е тела, способные поглощать в-ва.
Адсорбция – поглощаемое в-во концентрируется на пов-ти раздела контактирующих фаз.
Адсорбент – компонент, на пов-ти ктр идет адсорбция.
Адсорбат – компонент, ктр концентрируется на пов-ти адсорбента. Адсорбция: физическая и химическая. 1) характ-ся обратимостью, неспецифичностью, экзотермичностью.
2) характ-ся необратимостью, специфичностью, локализирована. При взаим-ии адсорбента с адсорбатом обр-ют хим-ю связь.
Поверхностная энергия Гиббса - термодинамическая ф-я, характеризующая энергию межмолекулярного взаим-я частиц на пов-ти раздела фаз с частицами каждой из контактирующих фаз. И количественно описывается уравнением: Gs=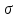 S, где S, где 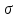 – удельная свободная поверхностная энергия, S – площадь пов-ти раздела фаз. Поверхностная энергия при постоянном давлении совпадает с энергией Гиббса. – удельная свободная поверхностная энергия, S – площадь пов-ти раздела фаз. Поверхностная энергия при постоянном давлении совпадает с энергией Гиббса.
Поверхностное натяжение. Можно объяснить след-м образом: Силы притяжения между молекулами на поверхности жидкости удерживают их от движения за ее пределы.
Адсорбционные равновесия и процессы на подвижных границах раздела фаз
Адсорбция раств-х в-в на пов-ти жидких адсорбентов описывается Уравнением Гиббса, ктр отражает зав-ть м/д []й в-ва в единице пов-ти раздела фаз и []й его в объеме р-ра:
Г = 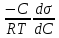 , где Г – кол-во в-ва ктр может адсорбироваться, с- равновесная молярная [] раств-го в-ва. , где Г – кол-во в-ва ктр может адсорбироваться, с- равновесная молярная [] раств-го в-ва. 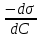 – поверхностная активность. – поверхностная активность.
Поверхностная активность – характ-ет поведение раств-го в-ва при его адсорбции пов-тью раздела.
Поверхностно-активные вещества.
Имеют гидрофобный (неполярный) и гидрофильный (полярный) фрагменты, т.е. структура дифильна. В зав-ти от хар-ра полярной группы 3виды ПАВ: 1. Анионактивные ПАВ, полярная группа- кислотная (соли высших карбоновых кислот)
2. Катионактивные ПАВ, полярная группа – катион (соли тетраалкиламмония)
3. Неионогенные ПАВ (полиоксиэтиленовые производные). ПАВ уменьшают поверхностное натяжение.
Поверхностно-неактивные вещ-ва не изменяют коэффициент поверхностного натяжения водной фазы, либо незначительно его увеличивают. (большинство неорг-х вещ-в: к-ты, щелочи, соли)
Изменение поверхностной активности в гомологических рядах (правило Траубе).
Поверхностная активность ПАВ в разбавленных р-ных водных р-рах при одинаковой молярной [] увел-ся в 3 – 3,5 раза при удлинении гидрофобной части на одну метиленовую группу. Для харак-ки поверхностной активности молекул ПАВ используют их гидрофильно – липофильный баланс (ГЛБ); заключается в том, что в молекуле любого ПАВ имеется определенное соот-е м/д активностями гидрофильных и гидрофобных групп.
|
 
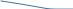 

Изотерма адсорбции - зависимость адсорбции от равновесной концентрации раств-го вещества при постоянной t. из рис-ка видно, чем длинне углеводородная цепь, тем эффективнее снижается 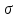 водного р-ра с ростом концентрации ПАВ. водного р-ра с ростом концентрации ПАВ.
Ориентация молекул в поверхностном слое и структура биомембран.
С увеличением конц. ПАВ в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит к образованию на границе пов-ти насыщенного мономолекулярного адсорбционного слоя, а котором молекулы пав предельно ориентированы - это слой Ленгмюра.
При наличии в р-ре в-ва, молекулы ктр дифильны, будет проис-ть их эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент всегда обращен гидрофильной фазе (к воде), а неполярный к гидрофобной фазе (акт уголь)
Адсорбционные равновесия на неподвижных границах раздела фаз.
При адсорбции изменяется хим-й состав пов-ти адсорбента, а колич-й харак-кой этого пр-са явл-ся величина удельной адсорбции Г.
Удельная адсорбция – равновесное кол-во поглощаемого в-ва, приходящееся на единицу пов-ти или массы твердого адсорбента.
Г=n/m, где n – кол-во адсорбата, моль; m – масса адсорбента, г.
Физическая адсорбция и хемосорбция.
В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы м/д физикой А. и хемосорбцией.
Адсорбция газов на твердых телах.
Явл-ся чисто поверхностным процессом, ктр заключается во взаим-ии молекул адсорбата с пов-тью адсорбента за счет сил Ван-дер-Ваальса и водородных связей. Силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль.
1. Адсорбция газов и паров на тв. адсорбентах зависит от свободной поверхностной энергии. Адсорбент тем эффективнее, чем мельче измельчен и чем выше его пористость.
2. Адсорбируемость газа определяется его сродством к пов-ти адсорбента. При физической А из смеси газов лучше адсор-ся тот компонент, ктр легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаим-ям.
|
Адсорбция из растворов. Имеет место конкуренция м/д раств-м в-вом и р-лем за возм-ть взаим-ть с адсорбционными центрами на пов-ти твердого адсорбента. Адсорбция зависит от:
1. Влияние природы адсорбента на пр-сс А. определяется удельной поверхностью адсорбента и его сродством к поглощаемому в-ву.
2. Природа р-ля. Чем хуже данный р-ль смачивает пов-ть адсорбента и чем хуже раств-ет в-во, тем лучше будет пр-дить А. раств-го в-ва.
3. Природа поглощаемого в-ва. Чем > раств-ть в-ва в данном р-ле, тем хуже оно адсорбируется на
пов-ти твердого адсорбента. – правило Шилова.
4. При повышении t А. в-в из р-ров уменьшается.
5. Влияние [] раств-го в-ва на пр-сс его А. при постоянной t описывается уравнением Ленгмюра.
Уравнение Ленгмюра.
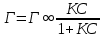 , где , где 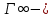 значение предельной А.; значение предельной А.;
С – равновесная [] адсорбата в с-ме; К – константа адсорбционного равновесия.
Уравнение было предложено исходя из положений теории Ленгмюра: - А. молекул проис-т не на всей пов-ти адсорбента, а лишь на адсорбционных центрах; - каждый адсорбционный центр может удерживать только одну молекулу адсорбата в течении определенного промежутка времени, затем десорбция молекул и А. новых;
- пр-сс А. обратим и носит динамический хар-р.
Зависимость величины адсорбции от различных факторов.
1. присутствие третьего компонента – р-ля, молекулы ктр могут конкурировать с молекулами адсорбата за места на поверхности адсорбента.
2. взаимодействие между молекулами адсорбата и растворителя
3. электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом.
Правило выравнивания полярностей. Описывает влияние природы поглощаемого в-ва. Правило Ребиндера - На пов-ти раздела фаз прежде всего адсорбируются те в-ва, при А. ктр происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз сп-ть к А. в-в возрастает. Поэтому эффективнее всего адсорбируются в-ва, молекулы ктр дифильны.
Избирательная адсорбция. (правило Фаянса) на поверхности данного адсорбента преимущественно адсорбируются те ионы, ктр могут достраивать кристаллическую решетку этого адсорбента. KI + AgNO3 = AgI(т)| + KNO3.
Значение адсорбционных процессов для жизнедеятельности. Явления А. играют очень большую роль также и в жиз-ти животных организмов. Роль А. обусловлена наличием в орг-ме огромного
кол-ва самых разнообразных поверхностей раздела — стенок сосудов, поверхности клеток, клеточных ядер и вакуолей, коллоидных частиц протоплазмы и, наконец, поверхности раздела между организмом и средой. Большинство р-ий, протекающих в орг-ме, совершается при непосредственном участии ферментов-катализаторов. Первые стадии действия любого фермента сводятся к А субстрата на пов-ти ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие.
| |
 Скачать 117.95 Kb.
Скачать 117.95 Kb.
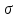 S, где
S, где 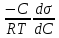 , где Г – кол-во в-ва ктр может адсорбироваться, с- равновесная молярная [] раств-го в-ва.
, где Г – кол-во в-ва ктр может адсорбироваться, с- равновесная молярная [] раств-го в-ва. 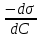 – поверхностная активность.
– поверхностная активность.


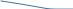


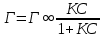 , где
, где 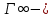 значение предельной А.;
значение предельной А.;