Устойчивость дисперсных систем.
Устойчивость дисперсионных с-м характеризует сп-ть ДФ сохранять состояние равномерного распределения частиц ДФ во всем объеме ДС.
В дисперсных с-мах различают Седиментационную, агрегативную и конденсационную устойчивость лиозолей.
Седиментационная – харак-ет сп-ть частиц ДФ нах-ся во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная – харак-ет сп-ть частиц ДФ противодействовать их слипанию м/д собой и тем самым сохранять неизменными свои размеры.
Конденсационная – это способность частиц дисперсной фазы сохранять неизменной свою удельную поверхность в течении длительного времени (КР конденнсационно не устойчивы, что объясняется их большой удельной поверхностью) – избыток свободной энергии (Энергии Гиббса).
Факторы, влияющие на устойчивость лиозолей.
1) электростатический – наличие двойного электрического слоя на поверхности частиц дисперсной фазы предотвращает их слипание
2) адсорбционно-сольватный фактор – поверхностное натяжение уменьшается в результате сольватации поверхности частиц. Сольватация – смачивание поверхности частицы жидкостью (водой - гидратация).
3) структурно-механический – из ПАВ и ВМС (высокомолекулярных соединений) на поверхности частиц дисперсной фазы образуются пленки, обладающие повышенными структурно-механическими свойствами
4) гидродинамический – снижается скорость коагуляции благодаря изменению вязкости ДС и плотности ДФ
5) энтропийный – благодаря броуновскому движению, частицы дисперсной фазы стремятся равномерно распределиться в объеме системы.
Коагуляция – пр-с слипания коллоидных частиц с обр-ем более крупных агрегатов из-за потери коллоидным р-ром агрегативной устойчивости. Процесс разрушения КР начинается с их коагуляции.
Порог коагуляции – минимальное кол-во электролита, ктр надо добавить к КР, чтобы вызвать явную коагуляцию – помутнение р-ра или изменение его окраски. Порог можно расчитать по ф-ле: 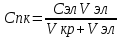 , где Сэл – исходная [] р-ра электролита; , где Сэл – исходная [] р-ра электролита; 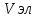 – объем р-ра электролита, добавленного к КР; – объем р-ра электролита, добавленного к КР; 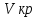 – объем КР. – объем КР.
Величина обратная порогу коагуляции, наз-ся коагулирующим действием: 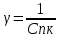
Коагулирующее действие электролитов на КР с ионным стабилизатором подчиняется правилу Шульце-Гарди: коагуляцию КР вызывают любые ионы, ктр имеют знак заряда, противоположный заряду гранул. Чем выше заряд иона-коагулянта, тем сильнее коагулирующее действие.
Взаимная коагуляция.
При смешении двух коллоидных растворов с разноименно заряженными частицами нередко происходит образование осадка, называемое взаимной коагуляцией. Разноименно заряженные коллоиды вызывают коагуляцию друг друга только в том случае, когда суммарный заряд частиц одного золя нейтрализует суммарный заряд другого.
Понятие о современных теориях коагуляции.
Теория коагуляции. Фрейндлих сформулировал основные положения адсорбционной теории коагуляции. Согласно этой теории коагулирующее действие электролита — следствие адсорбции ионов поверхностью агрегата. Поскольку коагулирующие ионы имеют заряд, противоположный потенциалопределяющим ионам, происходит нейтрализация заряда частиц, и устойчивость падает.
В настоящее время принята физическая теория коагуляции. Согласно теории - повышение концентрации электролита в ДС приводит к уменьшению толщины диффузного слой. Что приводит к потере агрегативной, а затем и кинетической устойчивости.
|
Коллоидная защита и пептизация.
КЗ - повышение агрегативной устойчивости лиофобных золей при добавлении к ним ВМС. Механизм заключается в том, что вокруг мицелл КР обр-ся адсорбционные оболочки из гибких макромолекул ВМС.
Пептизация – пр-с, обратный коагуляции – превращение осадка (коагулята), образовавшегося в рез-те коагуляции, в устойчивый КР. Может проводиться 2 путями: - промыванием коагулята чистым раст-лем; - добавлением спец-го электролита – пептизатора.
Коллоидные ПАВ; биологически важные коллоидные ПАВ (мыла, детергенты, желчные кислоты). Коллоидные ПАВ отн-ся к лиофильным КР, так же как и ВМС, они характ-ся дифильностью их молекул, т.е. наличием в молекуле гидрофильного и гидрофобного фрагментов. Эти молекулы в р-ре сосредоточены в поверхностном слое, что вызывает снижение поверхностного натяжения р-ра ПАВ с увеличением его [] до определенного знач-я, называемого критической [] мицеллообразования. При [] = КММ или >, молекулы ПАВ и ВМС объединяются в крупные ассоциаты – мицеллы.
Детергент— вещество или смесь, помогающее отмывать что-либо от грязи, моющее средство.Наиболее распространен вид смесей-детергентов – мыло
Мыла отн-ся к анионактивным ПАВ, моющее действие ктр связано с наличием дифильного аниона. Они представляют собой раствр-е в воде натриевые и калиевые соли карбоновых жирных кислот. При контакте с загрязненной пов-тью молекулы ПАВ адсорбируются на частицах грязи, ориентируясь гидрофобными участкамик пов-ти частиц, а гидрофильными фрагментами – к воде.
Мицеллообразование в р-рах ПАВ.
В полярной ДС (вода) возникают мицеллы, пов-ть ктр образована полярными группами, а ядро – гидрофобными фрагментами молекул ПАВ. В случае неполярной ДС наблюдается обратная ориентация дифильных молекул. Подобная структура мицелл обеспечивает сильное взаим-е с ДС и хорошую сольватацию их пов-ти молекулами ДС, что делает коллоидную с-му лиофильной, термодинамически устойчивой и не требующей стабилизаторов.
Определение ККМ.
Минимальная концентрация коллоидного ПАВ, начиная с которой в его растворе происходит образование мицелл, получила название критической концентрации мицеллообразования (ККМ). Значение ККМ зависит от различных факторов: природы коллоидного ПАВ, температуры, присутствия примесей посторонних веществ, особенно электролитов. Установлено, что с ростом длины углеводородного радикала молекулы коллоидного ПАВ значение ККМ уменьшается. Понижение температуры также способствует уменьшению ККМ. Присутствие электролитов в растворе не оказывает существенного влияния на ККМ неионогенного коллоидного ПАВ.
Липосомы. Представляют собой микрокапсулы диаметром 10-7 – 10-5 м, содержащие внутри воду, окруженную одним или несколькими бислоями из молекул фосфолипидов или сфинголипидов. По размерам и структуре подобны живым клеткам, а их бислойная липидная оболочка близка по структуре и св-вам к клеточным мембранам. Липосомы широко используют для направленной доставки лекарственных веществ к зонам поражения.
Св-ва р-ров ВМС. Биополимеры – природные высокомолекулярные соединения (ВМС).
Растворы ВМС характеризуются термодинамическими свойствами, это связано с гибкостью цепей макромолекул, большим числом конформаций. В растворах ВМС возможны процессы ассоциации макромолекул.
ВМС могут находиться в аморфном и кристаллическом состоянии. Мицеллы ВМС не проходят ч/з поры мембран. Для них характерно: слабое БД частиц ДФ, малая скороть диффузии и низкое осмотическое давление и малая сп-ть рассеивать свет.
|
Особенности растворения ВМС как следствие их структуры. При контакте полимера (ВМС) и растворителя (НМС) происходит набухание и затем растворение полимера. Начальная стадия растворения ВМС заключается в диффузии молекул р-ля в объем полимера. Набухание – самопроизвольный пр-сс поглощения полимеров р-ля, сопровождаемый увеличением объема и массы взятого образца ВМС. Количественно набухание измеряется степенью набухания:
а = (m – m0)/m0, или а = (V – Vo)/Vo, где m0 — начальная масса; Vo— начальный объем образца полимера; т — масса; V— объем набухшего образца.
Зависимость величины набухания от различных факторов. Степень набухания прежде всего зависит от природы полимера, т.е. жесткости его цепей. В зав-ти от этих факторов и T набухание может быть ограниченным и неограниченным. При ограниченном а достигает предельного знач-я, после чего не зависит от времени (амилаза). Так же а зависит от природы раств-ля. В соотв-ии с правилом «подобное в подобном» полярные биополимеры, например, белки, в воде набухают лучше, чем в спирте. На процесс набухания полимеров в воде влияет присутствие электролитов и значение рН.
Аномальная вязкость растворов ВМС.
Вязкостью или внутренним трением называют меру сопротивления среды движению. Измерение вязкости - самый простой и доступный способ изучения свойств макромолекул. Он ценен тем, что позволяет определять молекулярную массу биополимеров. В растворах ВМС обнаруживается аномальная вязкость: она очень высока и уменьшается с увеличением давления на протекающую жидкость. Большая вязкость этих растворов зависит от степени сродства между молекулами: силы сцепления гидрофильных молекул белков и полисахаридов с молекулами воды очень высоки, и вязкость их даже в очень разбавленных растворах также будет высокой. Кроме того, большое значение имеет форма частиц. Если вытянутые частицы располагаются поперек потока, то они оказывают наибольшее сопротивление. При увеличении внешнего давления на жидкость эти частицы ориентируются вдоль потока, в рез-те вязкость р-ра уменьшается.
Вязкость крови и других биологических жидкостей. Существенным физиологическим моментом, связанным с важнейшими процессами, происходящими в организме, является поддержание состояния осмотического равновесия м/д кровью и тканевыми жидкостями, ктр, будучи динамическим, обеспечивает постоянный обмен жидкости, низкомолекулярных питательных веществ и конечных продуктов обмена. Распределение воды и минеральных в-в м/д кровью и тканями и поддержание осмотического равновесия обеспечивается в основном нормальной [] белков в плазме крови, а кровяное давление компенсируется коллоидно-осмот-м Р.
Осмотическое давление р-ров биополимеров.
Экспериментально определенное осмот-е давление для р-ра ВМС заданной [] превышает вычисленное по закону Вант-Гоффа. Это связано с тем, что макромолекула благодаря большим размерам и гибкости ведет себя в р-ре как несколько более коротких молекул. Для расчета осмот-го давления р-ров ВМС используется уравнение Галлера:
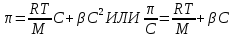 , где , где
С – массовая [] ВМС в р-ре, г/л. М – средняя молярная масса ВМС, г/моль. 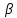 – коэф-т, учитывающий гибкость и форму макромолекулы. – коэф-т, учитывающий гибкость и форму макромолекулы.
Полиэлектролиты. Полиэлектролит — полимер, в состав молекул ктр входят группы, способные к ионизации в р-ре. Полиэлектролиты применяются в технике в качестве коагулянтов для очистки сточных вод, для снижения вязкости
Высоко[]-х дисперсных с-м на водной основе Эффективность полиэлектролитов в этих приложениях объясняется адсорбцией полиионов на пов-ть частиц с формированием ДЭС, эффективно снижающего трение м/д частицами. К полиэлектролитам относятся важнейшие биополимеры — белки, НК. Они играют важную роль в регулировании вязкости крови.
|
Изоэлектрическая точка и методы ее определения. При некотором промежуточном значении кислотности суммарный заряд макромолекулы становится равным нулю. Это значение называется изоэлектрической точкой. Изоэлектрическая точка может быть измерена однозначно с помощью электрофореза, может быть использованы данные по набуханию полиамфолитов в р-рах с различным pH.
Онкотическое давление плазмы и сыворотки крови. Онкотическое давление – часть осмотического давления крови π(ВМС), создаваемая в ней белками (альбумин, глобулин).
Величина онкотического давления колеблется в пределах 25-30 мм рт.ст. и на 80% определяется альбуминами вследствие их малых размеров и наибольшего содержания в плазме крови. Онкотическое давление играет важную роль в регуляции обмена воды в организме, а именно в ее удержании в кровеносном сосудистом русле. Онкотическое давление влияет на образование тканевой жидкости, лимфы, мочи, всасывание воды из кишечника. При понижении онкотического давления плазмы развиваются отеки, так как вода плохо удерживается в сосудах и переходит в ткани.
Устойчивость растворов биополимеров. Устойчивость лиофильных КР обусловлена сильным взаим-ем ДФ с ДС. Являясь термодинамически устойчивыми, такие с-мы не имеют склонности к самопроизвольному разрушению и не требуют специального стабилизатора.
Высаливание биополимеров из раствора. Высаливанием наз-ся разрушение лиофильных КР в рез-те практически полной десольватации мицелл, сопровождающееся выделением ПАВ или ВМС в виде хлопьев. Высаливающее действие на лиофильные с-мы оказывают все ионы. Помимо электролитов высаливающее действие на водные р-ры белков оказывают орг-е в-ва (этанол, ацетон).
|
Коацервация и ее роль в биологических с-мах.
При нарушении устойчивости раствора ВМС возможно образование коацервата — новой жидкой фазы, обогащенной полимером. Коацерват может нах-ся в исходном р-ре в виде капель или образовать сплошной слой.
Коацервация происходит при изменении T или состава р-ра и обусловлена понижением взаимной раств-ти компонентов р-ра. Коацервацию используют при капсулировании лекарств.
Застудневание растворов ВМС.
Большинство растворов ВМС, способны при определенных условиях переходить в твердое состояние без видимого разделения фаз. Этот процесс носит название застудневание, а продукты, образовавшиеся в результате этих процессов, называются студнями или гелями. Студни или гели – это дисперсные системы, у которых частицы ДФ не движутся свободно, а связаны между собой, т.е. это золи, потерявшие агрегативную устойчивость, но сохранившие кинетическую устойчивость. Причиной застудневания является возникновение связей между молекулами ВМС. Связи могут быть гидрофобные, водородные, ионные. Они зависят от природы вещества и условий застудневания.
Застудневание можно определить, как процесс обр-я и упрочнения пространственной сетки.
Свойства студней: синерезис и тиксотропия.
Синерезис – необратимый пр-с старения геля, сопровождаемый упорядочением структуры с сохранением первоначальной формы, сжатием сетки и выделением из нее р-ля.
Тиксотропия – сп-ть геля разжижаться при механическом воздействии и самопроизвольно восстанавливать свои св-ва в состоянии покоя. (сотрясение ГМ, встряхивание кефира в бутылке)
| |
 Скачать 117.95 Kb.
Скачать 117.95 Kb.