потенцометрия. Определение Витаина р (рутина) Количественное определение содержания рутина методом титрования
 Скачать 144.52 Kb. Скачать 144.52 Kb.
|
|
Определение Витаина Р (рутина) 1. Количественное определение содержания рутина методом титрования Для определения рутина (витамина Р) берётся навеска корма 0,50г и тщательно растирается в ступке, переносится в колбу, заливается 50мл горячей дистиллированной воды и проводится экстракция в течение 5 минут. Затем отфильтровывается 10 мл раствора, переносится в коническую колбу. К нему добавляется 10мл дистиллированной воды и 10 капель индигокармина. Титруется 0,05 н. раствором перманганата калия до получения устойчивой жёлтой окраски.  2 Количественное определение Методы определения рутина в ЛФ: А) Химические * Перманганатометрия Б) Физико-химические * Электрохимические (потенциометрия и полярография) * Оптические (спектрофотометрия, флуорометрия) В) Комбинированные (Хроматомасс-спектрометрия). Фармакопейным методом определения рутина является спектрофотометрический метод. Характеристика методов анализа рутина 1) Перманганатометрия. Из методов титриметрического анализа выбрали метод окисления-восстановления (редоксиметрия). Данный метод основан на окислительно-восстановительных реакциях, которые протекают между рабочим раствором и определяемым веществом. В основе перманганатометрии лежит реакция окисления ионом перманганата МnO4. Рутин способен окислятся раствором перманганата калия (КМnO4). Следовательно, определить количество рутина в лекарственной форме можно методом перманганатометрии, то есть измерением объема раствора перманганата калия известной концентрации, затраченного на реакцию с рутином. 2) Потенциометрия. Потенциометрический метод количественного определения рутина. Потенциометрическое титрование относится к методу электрохимического анализа, основанному на измерении изменяющегося в процессе титрования электрохимического потенциала электрода, погруженного в изучаемый раствор. Количественное определение рутина в среде неводных растворителей, например, ацетона, диметилформамида, диметилсульфоксида потенциометрическим методом возможно с использованием в качестве титрантов гидроокиси тетраэтиламмония или натрия. Метод имеет преимущество перед оптическими в точности определения и не требует наличия стандартных веществ для проведения количественной оценки. Малая чувствительность (для анализа требуется 0.0005 - 0.001 г вещества) и недостаточная селективность для каждого из классов затрудняют определение без предварительного разделения веществ в сырье и суммарных препаратах. 3) Полярография. В основу высокочувствительного полярографического метода анализа положено восстановление рутина на ртутном капельном электроде. Метод позволяет анализировать сумму флавоноидов, в пересчете на одно из соединений (чаще всего рутин), выбранное в качестве стандарта. В отличие от спектрофотометрии окрашенных комплексов метод дает более близкие к истинному суммарному содержанию результаты для флавоноидов. Рутин может быть определен на фоне 0.4 М раствора хлористого аммония при потенциале полуволны 1.5 В. В практике фармацевтического анализа и в особенности в заводских условиях полярографический анализ встречает затруднения, так как требует соблюдения строгих условий техники безопасности при работе со ртутью. К недостаткам метода можно отнести его малую избирательность из-за близких величин потенциалов полуволн, в связи, с чем требуется, как и при спектральных методах, предварительное разделение веществ. 4) Спектрофотометрия. Спектрофотометрический метод анализа является фармакопейным методом количественного определения рутина. Сущность спектрометрического анализа заключается в качественном и количественном определении веществ по их спектрам поглощения. Физической основой спектрального анализа является взаимодействие электромагнитного излучения с веществом. Проводят спектрофотометрическое определение по максимумам собственного поглощения. Этот метод является одним из наиболее распространенных методов анализа рутина. Обладая высокой чувствительностью, метод неселективен, так как не контролирует содержание каждого из веществ одного класса соединений и не позволяет судить о их количестве. А также проводят спектрофотометрическое определение на основе цветных реакций. Спектрофотометрические определения по реакции диазотирования ранее были широко распространены в анализе. Реакция чувствительна, но не избирательна, так как наряду с флавоноидами эту реакцию дают фенольные соединения, пиразолоны и другие классы соединений. Несмотря на указанные недостатки, метод нашел широкое применение при установлении суммарного содержания флавоноидов в сырье и суммарных фитохимических препаратах. 5) Флуориметрия. Флуориметрия (люминесцентный анализ) -- определение концентрации вещества по интенсивности флуоресценции, возникающей при облучении вещества ультрафиолетовыми лучами. При соответствующих условиях этим путём можно обнаружить наличие ничтожных количеств вещества. Комплексонообразующие свойства рутина положены в основу этого метода, являющегося на порядок более чувствительным, чем спектрофотометрический. Количественно оценить рутин этим методом возможно при наличии 0.05-1 мкг вещества в 1 мл раствора. Высокая чувствительность флуорометрического метода раскрывает широкие возможности его применения для предварительной идентификации биологически активных веществ. Однако получить объективные результаты при анализе лекарственных препаратов можно только после разделения веществ с помощью различных видов хроматографии. 6) Хроматомасспектрометрия. Хроматомасспектрометрия - метод анализа смесей, преимущественно органических веществ, и определения следовых количеств веществ в объеме жидкости. Метод основан на комбинации двух самостоятельных методов - хроматографии и масс-спектрометрии. С помощью первого осуществляют разделение смеси на компоненты, с помощью второго - идентификацию и количественный анализ. Применимость и аналитические качества масс-спектрометрии в области количественного определения рутина в значительной мере определяются возможностью ее комбинации с другим методом, таким как жидкостная хроматография. Хроматомасспектрометрический метод позволяет идентифицировать рутин независимо от присутствия посторонних или родственных соединений. Фотометрическое определение суммарного содержания флавоноидов в «Аскорутине». Предварительно сняли спектр поглощения водно-спиртового 0,05 % раствора «Аскорутина». Рис.2. Спектр поглощения 0,05% раствора «Аскорутина». 0,05% раствор «Аскорутина» имеет максимумы поглощения при длинах волн 250 нм (А = 1,185) и 360 нм (А = 0,508). Для получения фотометрируемой формы проводили реакцию рутина с хлоридом алюминия, с образованием окрашенного в желтый цвет комплексного соединения. В качестве стандарта использовали водно-спиртовый раствор рутина с концентрацией 4 мг/мл. В мерную колбу вместимостью 25 мл налили 1 мл раствора «Аскорутина», добавили 1 мл 2% спиртового раствора алюминия хлорида и довели объем до метки дистиллированной водой. Для приготовления стандартного раствора в мерную колбу вместимостью 25 мл налили 0,2 мл стандартного раствора рутина с концентрацией 4 мг/мл, добавили 1 мл 2% спиртового раствора алюминия хлорида и доводили объем до метки дистиллированной водой. Через 20 минут измеряли оптическую плотность на фотоэлектроколориметре КФК-2 при длине волны 440 нм в кювете с толщиной слоя 10 мм. Количество рутина в мг/мл находили методом стандарта и рассчитывали содержание рутина. Расчеты: Оптическая плотность раствора, содержащего 1 мл раствора «Аскорутина», равна 0,1, а раствора, содержащего 2 мл раствора «Аскорутина», равна 0,24. 0,16 мг - в 1 мл х - в 50 мл 8 мг - 50мг y - 300 мг 48 мг рутина содержится в 1 таблетке «Аскорутина». Приготовление 2% раствора алюминия хлорида. 2 г алюминия хлорида (ГОСТ 3759-75 «х.ч.» или «ч.д.а.») растворяют в мерной колбе вместимостью 100 мл в 50 мл 50% спирта, доводят объем раствора спиртом той же концентрации до метки и перемешивают. Потенциометрические методы анализа Основаны на использовании электродвижущей силы электрохимической (потенциометрической ) ячейки от концентрации (активности) определяемого вещества в анализируемой растворе. Простейшая потенциометрическая ячейка содержит два электрода; потенциал одного из них прямо или косвенно зависит от концентрации определяемого вещества – его называют индикаторным (ионселективным) электродом; и второй электрод относительно которого измеряется потенциал индикаторного электрода, называемый электродом сравнения. Потенциометрический метод анализа предоставляет возможность прямого и селективного определения различных элементов и разных ионных форм одного и того же элемента ( NH4+, NO2,- NO3-, S, SO4, Cl ) , что имеет особое значение для анализа окружающей среды. Достоинства метода - простота, быстрота, невысокая стоимость оборудования, возможность проведения анализа в мутных и окрашенных средах. Буферные растворы– растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным рН, почти не зависящими от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты или щелочи. Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью. Потенциометрическое титрование. Потенциометрическое титрование – способ определения объема титранта, затраченного на титрование определяемого вещества в анализируемом растворе , путем изменения ЭДС ( в процессе титрования) с помощью гальванической цепи, составленной из индикаторного электрода и электрода сравнения. Изменение концентрации иона непременно сопровождается изменением потенциала на электроде, погруженном в титруемый раствор. При этом, около точки эквивалентности наблюдается скачок потенциала, который фиксируется при помощи потенциометра. В данном случае сам электрод как бы сам служит индикатором и может быть назван индикаторным электродом. Иначе говоря, за ходом реакции следят с помощью индикаторного электрода в паре с подходящим электродом сравнения, измеряют разность потенциалов между электродами. В методе потенциометрического титрования для нахождения конечной точки титрования используют зависимость равновесного потенциала индикаторного электрода от состава раствора. Измеряя потенциал электрода после добавления каждой порции раствора титранта, можно проследить за протеканием химической реакции в процессе титрования и по полученной кривой титрования найти конечную точку. В потенциометрическом титровании применимы кислотно-основные, окислительно-восстановительные реакции, а также реакции комплексообразования и осаждения, протекающие стехиометрически, быстро и количественно. При потенциометрическом титровании не требуется использование индикаторов, изменяющих окраску вблизи ТЭ. Кривая потенциометрического титрования – графическое изображение изменения ЭДС электрохимической ячейки в зависимости от объема прибавленного титранта. Необходимо иметь подходящий индикаторный электрод, потенциал которого обратимо реагирует на изменение концентрации одного из участвующих в реакции титрования ионов. Кроме того, для проведения титрования необходимы бюретка, магнитная мешалка и прибор для измерения потенциала индикаторного электрода (обычно – рН -метр со шкалой, прокалиброванной в единицах рН и милливольтах). Электроды погружены в раствор, определяют потенциал и приступают к титрованию, приливая из бюретки каждый раз определенный объем рабочего раствора реактива, перемешивая и делая отсчет разности потенциалов. Результаты опыта изображают графически: на оси абсцисс откладывают объем рабочего раствора (мл), а на оси ординат – величины рН или потенциала. При этом точка перегиба на полученной кривой совпадает с точкой эквивалентности титрования. Он и соответствует конечной точке титрования. К несомненным достоинством потенциометрического титрования по сравнению с использованием визуальных индикаторов относится отсутствие субъективных ошибок, связанных с наблюдением за изменением окраски индикатора. Потенциометрически можно титровать мутные и окрашенные растворы т.е. можно рещать задачу, невыполнимую для визуальных титриметрических методов. 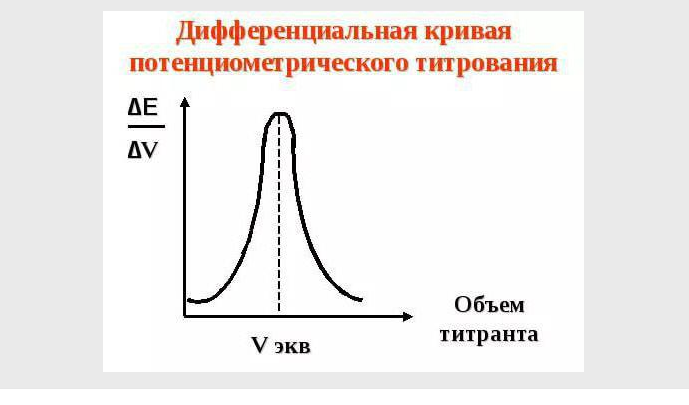 2.1. Метод титрования. Для титрования в бюретку наливают раствор известной концентрации (в нашем случае это 0,05Н раствор перманганата калия) и устанавливают бюретку в рабочее положение. Пипеткой отбирают точный объем раствора, концентрацию которого нужно определить, и переносят его в коническую колбу (в нашем случае это экстракты чая). После по каплям приливают раствор с известной концентрацией из бюретки в колбу с анализируемым раствором, который непрерывно перемешивают. Конец титрования устанавливают по изменению цвета индикатора. 2.2. Приготовление исходных веществ. 2.2.1. Приготовление 0,05 Н раствора перманганата калия (KMnO4). Необходимую массу для приготовления данного раствора сначала высчитывают по формуле: m=cVM, c- необходимая концентрация раствора (0,05 моль/л); V- общий объем раствора (0,1 литр); M- молярная масса вещества KMnO4 (158 г/моль). Подставляем и находим, что масса KMnO4 равняется 0,79 г или 790 мг. Эта масса отмеряется на технических весах и вносится в нужный объем воды. 2.2.2. Приготовление раствора индикатора – индигокармина. Индигокармин – органическая краска, является специфическим индикатором, изменяющим свою окраску в зависимости от реакции среды раствора. Раствор индигокармина готовят следующим образом: берут 1 г краски, растворяют его в 1000 мл раствора этилового спирта (на 1 часть спирта надо 4 части воды). 6. Литература 1. Машковский М.Д., Бабаян Э.А., Северцев В.А. Государственная фармакопея СССР, XI издание, Выпуск 2, Общие методы анализа, лекарственное растительное сырье / М.Д. Машковский, Э.А. Бабаян, В.А. Северцев. – М., "Медицина", 1991 – 196 с. 2. Арзамасцев А.П. Фармацевтическая химия: Учеб. пособие - М.: ГЭОТАР-МЕД, 2004 — 640 с. 3. Беликов B.Г. Фармацевтическая химия. В 2 ч: Учебн. пособие - М.: МЕДпресс-информ, 2007 — 624 с. 4. https://studfiles.net/preview/1714947/page:9/ 5. https://www.skachatreferat.ru/referaty/Курсовая-Работа-Рутин/73197562.html 6. http://fb.ru/article/332271/potentsiometricheskie-metodyi-analiza-i-ih-tipyi 7. https://nsportal.ru/ap/library/nauchno-tekhnicheskoe-tvorchestvo/2012/02/09/opredelenie-soderzhaniya-vitamina-r-rutina-v |
