физхимия. ФХ_74 (1). Определите состав реакционной смеси до и после реакции. Составьте таблицу материального баланса
 Скачать 40.67 Kb. Скачать 40.67 Kb.
|
КОНТРОЛЬНЫЕ ЗАДАНИЯОпределите состав реакционной смеси до и после реакции. Составьте таблицу материального баланса. Рассчитайте ΔН0298, ΔS0298, ΔG0298 химической реакции. Возможно ли осуществить реакцию при 473 К? Определите скорость и время реакции с учетом степени превращения и выхода продукта. Определите рН среды после реакции.
Задание1 Определите состав реакционной смеси до и после реакции с учетом выхода продуктов реакции. Составьте таблицу материальногобаланса. Дано: 1 Химическая реакция для расчета материального баланса H3PO4+NaOH 2. Характеристики исходных растворов Сн H3PO4) = 4 моль/л; Vр-ра(H3PO4) = 2 л; СМ(NaOH) = 4 моль/л; mр-ра(NaOH) = 2,1 кг; ρр-ра(NaOH) = 1,21 г/мл;
Материальные баланс
* - количество молей приходной и расходной частей могут бытьнеравными. Задание 2.Рассчитайте энергию Гиббса, энтальпию, энтропию данного процесса при температуре 298 К. Возможна ли данная реакция при температуре 473 К? Определяем энтальпию данной реакции при Т=298 К: 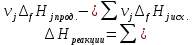 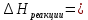 -1544,90-285,83+1266,90+426,35=-137,48 кДж/моль. -1544,90-285,83+1266,90+426,35=-137,48 кДж/моль. Определяем энтропию данной реакции при Т=298 К: 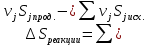 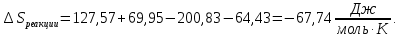 Определяем энергию Гиббса при Т = 298 К: ΔG0298 = ΔН0298 - ТΔS0298 ΔG0298 = –137,48 – 298·(–67,74·10–3) = –117,29 кДж/моль. Так как ΔG0298 <0, то данная реакция возможна при температуре Т=298 К. ΔG0473 = –137,48 – 473·(–67,74·10–3) = –105,44 кДж/моль. При Т=473 К данная реакция также возможна.  Задание 3. Определите скорость и время реакции с учетом выхода продукта. Константа скорости реакции К=0,7 л/(моль·мин). Задание 3. Определите скорость и время реакции с учетом выхода продукта. Константа скорости реакции К=0,7 л/(моль·мин).Масса раствора после реакции: mр-ра = mр-ра(H3PO4)+mр-ра(NaOH) = 2460+2100= 4560 г. Так как концентрации веществ в растворе незначительны, то плотность раствора принимаем за 1 г/мл, отсюда: Vр-ра = 4,56 л. Время реакции: 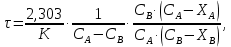 где К – константа скорости реакции; СА, СВ – начальные концентрации реагирующих веществ, моль/л; ХА, ХВ – количество молей реагирующих веществ, вступивших в реакцию к моменту времени 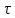 . .Концентрация веществ до реакции: С(H3PO4)=ν/V=8/4,56=1,74 моль/л С(NaOH)=ν/V=7/4,56=1,54 моль/л Концентрация веществ после реакции: С(H3PO4)=ν/V=1,04/4,56=0,23 моль/л С(NaOH)=ν/V=0,56/4,56=0,12 моль/л Время реакции: τ=(2,303/0,7)∙(1/(1,74−1,54))∙(1,54∙0,23/1,74∙0,12)=27,97 мин Скорость реакции по H3PO4: ϑ=ΔC/Δτ=1,74−0,23/27,97=0,054 моль/(л∙мин) Задание 4. Определите рН среды после реакции. После завершения реакции в растворе присутствуют вещества: H3PO4, NaOH, H2NaPO4. На реакцию среды могут влиять NaOH, H2NaPO4 и H3PO4. H3PO4 и H2NaPO4 образуют буферный раствор слабой кислоты и ее соли, рН которых определяется уравнением: 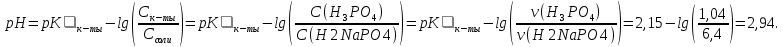  Рассчитаем общую концентрацию буферного раствора: 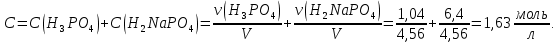 Рассчитаем буферную ёмкость этого раствора: 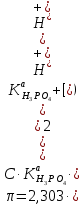 Найдем концентрацию NaOH в растворе и как он изменяет рН буферного раствора: 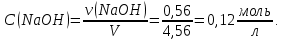 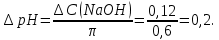 Таким образом, рН раствора: рНр-ра = рН + ΔрН = 2,94+0,2 = 3,14. Среда кислая | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
