Министерство здравоохранения Хабаровского края КГБОУ ДПО “Институт повышения квалификации специалистов здравоохранения”
Реферат
ТЕМА: Особенности при определении групп крови в системе АБ 0
Цикл Современные методы иммуногемоталогических исследований.
Время
Выполнил(а):
Проверил(а):
Город Хабаровск 2016
ПЛАН
1. Определение групп крови
1.1 Общие положения
1.2 Методика определения группы крови простой реакцией
1.3 Метод определения группы крови двойной (перекрестной) реакцией
1.4 Определение группы крови моноклональными антителами
1.5 Ошибки при определении групп крови
1.6 Определение резус-фактора
1.7 Определение резус-фактора с помощью моноклонального реагента (цоликлон анти-d супер)
1.8 Определение группы крови и резуопринддлежности перекрестной реакцией на микроплатах
1.9 Гелевые технологии в иммуногематологии
2. Алгоритмы выполнения иммуногематологических исследований в специализированных лабораториях реципиенты
3. Доноры
3.1 Беременные женщины
3.2 Новорожденные
Использованная литература
1. ОПРЕДЕЛЕНИЕ ГРУПП КРОВИ
1.1 ОБЩИЕ ПОЛОЖЕНИЯ
Определение групп крови по системе АВО проводится двумя способами: простой реакцией и двойной реакцией. Простая реакция проводится стандартными сыворотками, при этом выявляют агглютиногены А и В в исследуемых эритроцитах. Двойная реакция предполагает определение группы крови по стандартным эритроцитам и стандартным сывороткам. Двойной реакцией определяют кровь преимущественно у доноров.
Срок годности стандартных агглютинирующих сывороток составляет 4 месяца при t от +4 до +6 °С. Во избежание ошибок при определении групп крови стандартные гемагглютинирующие сыворотки окрашивают в разные цвета. Сыворотка О (I) группы не окрашивается, и этикетка ее не маркируется. Сыворотка А (II) группы окрашивается в синевато-зеленый цвет, и этикетка маркируется синим цветом. Сыворотка В (III) окрашивается в розовый цвет, и этикетка маркируется красным цветом. Сыворотка АВ (IV) группы окрашивается в желтый цвет, этикетка — тоже в желтый цвет. На этикетке флаконов с сывороткой указывают групповую принадлежность, титр сыворотки, номер серии, срок годности. Титр сыворотки — это ее максимальное разведение, в котором сыворотка дает еще четкую агглютинацию. Оптимальный титр должен быть не ниже 32, т. е. при разведении сыворотки в 32 раза она сохраняет четкую агглютинацию.
Для определения группы крови кровь можно забирать из вены, из пальца, уколов в мякоть ногтевой фаланги.
Оснащение: стандартные сыворотки О (I), A (II), В (III) двух разных серий каждой группы; белые тарелки; стеклянные палочки; пипетки; спирт; ватные шарики; 0,9% раствор хлорида натрия; раствор йода; скарификатор.
Перед определением группы крови необходимо убедиться в пригодности сывороток:
флакон не должен иметь трещин, дефектов;
на флаконе обязательно должна быть этикетка;
обязательно внимательно прочитать срок годности, титр сыворотки, серию и групповую принадлежность;
4)в сыворотке не должно быть хлопьев, осадка, пленок. Сыворотками лучше пользоваться в день вскрытия ампул,
но допускается хранение открытых ампул 3-4 дня в холодильнике, при условии если горлышко заклеивается пластилином, лейкопластырем, закрывается ваткой.
1.2 МЕТОДИКА ОПРЕДЕЛЕНИЯ ГРУППЫ КРОВИ ПРОСТОЙ РЕАКЦИЕЙ
Определение группы крови проводится при температуре + 15- +25 °С на маркированной плоскости (тарелке) белого цвета, где записывается фамилия лица, у которого определяется кровь. На тарелку наносят по 2 капли стандартных сывороток групп Оар (I), Ар (II), Ва (III) двух серий. Расстояние между каплями не менее 4—5 см. Каждая сыворотка наносится своей пипеткой. Справа от капель сывороток помещают каплю крови, которая должна быть в 5-10 раз меньше капель сывороток. Перемешивают кровь с сыворотками. Можно перемешивать кровь с сывороткой одним и тем же углом предметного стекла (или стеклянной палочкой), но в этом случае после каждого перемешивания необходимо промывать стекло в воде и насухо вытирать. За ходом реакции в общей сложности наблюдают не менее 5 мин, периодически покачивая тарелку. В капли, в которых к третьей минуте наблюдения произошла агглютинация, вносят по 1 капле физиологического раствора и наблюдают еще две минуты. Добавление физиологического раствора не разрушает истинной агглютинации и позволяет отдифференцировать ее от псевдоагглютинации, обусловленной самопроизвольным склеиванием эритроцитов в монетные столбики. Результат оценивается по наличию агглютинации.
Оценка результатов:
Проводится не ранее чем через 5 мин.
Если со стандартными сыворотками агглютинации не наступило, значит эритроциты исследуемой крови не имеют аг-лютиногенов и она относится к Ооф (I) группе.
Если агглютинация наступила с сывороткой Оос(3 (I) и Ва (III) групп и не наступила с сывороткой А(3 (II), то исследуемая кровь — Ар (II) группы.
Если агглютинация наступила с сыворотками Оар (I) и Ар (II) и не наступила с сывороткой Ва (III), значит исследуемая кровь — Ва (III) группы.
Наличие агглютинации со всеми стандартными сыворотками не позволяет отнести ее к АВ0 (IV) группе, поскольку возможна панагглютинация. В этом случае на тарелку наносят 2 капли стандартной сыворотки АВ0 (IV) группы и добавляют к ним каплю исследуемой крови. Результат оценивают через 5 мин. Если агглютинации не произошло, то исследуемая кровь — АВ0 (IV) группы.
1.3 МЕТОД ОПРЕДЕЛЕНИЯ ГРУППЫ КРОВИ ДВОЙНОЙ (ПЕРЕКРЕСТНОЙ) РЕАКЦИЕЙ
Для определения группы крови этим методом кроме стандартных сывороток берут стандартные эритроциты групп Осф (I), Ар (II), Ва (III), которые готовят в учреждениях службы крови. Кровь для исследования берут из вены в количестве 5 мл в чистую сухую пробирку без добавления цитрата, для того чтобы можно было получить отдельно сыворотку и эритроциты. Тарелку делят горизонтальной линией на две части. В верхней части ведут исследования стандартными сыворотками с исследуемыми эритроцитами, в нижней — стандартными эритроцитами с исследуемой сывороткой. Через 5 мин проводят оценку и делают заключение о группе крови.
1.4 ОПРЕДЕЛЕНИЕ ГРУППЫ КРОВИ МОНОКЛОНАЛЬНЫМИ АНТИТЕЛАМИ
Моноклональные антитела получают с помощью генной инженерии. АВО-титрующие моноклональные антитела (цолик-лоны анти-А и анти-В) выпускаются в разных странах: Германии, Англии, Канаде, США, России — в промышленных масштабах. Они не являются продуктами клеток человека, их готовят из крови стерильных мышей, поэтому исключено содержание в них вируса гепатита и СПИДа. Принимая во внимание высокую активность и авидность реагентов цоликлон, а также полную их стандартность, для каждого определения группы крови достаточно применять по одной серии реагентов анти-А и анти-В. Цоликлон анти-А окрашен в голубой цвет, анти-В — в розовый.
Цоликлоны анти-А и анти-В наносят на планшет или пластинку по одной большой капле (0,1 мл) под соответствующими надписями "анти-А" и "анти-В". Рядом с каплями антител наносят исследуемую кровь по одной маленькой капле в соотношении 10 : 1 (0,01 мл). После смешивания реагентов и крови за реакцией агглютинации наблюдают в течение 2,5 мин.
Оценка результатов:
Агглютинации нет ни с цоликлоном анти-А, ни с цоликло-ном анти-В. Следовательно, исследуемые эритроциты не содержат антигенов А и В, и кровь принадлежит к группе Оар (I).
Агглютинация наблюдается только с цоликлоном анти-А. Следовательно, исследуемые эритроциты содержат только антиген А, и кровь принадлежит к группе Ар (II).
Агглютинация наблюдается только с цоликлоном анти-В. Следовательно, исследуемые эритроциты содержат только антиген В, и кровь принадлежит к группе Ва (III).
Агглютинация наблюдается как с цоликлоном анти-А, так и с цоликлоном анти-В. Следовательно, исследуемые эритроциты содержат оба антигена (А и В), и кровь принадлежит к группе АВ0 (IV).
С целью исключения аутоагглютинации, которая может наблюдаться у некоторых больных (миеломная болезнь, ожоговая болезнь), а также в пуповинной крови новорожденных, в случае установления группы крови АВ (IV) необходимо произвести контрольное исследование: одну каплю (0,1 мл) изотонического раствора хлорида натрия смешать с маленькой каплей (0,01 мл) исследуемой крови. Реакция агглютинации должна ОТСУТСТВОВАТЬ.
1.5 ОШИБКИ ПРИ ОПРЕДЕЛЕНИИ ГРУПП КРОВИ
Ошибки технического характера:
не маркированы тарелки;
использована одна палочка при смешивании сывороток разных групп и крови;
нарушено соотношение между стандартными сыворотками и исследуемой кровью (эритроцитов должно быть в 5-10 раз меньше, чем сыворотки);
оценка результатов проводится до истечения 5 мин.;
не соблюден температурный режим;
если не добавляется 0,9% раствор хлорида натрия, за агглютинацию принимают монетные столбики.
Ошибки биологического характера, т. е. неспецифическая агглютинация:
способность эритроцитов давать агглютинацию со всеми стандартными сыворотками;
эритроциты агглютинируются с собственной сывороткой — для исключения ошибки необходимо тарелку поставить в термостат при t +37 °С на 5б мин. Может быть у людей с заболеваниями крови, печени, почек, хроническими воспалительными процессами;
полная панагглютинация — испытуемые эритроциты и сыворотка обладают панагглютинирующими свойствами, физиологический раствор, помещение тарелки в термостат, отмывание эритроцитов трижды физиологическим раствором неэффективно. В этом случае необходимо исследовать агглютиноге-ныАиВв слюне больного;
феномен Томпсона — инфицированная кровь дает неспецифическую агглютинацию;
5)у новорожденных агглютиногены А и В еще не достаточно активны и поэтому исследование должно проводится сыворот ками с высоким титром антител;
6)наличие слабых агглютиногенов А2, А3. Ошибки, связанные с сыворотками:
использование сывороток с титром ниже 1 : 32;
у сывороток истек срок годности;
использование инфицированных сывороток.
1.6 ОПРЕДЕЛЕНИЕ РЕЗУС-ФАКТОРА
В повседневной практике определение резус-фактора производится с помощью антирезусных сывороток (анти-D) или моноклональными aHTn-D-антителами.
Для проведения данного исследования используется универсальная антирезусная сыворотка для экспресс-метода (анти-D). Исследуемую кровь берут из пальца непосредственно перед исследованием или используют консервированную кровь без всякой предварительной обработки, а также эритроциты из пробирки после образования сгустка и отстаивания сыворотки. На дно пробирки наносят одну каплю стандартной антирезус-ной сыворотки для экспресс-метода и добавляют одну каплю исследуемой крови. После чего осторожными движениями добиваются, чтобы образовавшаяся жидкость растекалась по стеклу пробирки. Через 3 минуты после внесения эритроцитов добавляют в пробирку 2
3 мл физиологического раствора. Пробирку осторожно переворачивают 3 раза. Затем читают результат.
Оценка результата:
Наличие глыбок агглютинатов на фоне просветленной жидкости указывает на резус-положительную принадлежность исследуемой крови — Rh+.
Отсутствие агглютинации (гомогенно окрашенная жидкость в пробирке) указывает на резус-отрицательную принадлежность — Rh
.
1.7 ОПРЕДЕЛЕНИЕ РЕЗУС-ФАКТОРА С ПОМОЩЬЮ МОНОКЛОНАЛЬНОГО РЕАГЕНТА (ЦОЛИКЛОН АНТИ-D СУПЕР)
На тарелку наносят большую каплю реагента (около 0,1 мл). Рядом помещают маленькую каплю (0,01-0,05 мл) исследуемой крови и смешивают кровь с реагентом. Реакция агглютинации начинает развиваться через 10-15 сек, четко выраженная агглютинация наступает через 30-60 сек. Результаты реакции считывают через 3 мин. Тарелку после смешивания реагента с кровью рекомендуется покачивать не сразу, а через 20-30 сек, что позволяет за это время развиться более полной крупнолепестковой агглютинации.
Цоликлон анти-D супер выпускается во флаконах по 2,5 или 10 мл (1 мл содержит 10 доз). Срок хранения — 1 год в холодильнике при t 2
8 °C. Вскрытый флакон можно хранить в холодильнике в течение месяца в закрытом виде.
1.8 ОПРЕДЕЛЕНИЕ ГРУППЫ КРОВИ И РЕЗУОПРИНДДЛЕЖНОСТИ ПЕРЕКРЕСТНОЙ РЕАКЦИЕЙ НА МИКРОПЛАТАХ
Только для диагностики "in vitro". Назначение микроплат: определение АВО, Rh-групповой принадлежностей перекрестной реакцией.
Принцип метода: эритроцитарные фенотипы АВО системы крови подразумевают присутствие или отсутствие А или В антигенов на поверхности эритроцитов и, соответственно, наличие антител в сыворотке против присутствующих антигенов. Определение Rh-принадлежности основывается на наличии или отсутствии антигена D.
Необходимые реагенты: микроплаты с U-образными лунками с помещенными в них готовыми реагентами (моноклональ-ные реагенты: анти-А, анти-В, анти-АВ, анти-D IgM; отрицательный контроль).
DianaPlate 1 предназначена для определения ABO/Rh-принад-лежности перекрестной реакцией одновременно у 12 пациентов.
Условия стабильности реагента: данный вид реагента стабилен при температуре хранения 2-8 °С при сохраненной целостности алюминиевой упаковки. После вскрытия упаковки микроплата может храниться в течение 7 дней при температуре 2
8 °С и при заклеенной вновь упаковке липкой лентой. Срок годности указан на этикетке.
Правила взятия, приготовления и хранения исследуемых образцов крови:
не подлежат использованию образцы крови с явлениями гемолиза, видимыми загрязнениями или содержащие сгустки;
рекомендуется использовать свежевзятую сыворотку или плазму (при использовании плазмы для проведения исследований необходимо помнить о том, что не будут выявляться ком-плементзависимые гемолитические реакции);
при необходимости образцы крови можно использовать для исследований в срок до 48 ч после взятия при условии их хранения при температуре 2—8 °С или замораживать их до температуры -20 °С — -80 °С;
свежевзятые эритроциты, приготовленные из цельной крови на антикоагулянте, можно использовать для исследований в срок до 48 ч после взятия при условии их хранения при температуре 2-8 °С.
эритроциты, взятые из гемоконтейнеров, на ACD, CPD, CPDA и SAG-Mannitol-консервантах, могут использоваться до истечения срока годности, указанного на упаковке гемоконтей-нера при условии его хранения при температуре 2-8 °С.
при использовании эритроцитов, взятых из сегментов гемоконтейнеров, рекомендуется отмыть их физраствором до приготовления суспензии.
Приготовление суспензии эритроцитов для исследования:
Приготовьте 1% эритроцитную суспензию с раствором Bromelin Diana (10 мкл исследуемых эритроцитов добавьте в 1 мл раствора). Смешайте. Инкубируйте 10 мин при комнатной температуре (максимум 30 мин).
Необходимое дополнительное оборудование:
автоматические дозаторы на 10, 25, 40, 50 мкл и 1 мл;
сменные наконечники;
шейкер микроплат;
центрифуга DianaFuge;
стандартные эритроциты Diana A1/B;
раствор Bromelin Diana;
физраствор;
секундомер.
Техника проведения исследования:
Температура образцов исследуемой крови и реагентов должна быть комнатной.
Идентифицируйте (пронумеруйте) каждый образец на микроплате или ряд лунок.
Добавьте 40 мкл 1% суспензии обработанных бромелином исследуемых эритроцитов в соответствующие лунки микроплаты.
Добавьте 50 мкл исследуемой сыворотки или плазмы в лунки А1 и В, а затем добавьте в них же 25 мкл суспензии стандартных эритроцитов Serigrup A1/B.
Восстановите лиофилизированные в лунках сыворотки и смешайте их с исследуемым материалом шейкированием на шейкере в течение 5 мин, на средней скорости.
Инкубируйте микроплату в течение 5 мин при комнатной температуре.
Центрифугируйте в центрифуге DianaFuge.
Встряхните микроплату на шейкере 1-2 минуты на средней скорости (до гомогенизации суспензии в лунке отрицательного контроля).
Встряхните 1-2 минуты на шейкере на самой медленной скорости для концентрирования агглютинации эритроцитов.
Считайте результаты реакции в течение последующих 3 мин и впишите их в прилагаемую таблицу интерпретации результатов, если не используется автоматический ридер.
Оценка результата (табл. 1):
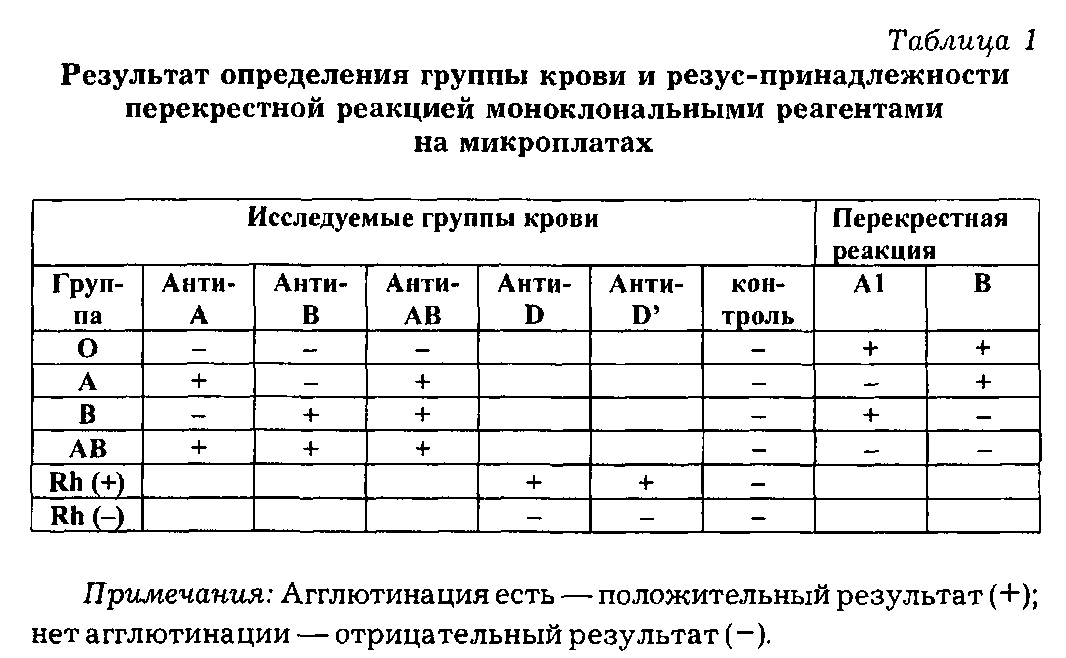
Внимание:
Результат реакции в контрольной микропробирке должен быть всегда отрицательным для правильной интерпретации реакции. Если он положительный, то необходимо отмыть вновь исследуемые эритроциты в физрастворе и приготовить новую эритроцитарную суспензию из них. Если контроль отрицательный, результаты реакции могут быть правильно интерпретированы.
При необходимости проверьте полученные отрицательные результаты в одной или обеих aHTH-D-лунках со специальным анти-D (Du)-peareHTOM.
Контроль качества:
Рекомендуемые процедуры по контролю качества должны проводиться в соответствие с общепринятыми европейскими инструкциями и правилами. Положительные и отрицательные контроли должны проводиться в каждой серии исследований.
Особые условия:
- Бактериальное или иное загрязнение исследуемых образцов или реагентов может приводить к возникновению ложноположительных или ложноотрицательных результатов. Используйте реагенты и материалы только в хорошем состоянии и с неистекшим сроком годности.
Эритроцитарные суспензии для исследований в более высокой концентрации клеток могут приводить к появлению лож-ноположительных или ложноотрицательных результатов.
Использование растворов для приготовления суспензии эритроцитов кроме Bromelin Diana может приводить к искажению результатов реакции.
Прямая реакция определения групповых принадлежностей должна всегда подтверждаться проведением перекрестной реакции со стандартными эритроцитами А1 и В. При любых расхождениях в результатах реакции между прямой и перекрестной необходимо дальнейшее проведение исследований до окончательной идентификации образца.
Исследование ABO/Rh-принадлежности должно проводиться при комнатной температуре.
Исследуемые образцы новорожденных могут давать слабую агглютинацию или отрицательную реакцию.
Образцы взрослых с подгруппами крови А или В или слабыми D-антигенами при длительном хранении в соответствующих условиях могут также давать слабую агглютинацию или ложноотрицательный результат.
При типировании образца пуповинной крови новорожденного необходимо перед исследованием эритроциты отмыть 4-5 раз в физрастворе для предотвращения получения ложных результатов из-за геля Вартона.
Следует учитывать, что реагенты, содержащиеся в данных микроплатах, не являются продуктами крови человека, не содержат возбудителей гепатитов В, С, а также ВИЧ.
1.9 ГЕЛЕВЫЕ ТЕХНОЛОГИИ В ИММУНОГЕМАТОЛОГИИ
Гелевая технология — это современная технология для определения антигенов эритроцитов, скрининга и идентификации антител. В основе — использование комбинации методов агглютинации и гель-фильтрации. Все тесты проводятся в пластиковых диагностических карточках, которые содержат микропробирки, заполненные полиакриламидным гелем. Гель может быть нейтральным либо содержать специфические моноклональные антитела или антиглобулиновый реагент.
Методика: исследуемые эритроциты или стандартные эритроциты и исследуемая сыворотка (плазма) помещаются в соответствующие микропробирки, где происходит реакция агглютинации, затем диагностические карточки центрифугируются для разделения результатов реакции. При этом неагглютинированные эритроциты свободно проходят между частицами геля и образуют осадок на дне микропробирки, в то время как агглютинированные располагаются на поверхности или в толще геля. Расположение агглютинатов в геле определяется силой агглютинации и положительный результат может быть оценен от "+" до "+ + + +". Размер частиц геля позволяет достичь наилучших результатов чувствительности и специфичности, а его прозрачность делает считывание результатов более надежным и позволяет интерпретировать самые сложные диагностические случаи.
В ходе многократных испытаний показано, что гелевая система является более чувствительной, чем традиционные серологические методики, особенно при определении и идентификации клинически значимых антител. Она также позволяет выявить и больший спектр клинически значимых*антител со снижением количества ложноположительных результатов. Устранение этапа отмывания при проведении антиглобулинового теста и стабильность всех реагентов обеспечивают высокий уровень достоверности результатов и увеличивают возможность стандартизации и контроля лабораторных исследований.
Особое значение гелевая методика приобретает при определении слабых антител, которые могут стать сильнее при вторичной стимуляции (например, в течение беременности).
Гелевый тест позволяет автоматизировать оценку результатов реакции гемагглютинации.
Результаты теста могут быть фотокопированы для сохранения их в архиве или служить учебным пособием в сложноди-агностируемых случаях.
Особо актуально использование гелевых технологий в педиатрии, когда получение достаточных количеств материала для других методик затруднено.
Использование гелевой системы позволяет снизить риск заражения персонала даже при работе с потенциально инфицированными образцами.
Пластиковые карты сделаны из биоразлагаемого материала и не загрязняют окружающую среду.
Основные преимущества гелевых технологий:
-отсутствие этапов отмывания эритроцитов;
сокращение времени на проведение полного иммуногема-тологического исследования в 5 раз;
возможность использования небольших количеств крови;
исследование крови, заготовленной на консервантах и стабилизаторах без искажения результатов;
стабильность конечной картины результатов;
объективный учет результатов и их стандартизация;
возможность автоматизации исследований и компьютерной обработки результатов;
высокая чувствительность и специфичность тестов;
длительные сроки хранения карт и реагентов.
2. АЛГОРИТМЫ ВЫПОЛНЕНИЯ ИИИУНОГЕИАТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ В СПЕЦИАЛИЗИРОВАННЫХ ЛАБОРАТОРИЯХ. РЕЦИПИЕНТЫ
Кровь реципиентов для иммуногематологических исследований заготавливается в количестве не менее 5 мл в чистую сухую пробирку или в пробирку с любым консервантом (стабилизатором). Срок хранения крови до исследования не должен превышать 48 ч при температуре +4 °С.

1. Определение группы крови по системе АВО перекрестным методом (см. рисунок).
Наличие слабой агглютинации при выявлении антигена А и/или экстрагглютинина анти-А1 требует дополнительной верификации подгруппы антигена А (А2) с реагентами анти-Al и анти-Н.
2.Определение резус-принадлежности (антиген D).
При определении слабых вариантов антигена D (Du), резус-принадлежность реципиента считается отрицательной. В таких случаях целесообразно выполнить полное типирование эритроцитов реципиента по основным антигенам систем Rh/K для точных рекомендаций по выбору гемотрансфузионных компонентов.
3.Скрининг антиэритроцитарных аллоантител в непрямом антиглобулиновом тесте и солевой реакции с панелью стан дартных эритроцитов, состоящей не менее чем из 3 видов кле ток, типированных по всем клинически значимым антигенам.
Обнаружение антиэритроцитарных аллоантител является показанием к назначению реципиенту индивидуального подбора при трансфузиях эритроцитсодержащих гемокомпонентов.
4.Идентификация антиэритроцитарных аллоантител с па нелью стандартных эритроцитов, состоящей не менее чем из 10 видов клеток, типированных по всем клинически значимым ан тигенам. Типирование антигена (ов) эритроцитов реципиента, к которому (ым) предположительно обнаружены антитела,
Идентификация антител считается завершенной при соответствии результатов реакций с панелью эритроцитов результатам типирования антигенов. В дальнейшем этому реципиенту для переливания выбирают эритроцитсодержащие гемоком-поненты с отсутствием антигена, к которому выявлены антитела, даже если антитела повторно не выявляются.
3. ДОНОРЫ
Кровь доноров для иммуногематологических исследований заготавливается в количестве не менее 5 мл в чистую сухую пробирку или в пробирку с любым консервантом (стабилизатором). Срок хранения крови до исследования не должен превышать 48 ч при температуре +4 °С.
1. Определение группы крови по системе АВО перекрестным методом.
Наличие слабой агглютинации при выявлении антигена А и/или экстрагглютинина анти-А1 требует дополнительной верификации подгруппы антигена А (А2) с реагентами анти-А1 и анти-Н.
2.Определение резус-принадлежности (антиген D, С, Е) эритроцитов.
При наличии слабых вариантов антигена D (Du), резус-принадлежность донора считается положительной. Резус-принадлежность донора считается отрицательной только при отсутствии антигенов D, С, Е.
3.Определение К-принадлежности эритроцитов. Эритроциты К-положительных доноров не выдаются для переливания К-отрицательным реципиентам. Рекомендуется криоконсервирование К-положительных эритроцитов для подбора и выдачи К-положительным реципиентам.
4.Типирование антигенов сие.
Типирование антигенов эритроцитов систем Rh/K производится три раза различными сериями типирующих реагентов. При совпадении результатов Rh/K-фенотип считается установленным и при последующих кроводачах не определяется. Применение гелевой технологии позволяет производить типирование два раза.
5.Скрининг антиэритроцитарных аллоантител в непрямом антиглобулиновом тесте и солевой реакции с панелью стан дартных эритроцитов, состоящей не менее чем из 3 видов кле ток, типированных по всем клинически значимым антигенам.
Обнаружение антиэритроцитарных аллоантител является показанием к выбраковке плазмы и ее компонентов, заготовленных от донора. Допускается донорство эритроцитов. Плазма доноров с аллоантителами может быть использована для изготовления иммуногематологических диагностикумов.
6.Идентификация антиэритроцитарных аллоантител с па нелью стандартных эритроцитов, состоящей не менее чем из 10 видов клеток, типированных по всем клинически значимым антигенам. Типирование антигена (ов) эритроцитов донора, к которому (ым) предположительно обнаружены антитела.
Идентификация антител считается завершенной при соответствии результатов реакций с панелью эритроцитов результатам типирования антигенов.
3.1 БЕРЕМЕННЫЕ ЖЕНЩИНЫ
Кровь беременных женщин для иммуногематологических исследований заготавливается в количестве не менее 5 мл в чистую сухую пробирку или в пробирку с любым консервантом (стабилизатором). Срок хранения крови до исследования не должен превышать 48 ч при температуре +4 °С.
1.Определение группы крови по системе АВО перекрест ным методом.
Наличие слабой агглютинации при выявлении антигена А и/или экстрагглютинина анти-А1 требует дополнительной верификации подгруппы антигена А (А2) с реагентами анти-А1 и анти-Н.
2.Определение резус-принадлежности (антиген D).
При обнаружении слабых вариантов антигена D (Du), резус-принадлежность беременных женщин считается отрицательной. В таких случаях целесообразно выполнить полное типиро-вание эритроцитов по основным антигенам систем Rh/K для точных рекомендаций по выбору гемокомпонентов для возможных трансфузий.
3.Скрининг антиэритроцитарных аллоантител в непрямом антиглобулиновом тесте и солевой реакции с эритроцитами биологического отца ребенка или панелью стандартных эрит роцитов, состоящей не менее чем из 3 видов клеток, типиро- ванных по всем клинически значимым антигенам.
Скрининг антител производится вне зависимости от резус-принадлежности беременной женщины. Обнаружение антиэритроцитарных аллоантител является показанием к определению их титра и назначению повторных исследований в течение беременности для определения динамики титров антител.
При несовместимости крови беременной женщины и биологического отца ребенка по антигенам системы АВО, необходимо проведение скрининга и определения титров иммунных антител системы АВО в динамике.
4. Идентификация антиэритроцитарных аллоантител с эритроцитами биологического отца ребенка и (или) панелью стандартных эритроцитов, состоящей не менее чем из 10 видов клеток, типированных по всем клинически значимым антигенам. Типирование антигена (ов) эритроцитов реципиента, к которому (ым) предположительно обнаружены антитела.
Идентификация антител считается завершенной при соответствии результатов реакций с панелью эритроцитов результатам типирования антигенов. В дальнейшем женщине для переливания выбирают эритроцитсодержащие гемокомпоненты с отсутствием антигена, к которому выявлены антитела, даже если антитела повторно не выявляются. Наличие антиэритроцитарных аллоантител является прогностическим признаком возможного иммуногематологического конфликта матери и плода, чреватого развитием гемолитической болезни плода и новорожденного. В этом случае в индивидуальном подборе по антигенам эритроцитов нуждается как сама беременная женщина, так и плод (новорожденный) при выполнении заменных переливаний.
3.2 НОВОРОЖДЕННЫЕ
Кровь новорожденных для иммуногематологических исследований заготавливается в количестве не менее 5 мл в чистую сухую пробирку или в пробирку с любым консервантом (стабилизатором). Срок хранения крови до исследования не должен превышать 48 ч при температуре +4 °С.
1.Определение группы крови по системе АВО перекрест ным методом.
В норме антитела системы АВО у новорожденных могут отсутствовать. В этих случаях групповую принадлежность определяют по антигенам эритроцитов.
Верификация подгруппы антигена А у детей до 18 месяцев не производится.
2.Определение резус-принадлежности (антиген D),
При обнаружении слабых вариантов антигена D (Du), резус-принадлежность новорожденного считается отрицательной. В таких случаях целесообразно выполнить полное типирование эритроцитов по основным антигенам систем Rh/K для точных рекомендаций по выбору гемокомпонентов для возможных трансфузий.
3.Определение антител, фиксированных на мембране эрит роцитов (прямая реакция Кумбса).
Выполняется новорожденным при подозрении на гемолитическую болезнь (ГБН). Положительный результат прямой реакции Кумбса подтверждает диагноз ГБН, отрицательный же ее не исключает.
4.Скрининг антиэритроцитарных аллоантител в непрямом антиглобулиновом тесте и солевой реакции с панелью стан дартных эритроцитов, состоящей не менее чем из 3 видов кле ток, типированных по всем клинически значимым антигенам.
Скрининг антител производится для установления причин ГБН. Обнаружение антиэритроцитарных аллоантител является показанием к определению их титра и специфичности (идентификации). Одновременно необходимо определять антитела в сыворотке крови матери.
5.Идентификация антиэритроцитарных аллоантител с па нелью стандартных эритроцитов, состоящей не менее чем из 10 видов клеток, типированных по всем клинически значимым ан тигенам. Типирование антигена (ов) эритроцитов реципиента, к которому (ым) предположительно обнаружены антитела,
Идентификация антител считается завершенной при соответствии результатов реакций с панелью эритроцитов результатам типирования антигенов. В дальнейшем ребенку для переливания выбирают эритроцитсодержащие гемокомпоненты с отсутствием антигена, к которому выявлены антитела, даже если антитела повторно не выявляются. В этом случае новорожденный нуждается в индивидуальном подборе по сыворотке матери и собственной сыворотке при выполнении заменных переливаний.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Переливание крови и кровезаменителей в хирургии и педиатрии: Учебное пособие. — М.: Издательско-торговая корпорация «Дашков и К°», 2006. — 128 с. |
 Скачать 5.84 Mb.
Скачать 5.84 Mb.

