Реферат біонанотехнології. Особливості створення трансгенних тварин практична цінність
 Скачать 251.5 Kb. Скачать 251.5 Kb.
|
|
Реферат на тему: «Особливості створення трансгенних тварин: практична цінність» ЗМІСТ Вступ 3 1.Методологія та технологія отримання трансгенних тварин. 4 2.Трансгенні тварини. 16 3.Перспективи і проблеми досліджень з трансгенезу в тваринництві 20 Висновки 22 Список використаної літератури 23 ВступБагатоклітинний організм вищих тварин і рослин є продуктом онтогенетичного розвитку, при якому з однієї клітини (зиготи), що утворилася в результаті злиття двох статевих клітин батьків (гамет), шляхом великого числа поділів утворюється вся сукупність високодиференційованих клітин органів і тканин організму. Оскільки будь-яка соматична клітина або клітина зародкового шляху, в кінцевому рахунку, бере свій початок від двох об'єднаних батьківських клітин, вона, як правило, містить в собі всю (або більшу частину) генетичну інформацію батьківських організмів. Незважаючи на те що ця схема є спрощеною і в міру розвитку диференційованого стану соматичних клітин їх генетичний матеріал часто зазнає незворотньої перебудови (наприклад еритроцити людини взагалі позбавлені ядер), така картина підкреслює спадкоємність генетичного матеріалу в рядах клітинних поколінь соматичних клітин організмів. Майже всі гени зигот мають хороші шанси бути представленими в більшості соматичних клітинах організму і взяти участь у формуванні їх генотипу і фенотипу. Передумови такого роду призвели до думки про можливість зміни фенотипу багатоклітинних організмів шляхом введення нових рекомбінантних генів в геном зигот, ще не зазнали дроблення в ранньому ембріональному розвитку. У разі об'єднання з геномом зиготи нові гени повинні поширитися в ряді клітинних поколінь соматичних клітин і експресуватися в більшості цих клітин. Оскільки, з відомими обмеженнями, весь багатоклітинний організм можна розглядати як клон соматичних клітин, що відбулися від єдиної клітини, поширення рекомбінантних генів, введених в зиготу, в соматичних клітинах організму допустимо розглядати як різновид молекулярного клонування послідовностей ДНК. Такий молекулярно-генетичний підхід до зміни генотипу і фенотипу багатоклітинних організмів був реалізований експериментально в середині 1970-х років. Зараження мишачих ембріонів на передімплантаційній стадії розвитку вірусом лейкозу мишей (MuLV) призводило до утворення дорослих особин, що містять вірусну ДНК, інтегровану в геном як соматичних клітин, так і клітин зародкового шляху, і ця ДНК передавалася з покоління в покоління. Гени, штучно введені в геном багатоклітинних організмів, що передаються від батьків потомству, отримали назву трансгенів, а процес такого введення і передачі генів позначили як трансгеноз, а тварини або рослини, що містять трансгени в геномі своїх клітин, стали називати трансгенними. Розвиток техніки створення трансгенних тварин і рослин призвело до виникнення нового напряму молекулярної генетики, що швидко розвивається. Були отримані унікальні знання про особливості експресії генів і біосинтезі білків в онтогенезі багатоклітинних організмів, а також про можливості зміни фенотипу трансгенних організмів, в тому числі і корекції мутантного фенотипу, і використання трансгенних організмів для вирішення завдань біотехнології, пов'язаних з біосинтезу рекомбінантних білків.
Теоретичні та методичні основи генетичної інженерії тварин розроблені значно менше, ніж мікроорганізмів і рослин. Видоспецифічність об’єктів для перенесення сторонніх генів в геном тварин та механізмів генетичної модифікації пов’язана зі складністю структурної організації і функціонування тварин, наявністю хромосомної обумовленості статі, специфічністю реалізації репродуктивної функції та ембріонального розвитку. Існують різні модельні системи генетичної інженерії тварин, розроблені на модельних об’єктах: нематоді (Caenorhabditis elegans), дрозофілі (Drosophila melanogaster), миші (Mus musculus) та деяких інших. У нематоди рекомбінантна ДНК за допомогою шприцу або мікропіпетки ін’єктується безпосœередньо в організм тварини. Для успішного проведення генетичної трансформації необхідне знання репродуктивної біології нематоди. Гонада нематоди представляє собою синцитій – багатоядерну клітину. Синцитій нематоди містить більше 100 ядер на різних стадіях. Ядра в одній частині синцитію ще не вступили в мейоз, в іншій містяться ядра, що вже завершили мейоз, є гаплоїдними і можуть приймати участь у заплідненні. Таким чином, якщо рекомбінантна ДНК вводиться в синцитій, то одразу більше 100 ядер потрапляють під вплив трансформуючої ДНК. Деякі з них поглинають ДНК. Зазвичай стороння ДНК формує або багатокопійні екстрахромосомні утворення, тобто присутня в ядрі поза межами хромосом. Рідко трансгени вбудовуються в хромосому ектопічно, часто багатокопійно. Технологія генетичної трансформації миші розроблялася для потенційного використання у ссавців, в тому числі людини. Існують дві стратегії генетичної трансформації для миші. Перша – це ектопічні вставки, коли трансгени потрапляють у випадкові місця геному, зазвичай багатокопійно. Для виконання генетичної трансформації рекомбінантна ДНК шляхом мікроін’єкції вводиться в ядро зиготи. Далі декілька оброблених зигот підсаджуються в матку, де розвивається плід. У кожному випадку трансген вбудовується в різні хромосоми або в різні місця однієї хромосоми, що призводить до розщеплення за трансгеном в потомстві. Такий підхід має деякі проблеми, пов’язані з порушенням експресії трансгена внаслідок ефекту положення та з інших причин, але стратегія ектопічних вставок доволі ефективна і не трудомістка.[1] Друга стратегія – таргетинг генів. За цієї стратегії трансгенна послідовність вставляється у місце, зайняте гомологічною послідовністю в геномі, тобто трансген заміщує власний ген. Ця стратегія дозволяє елімінувати або модифікувати функцію, яка кодується певним геном організму. Таргетинг генів доцільно застосовувати, коли потрібно інактивувати мутантний алель або виправити його на алель дикого типу. Виправлення мутантного алеля на алель дикого типу відбувається шляхом генного заміщення. При цьому трансген однокопійно вбудовується в свій локус на відповідній хромосомі. Для миші таргетинг генів здійснюють в ембріонально-стовбурових клітинах. Ембріонально-стовбурові клітини здатні розвиватися в клітини будь-якого типу, в тому числі і в клітини зародкової лінії. Після генетичної трансформації ембріонально-стовбурових клітин на селективних середовищах з безлічі трансформованих відбирають ті клітини, де вставка відбулася шляхом генного заміщення, тобто алель дикого типу замістив собою мутантний алель цього ж гена. Далі відселектовані трансформовані ембріонально-стволові клітини ін’єктують у зародок на ранніх стадіях розвитку. Дорослі особини, які виросли з таких зародків, схрещують з нормальними мишами. Отримане потомство є химерним, оскільки організм має певні тканини від оригінальних, нетрансгенних особин і деякі від трансгенних ембріонально-клітинних ліній. Хімерні миші далі схрещуються з їх сибсами для отримання гомозиготного потомства з нокаутованою (knockout), тобто інактивованою копією кожного гена. Мишей, які містять цільовий трансген в кожній клітині, ідентифікують молекулярно-генетичними методами аналізу. Методика таргетингу генів має важливе значення для генної терапії, сутність якої як раз і полягає у заміні мутантного алеля алелем дикого типу шляхом генного заміщення. На відміну від рослин, де існує можливість отримання цілого фертильної рослини з однієї трансформованої соматичної клітини, отримання трансгенних тварин - дуже складний і тривалий процес. Використовувана стратегія полягає в наступному: 1. Клонований ген вводять в ядро заплідненої яйцеклітини. 2. Запліднені яйцеклітини з екзогенної ДНК імплантують в рецепієнтную жіночу особину (оскільки успішне завершення розвитку ембріона ссавців в інших умовах неможливо). 3. Відбирають нащадків, які розвинулися з імплантованих яйцеклітин, та які містять клонований ген у всіх клітинах. 4. Схрещують тварин, які несуть клонований ген в клітинах зародкової лінії, і отримують нову генетичну лінію. Експерименти по генетичній модифікації багатоклітинних організмів шляхом введення в них трансгенів вимагають багато часу. Проте, трансгеноз став потужним інструментом для дослідження молекулярних основ експресії генів ссавців і їх розвитку, для створення модельних систем, що дозволяють вивчати хвороби людини, а також для генетичної модифікації клітин молочних залоз тварин з метою отримання з молоком важливих для медицини білків. Був навіть запропонований новий термін «фарминг» (pharming), що відноситься до процесу отримання з молока трансгенних домашніх тварин автентичних білків людини або фармацевтичних препаратів. Незважаючи на те, що перші трансгенні сільськогосподарські тварини були отримані в 1985 р введенням екзогенної ДНК в пронуклеус зигот, до теперішнього часу не розроблено ефективного методу, який би міг бути використаний для створення генетично модифікованих тварин незалежно від виду і від цілей експерименту. Розробка нових ефективних методів переносу генів в ембріональні і соматичні клітини тварин, а також вдосконалення існуючих підходів залишається актуальним завданням. Методи трансгенеза тварин - це створений з різних молекул ДНК-гібридний (рекомбінантний) ген. Трансгени - це введений штучно і закріплений в ДНК тварини чужорідний ген. А трансгенез – це процес інтеграції і перенесення в геном тваринного чужорідної генетичної інформації. Серед великої різноманітності способів впровадження екзогенної ДНК в геном тварини можна виділити наступні, які знайшли широке застосування в практиці трансгенозу:
Метод мікроін'єкції. Вперше для отримання трансгенних тварин був використаний саме метод мікроін'єкції. Це сталося в 1985 році одночасно в двох дослідницьких лабораторіях. Одна з них належала США, інша перебувала в Німеччині. В даний час цей метод є найбільш часто використовуваних. Спосіб мікроін'єкції заснований на введенні розчину генних конструкцій в чоловічій пронуклеус (попередник ядра) зигот. При заплідненні в яйцеклітині утворюються два ядра, одне з яких чоловіче (чоловічий пронуклеус), інше - жіноче (жіночий пронуклеус). Чоловічий і жіночий пронуклеус після зближення об'єднуються в загальне ядро зі об'єднанням батьківських і материнських хромосом в один генотип ембріона. Про успішність мікроін'єкції можна судити по збільшенню обсягу пронуклеуса в 1,5 рази. Коли процедура завершується, отримані ембріони кілька годин культивуються, а потім підсаджуються в матку одночасно кільком самкам. Після народження потомства проводиться аналіз на інтеграцію трансгену шляхом відбору проб. Число трансгенних малюків від загального числа народжених за допомогою даного методу потомства досить незначно. У піддослідних мишей це приблизно 15%, у свиней - від 10 до 15%, у овець, кіз і великої рогатої худоби цей показник лави. 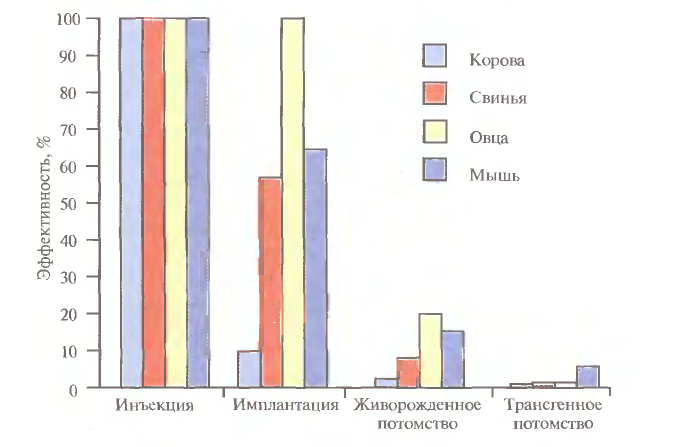 Рисунок 1. Сумарна ефективність трансгенозу після мікроін'єкцій. Всі запліднені яйцеклітини (100%) корови, свині, вівці і миші інокулював трансгенних, проте успішна імплантація і поява потомства були рідкісними подіями: трансгенну потомство давали менше 5% оброблених яйцеклітин. Метод використання ретровірусних векторів. Більш простим способом доставки чужорідних генів в геном тварини-реципієнта є використання векторів на основі вірусів. В цьому випадку ембріони на ранній (восьмиклітинній) стадії розвитку інкубують в культуральному середовищі в присутності фібробластів, в яких утворюються рекомбінантні ретровіруси, і після зараження такими вірусами ембріони пересаджують псевдовагітним самкам мишей, де вони продовжують свій розвиток. Ретровіруси можуть бути екотропними, тобто здатними відтворюватися в клітинах одного виду тварин або декількох споріднених видів. Наприклад, вірус лейкимії миші може розмножуватися тільки в клітинах миші або щура. Амфотропні ж віруси здатні до поширення в багатьох видах тварин. Ретровірус проникає в клітину за допомогою мікропіноцитозу – транспорту невеликих за розміром молекул. У одних вірусів транскрипція відбувається в ядрі клітини, у інших - в цитоплазмі. Якщо інтеграція трапляється в геномі генеративних клітин, то ретровіруси передаються потомству у спадок. Тут йде мова про ендогенні ретровіруси. Вперше вірусна ДНК була виявлена в клітинах дорослої миші в 1974 році. Інфекція зигот в більшості випадків призводить до отримання трансгенних тварин, так як інтеграція можлива, якщо клітина вступає в непрямий поділ після реплікації ДНК. Переваги використання ретровірусних векторів: Майже 100% ембріонів, оброблених ретровірусом, можуть бути інфіковані. Стає можливим проведення генною терапією спадкових захворювань. Ретровіруси уможливлюють трансформацію окремих органів (наприклад, молочних залоз для підвищення видою). [2] Крім простоти одним з переваг даного способу введення ДНК є те, що в геном клітин зародків інтегрується, як правило, одна копія досліджуваного гена, фланкованого довгими кінцевими повторами вірусної хромосоми, що може сприяти ефективній експресії гена. Однак до недоліків методу слід віднести необхідність проведення додаткових генно-інженерних маніпуляцій при підготовці ретровірусного вектора, обмежену ємність вектора (розмір вставки - до 10 т.п.о.), внаслідок чого трансген може виявитися позбавленим прилеглих регуляторних послідовностей, необхідних для його експресії, і мозаїцизм утворених трансгенних тварин, які складаються з клітин як містять, так і не містять трансгени. Використання ретровірусних векторів має і ще один великий недолік. Хоча ці вектори створюються так, щоб вони були дефектними по реплікації, геном штаму ретровірусу (вірусу-помічника), який необхідний для отримання великої кількості векторної ДНК, може потрапити в те ж ядро, що і трансгени. Незважаючи на всі вжиті заходи, ретровіруси-помічники можуть реплікуваться в організмі трансгенної тварини, що абсолютно неприпустимо, якщо цих тварин передбачається використовувати в їжу або як інструмент для отримання комерційного продукту. І оскільки існують альтернативні методи трансгенозу, ретровірусні вектори рідко використовуються для створення трансгенних тварин, що мають комерційну цінність Недоліки використання ретровірусних векторів: Обмежена ємність. Придушення експресії трансгенів in vivo. Низький титр (вирішена за допомогою псевдотипуванін). Можливість клітинних онкогенів. Неможливість передачі у спадок трансформації окремих органів. Використання модифікованих ембріональних стовбурових клітин. Клітини, виділені з мишачих ембріонів на стадії бластоцисти, можуть пролиферировать в культурі, зберігаючи здатність до диференціювання в будь-які типи клітин, в тому числі і в клітини зародкової лінії, при введенні в інший ембріон на стадії бластоцисти. Такі клітини називаються плюрипотентними ембріональними стовбуровими клітинами (ЕS). ЕS-клітини в культурі легко модифікувати методами генної інженерії без порушення їх плюріпотентності. Наприклад, в певний сайт несуттєвого гена в їх геномі можна вбудувати функціональний трансген. Потім можна відібрати змінені клітини, культивувати їх і використовувати для отримання трансгенних тварин (рис. 4). Це дозволяє уникнути випадкового вбудовування, характерного для методу мікроін'єкцій і ретровірусних векторних систем. Рекомбінантні гени вводять в такі клітини будь-яким з вищезгаданих способів, а крім того, eлектропорацією або іншими стандартними методами, застосовуваними для доставки генів в культивовані соматичні клітини. При цьому разом з досліджуваними генами можливе введення селектуючих маркерів, які дозволяють проводити відбір клітин, що експресують дані маркери і, отже, гарантовано містять зчеплені з ними досліджувані гени. Відібрані таким чином клітини переносять в бластоцисти ембріонів, що розвиваються або використовують для отримання агрегаційних химер об'єднанням їх з клітинами восьмиклітинних ембріонів з подальшою пересадкою ембріонів псевдовагітним самкам. При трансфекції ЕS-клітин в культурі вектором, призначеним для інтеграції в специфічний хромосомний сайт, в деяких клітинах ДНК вбудовується випадковим чином, в інших вбудовування відбувається в потрібний сайт, в більшості ж ЕS-клітин інтеграції взагалі не відбувається. Для збільшення числа клітин першого типу використовують так звану позитивно-негативну селекцію. Ця стратегія полягає в позитивній селекції клітин, які мають векторну ДНК, вбудувати в потрібний сайт, і негативної селекції клітин з векторної ДНК, інтегровану в випадковий сайт.[1] Сайт-мішень повинен перебувати в такій області геномної ДНК, що не кодує важливих білків, щоб інтеграція чужорідної ДНК не вплинула на процеси розвитку або клітинні функції. Крім того, важливо, щоб вбудовування трансгену не блокувало трансляцію відповідного ділянки геному. Пошук подібних сайтів ведеться безперервно. Електропорація: метод заснований на здатності клітинної мембрани, ставати проникною для екзогенних молекул ДНК під дією імпульсів високої напруги. Коли відмінності в потенціалах на зовнішньої і внутрішньої поверхні мембрани перевищать певний рівень, формуються тимчасові пори, через які здатні проходити екзогенні молекули. Зміна кількості пір в мембрані можна зупинити за умови, що величина або тривалість імпульсів високої напруги не перевищить критичної межі. Розмір пір залежить від довжини імпульсів, сили електричного поля, а також іонного складу середовища. Електропорація була проведена, наприклад, для ембріонів креветки і молюсків. Недоліком використання електропорації є поступова деградація і зменшення експресії трансгена з часом. Біобалісти трансформація: суть методу біобалістичної трансформації полягає в тому, що на найдрібніші частинки вольфраму, платини або золота, діаметром від 0,1 до 3,5 мкм, напилюється векторна ДНК, що містить необхідну для трансформації генну конструкцію. Вольфрамові, платинові або золоті частинки, що несуть ДНК, на целофановій підкладці поміщаються всередину біобалістичної гармати. Суспензія тварин клітин або ембріонів, на ранній стадії розвитку, поміщається під біобалістичну гармату на відстані 10-25 см. У гарматі вакуумним насосом зменшується тиск до 0,1 атм. У момент скидання тиску частинки металу з величезною швидкістю викидається з гармати і, пробиваючи мембрани, входять в цитоплазму і ядра клітин. Зазвичай клітини, розташовані безпосередньо по центру, гинуть через величезну кількість і тиск частинок металу, в той час як в зоні 0,6-1 см від центру знаходитимуться трансформовані клітини (Рис.3). Далі клітини або ембріони тварин переносять на середу для подальшого культивування та регенерації. Бомбардування мікрочастинками була використана, наприклад, для трансформації запліднених яйцеклітин креветки, морського їжака. Відсоток тих, хто вижив клітин після бомбардування становить приблизно 70%, а також була доведена експресія трансгена у деяких різновидів риб. Головною перевагою даного методу є висока ефективність вбудовування векторної ДНК, а також те, що можна отримати трансгенні клітини в найкоротші терміни. Істотним недоліком цього методу є те, що ембріони, які зазнали бомбардування, досить рідко розвиваються в повноцінних дорослих особин, більшість з них рано чи пізно гине. Ліпофекція ліпосоми – це сферичні утворення, оболонки яких складаються з фосфоліпідів. Їх можна отримати в результаті різкого струшування або обробки ультразвуком водних емульсій фосфоліпідів. Метод ліпофекції заснований на взаємодії між позитивно зарядженими молекулами фосфоліпідів, з яких складаються ліпосоми, і негативно зарядженими молекулами ДНК. В даний час запропоновані три моделі асоціацій між ДНК і фосфоліпідами. Суть першої моделі полягає в тому, що позитивно заряджені ліпосоми приєднуються до негативно зарядженим молекулам ДНК. Число ліпосом, які приєдналися до ДНК, залежить від розмірів молекули нуклеїнової кислоти. У другому випадку молекули ДНК "проковтуються" ліпосомами, тобто ДНК електростатично взаємодіють з внутрішньою поверхнею ліпосоми. У третьому випадку молекула ДНК оточена декількома молекулами фосфоліпідів, які формують своєрідну стрічку з нуклеїнової кислотою.[3] Метод пересадки ядер клітин. Його особливістю якого є використання трансформованих клітинних ліній для отримання трансгенних особин за допомогою генних конструкцій. Для цього беруться стовбурові лінії, а також соматичні клітини, які культивуються in vitro, тобто в пробірці. Одним з методів пересадки ядер є метод мікроманіпуляції, і полягає він в наступному: за допомогою мікропіпетки відбувається вилучення пронуклеусів після того, як відбулося проколювання зон пеллюціда і зон плазматичної мембрани. Піпеткою з великим діаметром в той же прокол вводиться ядро з повним набором хромосом від донора. За допомогою такого методу цитоплазма зиготи травмується набагато менше, як і донорське ядро. Існує ще один спосіб трансплантації ядра, який полягає у використанні для цієї мети цитохалазинів, тобто речовин, які синтезовуються за допомогою грибів. Структура мікроферментів (ниток, що складаються з молекул глобулярного білка актину) руйнується цитохалазином В, після чого ядро може бути розташоване унікальним чином. Ядро за допомогою тоненької нитки цитоплазми залишається з'єднаним з клітиною. Потім цей зв'язок штучно розривається за допомогою центрифугування. Утворюються цитопласти (клітини без ядра) і каріопласти (ядра, оточені цитоплазмою). У градієнті щільності цитопласти відокремлюються від інтактних клітин, і можуть бути використані для з'єднання з каріопластами інших клітин, щоб вийшла життєздатна клітина. Перенесення генів за допомогою штучних дріжджових хромосом. Хромосоми вищих організмів містять в своєму складі протяжні молекули ДНК. Наприклад, довжина ДНК однієї з типових хромосом людини становить 100-200 мільйонів пар основ (м.п.о.). Дослідження генів в хромосомах вищих рослин, тварин і людини зажадало створення векторів для клонування фрагментів ДНК довжиною в кілька сотень тисяч пар основ. Цим завданням відповідає нещодавно створена система для клонування наддовгих молекул ДНК на основі штучно отриманої міні-хромосоми дріжджів YAC (yeast artificial chromosome). YAC-вектор являє собою кільцеву молекулу ДНК, що містить ряд генетичних елементів, які дозволяють їй існувати в позахромосомних стані в клітинах дріжджів. Вектор містить в собі дві теломірні послідовності нуклеотидів TEL, необхідні для реплікації кінців міні-хромосоми, і область початку реплікації ARS1, з'єднану з послідовністю центромери. Всі ці функціональні елементи потрібні для реплікації YAC-вектора і його правильної передачі в дочірні ядра під час мітозу. Крім того, вектор містить два селектуючих маркера TRP, відновлюють здатність до зростання ауксотрофності по триптофану клітин дріжджів за відсутності екзогенного триптофану, а також маркер URA3, що компенсуючий генетичний дефект клітин дріжджів, який порушує біосинтез урацила. У векторі є також ген супрессорной тРНК sup4, що є селектіруемих маркером для підтримки вектора в мутантних бактеріальних клітинах, що містять амбер-мутації в життєво важливих генах. Крім цього, він володіє послідовностями нуклеотидів, необхідними для його реплікації в бактеріальних клітинах.[1] При підготовці до клонування YAC-вектор, виділений у вигляді плазміди, розщеплюють рестриктазой BamHI і відокремлюють від утвореного короткого фрагмента ДНК, який не потрібно для реплікації YAC-вектора в дріжджах (етап 1). Після цього проводять друге розщеплення вектора рестриктазой EcoRI, що супроводжується утворенням двох його "плечей", кожне з яких на одному з кінців містить теломерні послідовності хромосоми дріжджів (етап 2). На заключному етапі (3) отримані "плечі" лігують з великими EcoRI-фрагментами клонуюючої ДНК, які отримують шляхом часткового розщеплення високомолекулярної хромосомної ДНК, призначеної для клонування. Отриманими таким чином рекомбінантними ДНК трансформують протопласти клітин дріжджів, і утворені трансформанти відбирають на селективному твердому живильному середовищі. В такому векторі вдавалося здійснювати клонування фрагментів ДНК довжиною до 700 т.п.о. При всіх своїх перевагах системи клонування, засновані на векторах сімейства YAC, мають ряд суттєвих недоліків. У рекомбінантних ДНК, підтримуваних в таких системах, часто виникають внутрішні делеції. Крім того, при введенні рекомбінантних ДНК в клітини дріжджів іноді має місце проникнення в одну клітину декількох молекул вектора зі вставками. В результаті окремі клони дріждєвих клітин можуть містити кілька незчеплених один з одним молекул рекомбінантних ДНК, а рекомбінація між ними взагалі може призводити до утворення химерних молекул. Все це дуже ускладнює фізичне картування генів в хромосомах досліджуваних об'єктів. 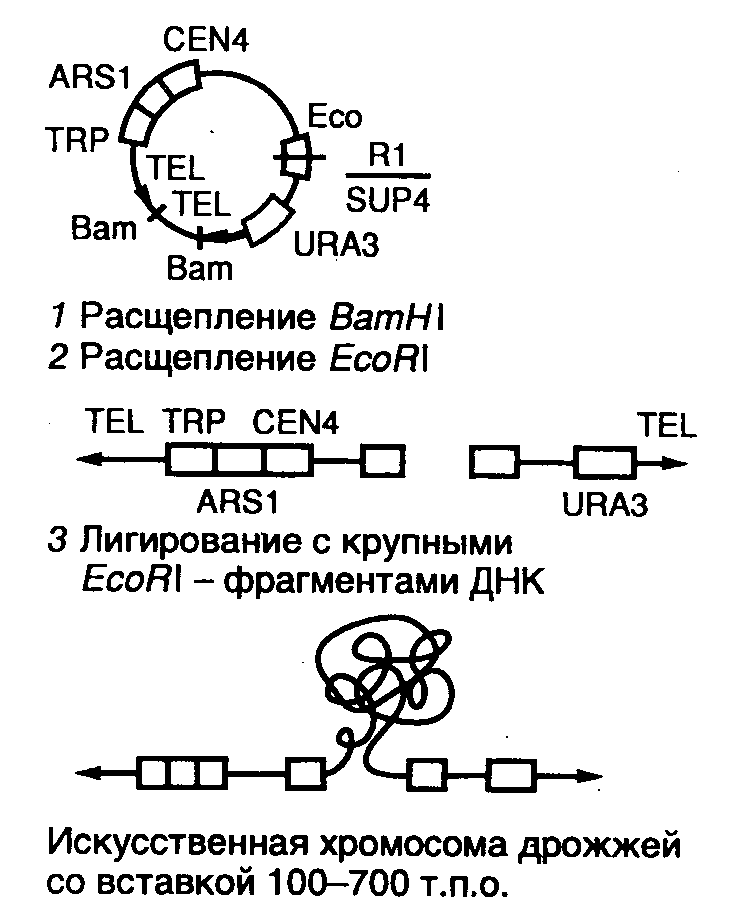 Рисунок 2. Схема клонування наддовгих молекул ДНК з використанням вектора YAC, 1 - лінеаризація ДНК вектора рестриктазой BamHI; 2 - розщеплення лінеаризованої ДНК вектора рестриктазой EcoRI з утворенням "плечей"; 3 - введення в вектор клонуючого EcoRI-фрагмента ДНК. Метод ліпосом - переносників ДНК. Це найбільш нешкідливий метод трансгенеза. Його особливість полягає в використанні ліпосом для збереження і перенесення в них генів. Ліпосоми створюються з різними властивостями. Вони не є іммуногенами і не володіють токсичністю. Однак даний метод не є ефективним, тому що ДНК, транспортувана таким чином в клітину, відразу ж захоплюється лізосомами і руйнується ними.[4] Метод використання статевих клітин сім'яників. Сперматозоїди - це природний вектор, який транспортує ДНК в клітину. Але проведені в цій області дослідження показали неоднозначні результати методу. В експериментах М. Lavitrano в 1989 році 30% піддослідних мишей, які були отримані за допомогою ін'єкцій змінених сперматозоїдів в незапліднені яйцеклітини миші, виявилися трансгенними і могли передавати трансгени у спадок. В іншому випадку безліч спроб повторити цей результат в інших лабораторіях не увінчалися успіхом, при подібних умовах були отримані різні результати. З усього цього можна зробити припущення, що вдала трансформація ДНК спостерігається тільки на певній стадії клітинного циклу. До цих пір ведуться дослідження в області визначення механізму вбудовування екзогенної ДНК в геном сперматозоїда. Можливість використання після кріоконсервації сперматозоїдів є позитивною стороною даного методу. Негативною ж стороною вважається велика кількість мікроманіпуляцій, необхідних при трансгенезу за допомогою цього способу. Але все ж сперматозоїди мають здатність поглинати ДНК і накопичувати її в ядрі. Для досягнення більшого ефекту з'єднання ДНК зі сперматозоїдом існує кілька методів: ліпосомний, ін'єкція в сіменники, в сім'яні канальці за допомогою створення пор в ліпідній мембрані під дією електричного поля.[1]
Біореакторами називають організми, продуценти лікарських білків. Біореактори можуть бути будь-які живі організми – бактерії, гриби, рослини, тварини – і навіть клітинні культури. У кожного з таких організмів-біореакторів є переваги і недоліки. Бактерії, наприклад, легко модифікуються методами генної інженерії, швидко розмножуються і їх зручно використовувати в промислових біотехнологічних установках. Таким методом виробляють генно-інженерний інсулін людини. Незважаючи на активний розвиток біотехнології в останні десятиліття, основним джерелом багатьох необхідних фармакології лікарських білків людини є донорська кров. Це фактори згортання крові – фібріоноген, антитромбін, альбумін, імуноглобуліни та інші білки, без використання яких важко уявити собі сучасну медицину. Достатня кількість якісних і дешевих лікарських білків людини могло б врятувати багатьох пацієнтів. Це завдання і лягла в основу робіт з отримання трансгенних тварин – продуцентів білків людини.[5] Стратегія цих робіт така: отримати трансгенну тварина, у якої чужий ген експресується в клітинах молочної залози і продукт роботи цього гена виділяється в молоко. Тоді отримання лікарського білка зведеться лише до процесу доїння. Трансгенні тварини дозволять вирішити і ще одну проблему – проблему очищення лікарських білків. Навіть якщо після очищення в препараті залишаться домішки, це будуть нетоксичні для людини білки молока. Створення тварин - генетичних моделей спадкових захворювань людини. Багато хвороб мають спадкові чинники. І це стосується не тільки моногенних захворювань, що відбуваються через мутації в якомусь одному певному гені. Часто причиною захворювання є цілий комплекс порушень геному: присутність алелей, що визначають схильність до захворювання, гіперфункція будь-яких генів через наявність додаткових копій цього гена або порушень в його регуляції і по багатьом іншим, але генетично зумовленим причин. До цієї групи відносяться велика частина захворювань серцево-судинної і нервової систем, багато ендокринні захворювання. Часто важко встановити конкретну причину захворювання, співвіднести виявлені у пацієнта генетичні дефекти з його анамнезом. В останні 10 років для вирішення цих питань все частіше залучаються трансгенні моделі спадкових захворювань людини. Трансгенні миші можуть служити модельними системами для вивчення хвороб людини і тест-системами для дослідження можливості синтезу продуктів, що представляють інтерес для медицини. Використовуючи цілих тварин, можна моделювати і виникнення патології, і її розвиток. Однак миша - не людина, хоча вона теж відноситься до класу ссавців, тому дані, отримані на трансгенних моделях, не завжди можна екстраполювати на людину в тому, що стосується медичних аспектів. Якщо передбачається використовувати молочну залозу як «біореактора», то найкращим тваринам для трансгенозу є велика рогата худоба, яка щорічно дає до 10 000 л молока, що містить приблизно 35 г білка на 1 л. Якщо в молоці міститиметься така кількість рекомбінантного білка та ефективність його очищення складе 50%, то від 20 трансгенних корів можна буде отримувати приблизно 100 кг такого білка в рік. Одна з цілей трансгенозу великої рогатої худоби - зміна змісту в молоці різних компонентів. Так, кількість сиру, одержуваного з молока, прямо пропорційно вмісту в ньому κ-казеїну, тому дуже перспективним видається збільшення кількості синтезованого κ-казеїну за допомогою гіперекспрессіі трансгену цього білка. Далі, якщо забезпечити експресію гена лактази в клітинах молочної залози, то можна буде отримувати молоко, що не містить лактози. Таке молоко незамінне для багатьох людей, що не переносять лактозу; після прийому молока або молочних продуктів у них виникає серйозний шлунковий розлад. Трансгеноз великої рогатої худоби - це дуже перспективний підхід, але створення великого числа трансгенних тварин потребує часу, адже для того щоб виростити статевозрілу тварину з заплідненої яйцеклітини, потрібно приблизно 2 роки.[1] При введенні свиням трансгени бичачого гормону росту під контролем промотора металлотіонеінов несприятливі ефекти спостерігалися. Кількість гормону у різних особин в групі трансгенних свиней відрізнявся, проте в цілому вся ця група швидше додавала у вазі. На жаль, цей позитивний результат частково знецінювався різними патологіями: у тварин відзначалися виразка шлунку, ниркова недостатність, кульгавість, запалення перикарда, зменшення рухливості суглобів, схильність до пневмонії. Причини цих симптомів невідомі. Можливо, вони пов'язані з довготривалою присутністю в організмі надлишку гормону росту. У цих експериментах трансгени синтезувалися більш-менш безперервно. Були створені також трансгенні вівці з підвищеною швидкістю росту вовни. Для цього кДНК овечого інсуліноподібного фактору росту I була поміщена під контроль мишачого промотора гена кератину з високим вмістом сірки, що забезпечувало гіперекспрессію кДНК. При цьому у трансгенних овець на відміну від свиней ніяких небажаних побічних ефектів не спостерігалося. Деякі позитивні результати були отримані і в ході експериментів з трансгенними свинями. Наприклад, були створені здорові трансгенні свині, в геномі яких присутня наступна генетична конструкція: регуляторна область гена β-глобіну людини, два гена α1-глобіну людини і один ген βА-глобіну людини. В результаті її експресії в клітинах крові свиней синтезувався людський гемоглобін, при цьому в результаті заміни людського промотора гена β-глобіну свинячим людський гемоглобін синтезувався в значно більшій кількості. Людський гемоглобін, що продукувався трансгенними свинями, володів такими ж хімічними властивостями, що і природний людський. Його можна було очистити від гемоглобіну свиней звичайної хроматографією.[6] У міру виснаження природних рибних запасів все більшу роль буде набувати розведення риби в штучних умовах. Основна мета досліджень в цій області - створення рекомбінантних риб шляхом трансгенозу. До теперішнього часу трансгени вводили мікроін'єкцією ДНК або електропорація запліднених яйцеклітин різних видів риб - коропа, зубатки, форелі, лосося і т. д. Оскільки у риб пронуклеус в заплідненоій яйцеклітині погано помітний в звичайний мікроскоп, лінеаризовану трансгенну ДНК вводять в цитоплазму запліднених яйцеклітин або клітин ембріонів, які досягли стадії чотирьох бластомерів. Ембріогенез у риб протікає у водному середовищі поза організмом, тому в імплантації немає необхідності. Всі подальші процеси можуть протікати в резервуарах з регульованою температурою. Виживання ембріонів риб після мікроін'єкцій досить висока, від 35 до 80%, а частка трансгенних нащадків коливається від 10 до 70%. Трансгени можна виявити за допомогою ПЛР з використанням яких препаратів еритроцитів зародків, або сумарної ДНК. Схрещуючи трансгенних риб, можна вивести трансгенні лінії.
При подальшому розвитку трансгенних технологій можлива поява абсолютно нових галузей їх використання. Багато з цих напрямків здаються абсолютно фантастичними, проте саме сьогодні розробляються стратегічні підходи для цих напрямків досліджень і майбутні можливості активно обговорюються в наукових виданнях. В основі здебільшого цих прогнозів - створення трансгенних тварин, у яких одні гени нокаутовані, а інші, навпаки, введені до складу геному. Створення таких мультитрансгенних тварин і передбачається в найближчому майбутньому. Отримання модифікованого молока. Перший варіант - створення тварин, які продукують молоко, за своїм складом максимально наближене до материнському молоку людини. Для цього треба вимкнути кілька генів корови і ввести в її геном кілька генів людини. При роботі з ембріональними стовбуровими клітинами це виглядає цілком здійсненним - можливо, перші такі тварини з'являться через 10-15 років.[1] Створення трансгенних тварин, джерел органів для пересадки людині. Цей уявний зовсім фантастичним проект по своїй складності приблизно такий же, як і попередній, але набагато більш актуальний. У світі існує величезна потреба в донорських органах. Багато хворих, роками сподіваються на пересадку нирки або серця, так і не встигають дочекатися своєї черги. Рішенням цієї проблеми могла б бути пересадка людині органів тварин. Так, наприклад, органи свині підходять людині з своєю будовою, розміром і багатьма біохімічним показниками. Але такі пересадки неможливі, так як ці органи будуть негайно відторгнуті імунною системою пацієнта. Для того щоб уникнути цього, треба сконструювати трансгенну свиню, у якій нокаутовані власні гени гістосумісності і замість них введені гени гістосумісності людини. Ці гени розташовуються компактно в локусах гістосумісності, і при проведенні генного нокауту можна вимкнути відразу кілька генів. Перші такі тварини, швидше за все, теж будуть отримані до кінця першого десятиліття XXI століття. Клонування трансгенних тварин. Створення трансгенних тварин - дуже трудомісткий процес. Так, за статистикою на одну трансгенну тварину вдається отримати на 40 ін'єктовані зигот миші, або на 100 зигот вівці або кози, або на 1500 зигот корови. З цих трансгенних тварин не більше 50% експресують трансгенний білок. При отриманні тварин продуцентів білків людини тільки у деяких особин рівень експресії трансгена в клітинах епітелію молочної залози досить високий. Можливий і такий варіант - ген експресується, але трансгенний білок з яких-небудь причин не виділяється в молоко. Якщо навіть вдається отримати трансгенну тварина, ідеальне за всіма параметрами, то його нащадки далеко не завжди будуть нащадками його якостей. Тому великий інтерес біотехнологів викликають роботи з клонування ссавців [6]. Ця методика в майбутньому дасть можливість знову і знову клонувати ідеальна тварина-продуцента і повністю забезпечити потреби медицини і фармакології в необхідних людських білках. Швидше за все, для трансгенних тварин будуть знайдені і інші області застосування, але вже зараз ясно одне: в XXI столітті використання трансгенних тварин буде настільки ж поширеною технологією, як використання мікроорганізмів в біотехнологічних виробництвах кінця XX століття. ВисновкиГенетична модифікація тварин за допомогою технології рекомбінантних ДНК (трансгенозу) заснована на введенні клонованого гена(ів) в геном клітини, яка могла б дати початок клітинам зародкової лінії. Схрещуючи трансгенних нащадків, що з'явилися в результаті такої операції, можна отримати гомозиготні лінії трансгенних тварин. Більшість досліджень у цій області проводилося на мишах. Зазвичай для цього вводили клонований ген в запліднену яйцеклітину миші за допомогою мікроін'єкції, імплантували її в реципієнтную самку і перевіряли потомство на наявність введеного гена. Чужорідний ген можна вводити в запліднену яйцеклітину миші і за допомогою ретровірусного вектора. Альтернативний підхід полягає у виділенні мишачих ембріональних стовбурових клітин і трансфекції їх клонованою геном. При цьому вводиться конструкція повинна інтегруватися в геном стовбурових клітин. Клітини, які несуть ген-мішень у певному хромосомному сайті, відбирають і культивують, а потім вводять їх в мишачі ембріони на ранніх стадіях розвитку. Мишачі ембріональні стовбурові клітини плюрипотентні, тобто, можуть дати початок клітинам будь-якого типу, в тому числі і клітинам зародкової лінії. Для трансгенозу використовують також штучні дріжджові хромосоми (YAC), що несуть безліч генів. Таким чином були отримані миші, які синтезують тільки людські антитіла. Їх використовували в якості модельних систем для вивчення генетичних хвороб людини (наприклад, хвороби Альцгеймера). За допомогою аналогічних експериментальних підходів були отримані трансгенні корови, вівці, свині, птиці та риби. Є надія, що трансгеноз дозволить покращувати генотип існуючих порід домашньої худоби і виводити породи тварин з новими ознаками. Крім того, можливо, таких домашніх тварин, як корови, вівці і кози, вдасться використовувати в якості своєрідних «біологічних фабрик» для отримання продуктів клонованих генів, секретується в молоко. Список використаної літератури
Харків 2018 |
