ОКС. Реферат ОКС. Острый коронарный синдром
 Скачать 53.34 Kb. Скачать 53.34 Kb.
|
|
| Типичные | Атипичные |
| Ангинозная боль в покое более 20 мин | Разнохарактерные болевые ощущения в грудной клетке, возникающие в покое |
| Впервые возникшая стенокардия III ФК | Боль в эпигастрии |
| Прогрессирующая стенокардия | Острые расстройства пищеварения |
| | Боль, характерную для поражения плевры |
| | Нарастающую одышку |
Физикальное исследование больных с ОКС нередко не выявляет каких–либо отклонений от нормы. Его результаты важны не столько для диагностики ОКС, сколько для обнаружения признаков возможных осложнений ишемии миокарда, выявления заболеваний сердца неишемической природы и определения экстракардиальных причин жалоб больного.
2 – Инструментальная диагностика
Основным методом диагностики является ЭКГ-исследование.
При наличии соответствующей симптоматики характерным является:
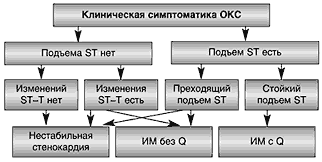
для НС - депрессия сегмента ST не менее чем на 1 мм в двух и более смежных отведениях, а также инверсия зубца T глубиной более 1 мм в отведениях с преобладающим зубцом R;
для развивающегося ИМ c зубцом Q - стойкая элевация сегмента ST,
для стенокардии Принцметала и развивающегося ИМ без зубца Q – преходящий подъем сегмента ST. (см. рис. 1).
Рисунок 1. Варианты ОКС в зависимости от изменений ЭКГ
Помимо обычной ЭКГ в покое, для диагностики ОКС и контроля эффективности лечения применяется холтеровское мониторирование электрокардиосигнала.
3 – Лабораторная диагностика
Из биохимических тестов предпочтительны (в порядке убывания релевантности):
Определение тропонина T и I;
Увеличение содержания МВ-КФК в крови более, чем вдвое по сравнению с верхней границей нормы (через 4-6 часов от начала формирования очага некроза миокарда).
Миоглобин (наиболее ранний маркер) – через 3-4 часа после развития ИМ.
Вышеперечисленные маркеры фактически единственные среди биохимических тестов, которые рекомендуются для лабораторной диагностики ОКС, учитывая их специфичность.
Перечисленные тесты приобретают особенно важное значение при дифференциальной диагностике ИМ без зубца Q и НС.
Оценка риска.
В течение первых 8–12 часов после появления клинической симптоматики ОКС необходимо обеспечить сбор диагностической информации в объеме, достаточном для стратификации риска. Определение степени непосредственного риска смерти или развития ИМ принципиально важно для выбора лечебной тактики в отношении больного с ОКС без стойкого подъема сегмента ST.
Критерии высокого непосредственного риска смерти и развития ИМ:
Повторные эпизоды ишемии миокарда (повторяющиеся ангинозные приступы в сочетании и без сочетания с преходящей депрессией или подъемом сегмента ST).
Повышение содержания сердечных тропонинов (при невозможности определения их – МВ-КФК) в крови.
Гемодинамическая нестабильность (артериальная гипертензия, застойная сердечная недостаточность).
Пароксизмальные желудочковые нарушения ритма сердца (желудочковая тахикардия, фибрилляция желудочков).
Ранняя постинфарктная стенокардия.
Отсутствие вышеперечисленных признаков стратифицируется как низкий непосредственный риск смерти и развития ИМ. Пациентам с низким непосредственным риском смерти и развития ИМ рекомендуется выполнение стресс-теста спустя 3-5 дней спустя эпизода с симптоматикой ОКС, для больных с высоким риском – выполнение стресс теста не ранее 5-7 дней после стойкой стабилизации состояния.
Стресс-тест – тест с физической нагрузкой. Для пациентов, использование физической нагрузки на тредмиле или велоэргометре для которых не представляется возможным, - стрессэхокардиография.
Критерии высокого риска неблагоприятного исхода по результатам стресс–тестов:
Развитие ишемии миокарда при низкой толерантности к физической нагрузке;
Обширный стресс–индуцированный дефект перфузии;
Множественные стресс–индуцированные дефекты перфузии небольшого размера;
Выраженная дисфункция левого желудочка (фракция выброса менее 35%) в покое или при нагрузке;
Стабильный или стресс–индуцированный дефект перфузии в сочетании с дилатацией левого желудочка.
Пациентам, отнесенным к категории высокого риска по клиническим признакам, данным инструментальных и лабораторных тестов, а также больным с НС, перенесшим ранее коронарную баллонную ангиопластику (КБА) или коронарное шунтирование (КШ), показана коронарография. На результатах последней основывается выбор дальнейшей тактики лечения больного – в частности, оценка целесообразности выполнения и определение вида операции реваскуляризации миокарда. Больным с упорно рецидивирующим болевым синдромом и выраженной гемодинамической нестабильностью коронарографическое исследование рекомендуется проводить в максимально сжатые сроки после появления клинической симптоматики ОКС без предварительного проведения стресс–тестов.
Медикаментозное лечение. Учитывая механизм развития, главным направлением патогенетической терапии следует считать воздействие на свертывающую систему крови.
Тромболитическая терапия
Показания:
Боль длительностью более 30 мин, сохраняющаяся несмотря на прием нитроглицерина, в сочетании с элевацией на 1 мм и более сегмента ST не менее чем в 2–х смежных отведениях ЭКГ или появлением полной блокады левой ножки пучка Гиса.
Нецелесообразно:
Позже 12 часов от начала развития ИМ
Отсутствие стойкой элевации ST
Противопоказания:
Геморрагический инсульт в анамнезе
Ишемический инсульт, динамическое нарушение мозгового кровообращения в течение последнего года
Внутричерепная опухоль
Активное внутреннее кровотечение
Расслаивающая аневризма аорты
Наилучшая стратегия ТЛТ в настоящий момент – схема ускоренного введения альтеплазы (100 мг) (по данным исследования GUSTO) – при массе тела более 65 кг 15 мг альтеплазы болюсно в течение 1-2 мин., затем инфузионно внутривенно 50 мг в течение 30 мин и затем 35 мг в течение 60 мин. До начала внутривенное введение гепарина 5000 МЕ + внутривенная инфузия гепарина 1000 МЕ/ч в последующие двое суток.
Антикоагулянты
Из соединений данной группы применяется в основном нефракционированный гепарин. В отличие от тромболитических средств НФГ вводится не только больным со стойкой элевацией сегмента ST, но и пациентам с другими вариантами ОКС.
Противопоказания:
Активное кровотечение и заболевания, сопровождающиеся высоким риском его возникновения.
Схема введения НФГ больным с ОКС без стойкого подъема сегмента ST:
внутривенно – болюс 60–80 ЕД/кг (но не более 5000 ЕД), затем инфузия 12–18 ЕД/кг/ч (но не более 1250 ЕД/кг/ч) в течение 48 часов.
Условием результативности гепаринотерапии считается увеличение АЧТВ в 1,5–2,5 раза по сравнению с нормальным значением этого показателя для лаборатории данного лечебного учреждения. АЧТВ рекомендуется определять через 6 часов после начала инфузии и затем – через 6 часов после каждого изменения скорости введения гепарина. Определение АЧТВ перед началом гепаринотерапии необязательно.
Схема введения НФГ больным без стойкого подъема сегмента ST:
подкожно по 7500–12500 ЕД 2 раза в день или внутривенно. Рекомендуемая продолжительность терапии гепарином при его подкожном введении составляет 3–7 дней.
Целесообразность применения НФГ в сочетании с ТЛТ оспаривается. Согласно современным представлениям, если тромболизис проводится неспецифичными фибринолитическими препаратами (стрептокиназа, анистреплаза, урокиназа) на фоне применения ацетилсалициловой кислоты в полной дозе, введение гепарина необязательно. При применении альтеплазы внутривенное введение гепарина считается оправданным. Гепарин вводится внутривенно болюсом 60 ЕД/кг (но не более 4000 ЕД), затем – со скоростью 12 ЕД/кг/ч (но не более 1000 ЕД/кг/ч) в течение 48 часов под контролем АЧТВ, которое должно превышать контрольный уровень в 1,5–2 раза. Начинать гепаринотерапию рекомендуется одновременно с введением альтеплазы.
Низкомолекулярные гепарины (эноксапарин, фраксипарин) обладают рядом преимуществ по сравнению с НФГ:
большая продолжительность действия,
более предсказуемый антикоагулянтный эффект,
вводятся подкожно в фиксированной дозе,
не нужен лабораторный контроль.
Результаты исследований FRIC, FRAXIS, TIMI 11B показали, что низкомолекулярные гепарины обладают не меньшей, но и не большей, чем НФГ, способностью снижать риск развития ИМ и смерти у больных с НС и ИМ без зубца Q.
Длительность лечения больных ОКС низкомолекулярными гепаринами в среднем составляет 5–7 суток.
Антиагреганты
Наиболее широко используемым в клинической практике антиагрегантом является ацетилсалициловая кислота. Препарат показан при всех вариантах ОКС. Его применение отчетливо снижает риск смерти и развития ИМ. Минимальная доза ацетилсалициловой кислоты, обеспечивающая уменьшение риска развития смерти и ИМ у больных с НС, составляет 75 мг/сут.
Противопоказания:
Обострение язвенной болезни
Геморрагические диатезы
Повышенная чувствительность к салицилатам (при непереносимости рекомендуется использование тиенопиридинов – тиклопидин (доза – 500 мг), клопидогрель (300 мг однократно, далее 75 мг в сутки).
В настоящий момент весьма перспективной является схема комбинированного ипользования ацетилсалициловой кислоты и клопидогреля, которая по данным исследования CUREдостоверно более выражено снижает риск развития сердечно-сосудистых событий.
Наиболее сильным антиагрегационным эффектом обладают блокаторы IIb/IIIa рецепторов тромбоцитов (абциксимаб, эптифибатид, тирофибан, ламифибан), которые способны блокировать агрегацию тромбоцитов, вызываемую любым физиологическим индуктором.
Рекомендуемые дозы антагонистов гликопротеиновых рецепторов IIb/IIIa: абциксимаб – внутривенно болюс 0,25 мг/кг с последующей инфузией 0,125 мкг/кг/мин в течение 12–24 часов; эптифибатид – внутривенно болюс 180 мг/кг c последующей инфузией 2,0 мкг/кг/мин в течение 72–96 часов; тирофибан – внутривенная инфузия 0,4 мкг/кг/мин в течение получаса, затем 0,1 мкг/кг/мин в течение 48–96 часов.
Нитраты
На начальном этапе лечения больных с ОКС препараты нитроглицерина и изосорбида–динитрата применяются внутривенно. Начальная скорость инфузии составляет 10 мкг/мин. Каждые 3–5 мин скорость введения увеличивают на 10 мкг/мин. Выбор скорости инфузии и темпа ее увеличения определяется изменениями выраженности болевого синдрома и уровня артериального давления (АД). Не рекомендуется снижать систолическое АД более чем на 15% от исходного при нормотензии и на 25% при гипертензии.
Побочные эффекты:
Снижение АД
Выраженная головная боль
–адреноблокаторы
Препараты этой группы рекомендуется применять у всех больных с ОКС при отсутствии противопоказаний:
бронхиальная астма,
тяжелая обструктивная дыхательная недостаточность,
брадикардия в покое менее 50 ударов в минуту,
синдром слабости синусового узла,
атриовентрикулярная блокада II–III степени,
хроническая сердечная недостаточность IV функционального класса,
выраженная артериальная гипотензия.
Начинать лечение предпочтительно с внутривенного введения –адреноблокаторов при постоянном мониторировании ЭКГ. После внутривенной инфузии рекомендуется продолжить лечение –адреноблокаторами путем приема внутрь. По данным мета–анализа выполненных к настоящему времени исследований, продолжительное лечение –адреноблокаторами больных, перенесших ИМ с зубцом Q, позволяет уменьшить смертность на 20%, риск внезапной смерти на 34% и частоту нефатального ИМ на 27%. Наиболее эффективными и безопасными считаются 1–селективные соединения без собственной симпатомиметической активности.
Схемы применения:
пропранолол – внутривенно медленно 0,5–1,0 мг, затем внутрь по 40–80 мг каждые 6 часов;
метопролол – внутривенно 5 мг за 1–2 мин трижды с интервалами между инъекциями по 5 мин, затем (через 15 минут после последней инъекции) внутрь по 25–50 мг каждые 6 часов;
атенолол – внутривенно 5 мг за 1–2 мин дважды с интервалом между инъекциями 5 мин, затем (через 1–3 часа после последней инъекции) внутрь по 50–100 мг 1–2 раза в день.
Индивидуальная доза –адреноблокаторов подбирается с учетом частоты сердечных сокращений, целевое значение которой составляет 50–60 ударов в мин.
Антагонисты кальция
Мета–анализы результатов рандомизированных исследований выявили дозозависимое негативное влияние нифедипина короткого действия на риск смерти больных с НС и ИМ. В связи с этим короткодействующие производные дигидропиридина не рекомендуются для лечения больных с ОКС. В то же время, по данным некоторых исследований, продолжительное применение дилтиазема (MDPIT, DRS) и верапамила (DAVIT II) препятствует развитию повторного ИМ и смерти у больных, перенесших ИМ без зубца Q. У больных с ОКС дилтиазем и верапамил применяются в случаях, когда имеются противопоказания к применению –адреноблокаторов (например, обструктивный бронхит), но при отсутствии дисфункции левого желудочка и нарушений атриовентрикулярной проводимости.
Рекомендуемые дозы препаратов составляют 180–360 мг/сут.
Ингибиторы ангиотензинпревращающего фермента
Положительное влияние ингибиторов ангиотензинпревращающего фермента (АПФ) на выживаемость больных, перенесших ИМ (в особенности осложненный застойной сердечной недостаточностью), доказана в ряде контролируемых исследований – GISSI–3, ISIS–4, AIRE, SAVE, TRACE и др. Обширный ИМ с патологическим зубцом Q является показанием к применению ингибиторов АПФ даже при отсутствии клинических и эхокардиографических признаков дисфункции левого желудочка. Чем раньше начинается лечение ингибиторами АПФ, тем сильнее выражено их тормозящее влияние на процесс постинфарктного ремоделирования сердца. С другой стороны, как показали результаты исследования CONSENSUS II, которое было прервано досрочно в связи с тем, что смертность в группе больных, получавших эналаприл, превысила смертность больных контрольной группы, ингибиторы АПФ должны применяться в терапии больных ИМ с большой осторожностью. По возможности, терапию следует начинать после стабилизации гемодинамики в первые 48 часов от момента развития ИМ. Рекомендуются следующие начальные дозы препаратов: каптоприл – 25 мг/сут, эналаприл и лизиноприл – 2,5 мг/сут, периндоприл – 2 мг/сут. Увеличение дозы должно проводиться постепенно под контролем АД и функции почек. При достижении оптимальной дозы терапия должна продолжаться в течение многих лет.
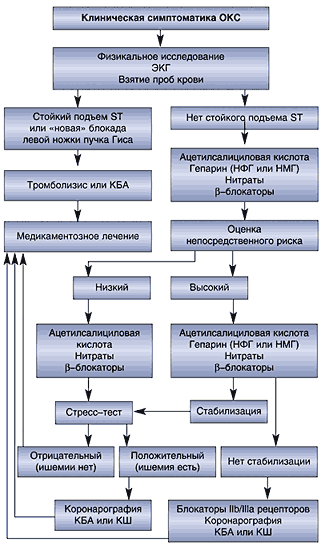
Алгоритм медицинской помощи больным с ОКС
Литература:
https://www.heart.org/en/health-topics/heart-attack
https://www.clevelandclinicabudhabi.ae/en/pages/page-not-found.aspx
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4438466/#::text=The%20ECG%20remains%20a%20cornerstone%20of%20MI%20diagnosis.,patient%20MI%20morbidity%20and%20mortality.
https://endovascular.kz/ru/rekomendatsii/klinicheskie-protokoly-mz-rk/ostryj-koronarnyj-sindrom-bez-pod-ema-segmenta-st
