Отчет о нир Йодометрическое определение дубильных веществ в растительном сырье
 Скачать 253.5 Kb. Скачать 253.5 Kb.
|
|
Результаты и их обсуждение Результаты количественного определения содержания дубильных веществ в ЛРС кровохлебки лекарственной приведены в табл. 2. Наиболее часто применяемый метод перманганатометрии Левенталя дал очень высокие показатели в обеих популяциях: от 16.76 ± 5.62 до 31.76 ± 15.42 в лесной популяции и от 20.40 ± 8.82 до 30.59 ± 12.28 – в луговой. К таким же выводам приходят и другие исследователи, работавшие с корневищем герани. По их данным, метод Левенталя также дает завышенные результаты. Метод перманганатометрии рекомендован Государственной фармакопеей 11-го издания (ГФ XI) как основной метод определения дубильных веществ. Однако он имеет ряд недостатков. Во-первых, нечеткий переход окраски титруемого раствора не позволяет объективно оценить момент смены, что часто увеличивает ошибку. В этом методе часто проявляется субъективность исследователя, что сильно обесценивает метод. Во-вторых, имеет место окисление перманганатом калия не только дубильных, но и других сопутствующих веществ. Табл. 2 Среднее содержание дубильных веществ в корневище Sanguisorba officinalis L. в зависимости от фазы вегетации в процентах от общей массы сухого сырья
Для проверки полученных нами данных использовали метод перманганатометрии в модификации Курсанова, который отличается от методики Левенталя сразу рядом параметров. В методике Курсанова применяется использование обычного настоя сырья на кипящей воде, так как метод был изобретен для определения качества чая . Это во многом понижает экстракцию веществ, но, как считает сам автор, из сырья практически не экстрагируются сопутствующие вещества. Вторым изменением методики является существенное упрощение формулы расчета, так как в ней присутствует лишь один изменяющийся параметр в виде результатов титрования. Это очень привлекает исследователей, и позволило данному методу заменить методику Левенталя. Количественные показатели содержания дубильных веществ в ЛРС кровохлебки лекарственной, полученные нами, в этом случае схожи с известными данными и соответствуют норме ГФ XI. Хотя использованные нами два метода перманганатометрии имеют много общего, они существенно отличаются друг от друга. В первую очередь отличие заключается в извлечении веществ. Методика Левенталя требует использования обратного холодильника, что во многом увеличивает экстракцию веществ из корневища. В этом есть свое преимущество, так как извлекаются почти все дубильные вещества, но и есть недостаток, так как, помимо дубильных веществ извлекаются и другие соединения, которые также будут окисляться пер-манганатом калия. Чтобы исключить такой фактор, как субъективность исследователя, нами был применен метод спектрофотометрии. В основе метода лежит измерение оптической плотности раствора при определенной длине волны, то есть используются физические характеристики раствора. Но у метода есть и недостаток. Разные виды дубильных веществ имеют разные максимумы поглощения. Это занижает полученные результаты, так как в исследовании мы получаем оптическую плотность только для гидролизуемых веществ при длине 278 нм, конденсированные же вещества имеют максимум поглощения при 272 нм. Значения содержания дубильных веществ, полученные методом спектрофотометрии в лесной и луговой популяциях, составляют от 7.52 ± 0.22 до 9.86 ± 0.98 и от 7.13 ± 0.48 до 9.82 ± 0.62 соответственно. 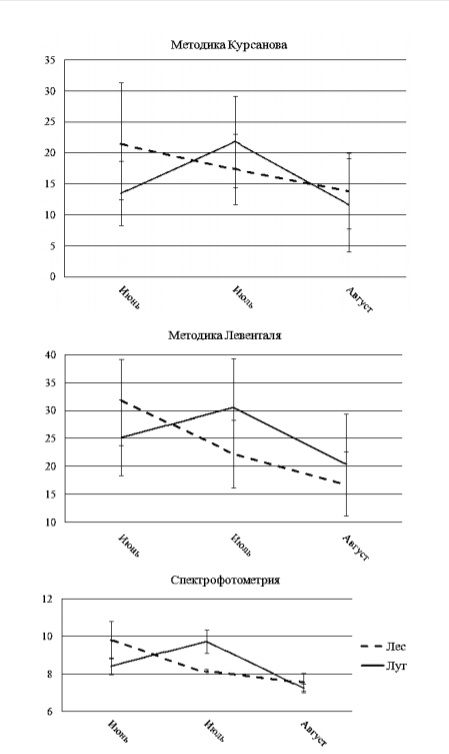 Рис. 1. Динамика накопления дубильных веществ в ЛРС кровохлебки лекарственной из двух популяций Динамика накопления дубильных веществ в каждой из исследуемых популяций, полученная с применением различных методик, полностью совпадает, несмотря на большую разницу в процентном соотношении (рис. 1–3). Стоит также отметить и то, что характер динамики не изменился за 2 года исследований. Максимальное значение дубильных веществ по всем трем методикам отмечено для фазы бутонизации в лесной популяции. Для луговой популяции максимум содержания дубильных веществ смещается к фазе цветения. Но минимумы содержания совпадают для обеих популяций и относятся к фазе плодоношения. Подобная разность поведения растений может говорить о различных экологических условиях и пластичности кровохлебки лекарственной как вида. Здесь также выделяется тот факт, что минимальные значения содержания дубильных веществ в корневище кровохлебки лекарственной, отмеченные в августе для луговой популяции и полученные тремя различными методами, различаются не столь сильно (от 7.03% до 8.27%). Но максимальные значения, характерные для лесной популяции в июне, различаются существенно (от 10.25% до 42.84%). Это можно объяснить все тем же недостатком метода перманганатомет-рии в результате окисления сопутствующих веществ. Это очень хорошо укладывается в обычный метаболический процесс, когда в самые активные периоды вегетации (бутонизация и цветение), количество различных веществ повышается, и именно они дают такой высокий результат. Дубильные вещества, являясь вторичными метаболитами, не могут так сильно менять свое содержание в корневище, что очень хорошо отражают результаты спектрофотометрии. Согласно этому метод спектрофотометрии, несмотря на количественные результаты, является более объективным, чем результаты методики перманганатометрии. Заключение Наши исследования популяций кровохлебки лекарственной на предмет со- держания дубильных веществ в лекарственном растительном сырье не выявили существенной разницы по количественным показателям. Данные эксперимента по количественному определению содержания дубильных веществ в обеих популяциях кровохлебки лекарственной, полученные с использованием методики Курсанова, совпадают с таковыми, указанными в литературе. В случае использования перманганатометрического метода Левенталя и метода спектрофотометрии значения в обеих популяциях оказались выше и ниже литературных данных соответственно. Лесная популяция кровохлебки лекарственной отличается от луговой популяции по динамике накопления и времени максимального содержания дубильных веществ в корневище, но при этом абсолютные значения, полученные с использованием разных методик, остаются почти на одинаковом уровне. Для лесной популяции максимальные значения содержания дубильных веществ отмечены в июне и приурочены к фазе бутонизации. Для луговой популяции максимум приходится на июль и приурочен к фазе цветения. Таким образом, при разработке рекомендаций по срокам сбора ЛРС кровохлебки лекарственной необходимо учитывать ее местообитания. Литература 1. Юзепчук С.В. Род кровохлебка – Sanguisorba // Флора СССР: в 30 т. / Отв. ред. В.Л. Комаров. – М.-Л.: Изд-во АН СССР, 1941. – Т. 10. – С. 421–429. 2. Соболева Л.С., Крылова И.Л. Зеленая аптека Татарии. – Казань: Тат. кн. изд-во, 1990. – 156 с 3. Бакин О.В., Рогова Т.В., Ситников А.П. Сосудистые растения Татарстана. – Казань: Изд-во Казан. ун-та, 2000. – 496 с. 4. Государственная фармакопея. 8-е изд. – М.: Медгиз, 1952. – 321 с. 5. Подымов А.И., Суслов Ю.Д. Лекарственные растения Марийской АССР. – Йошкар- Ола: Мар. кн. изд-во, 1990. – 192 с. 6. Бухаров В.Г., Корнеева Л.Н. Тритерпеновые гликозиды из Sanguisorba officinalis L. // Изв. АН СССР. Сер. хим. – 1970. – № 10. – С. 2402–2404. 7. Okuda T., Hatano T., Yazaki K., Ogawa N. Rugosin A, B, C and praecoxin A, tannins having a valoneoyl group // Chem. Pharm. Bull. – 1982. –V. 30, No 11. – P. 4230–4233. 8. Konishi K., Urada M., Adachi I., Tanaka T. Inhibitory effect of sanguiin H-11 on chemotaxis of neutrophil // Biol. Pharm. Bull. – 2000. – V. 23, No. 2. – P. 213–218. 9. Носов А.М. Лекарственные растения. – М.: Эксмо, 2004. – 350 с. 10. Zou S., Chen W. Determination of ursolic acid and oleanolic acid in Sanguisorba officinalis L. by HPLS // Shizhen Guoyi Guoyao. – 2006. – V. 17, No 8. – P. 1373–1374. (на кит. яз.) 11. Kim Y.H., Chung C.B., Kim J.G., Ko K.I., Park S.H., Kim J.H., Eom S.Y., Kim Y.S., Hwang Y.I., Kim K.H. Anti-wrinkle activity of ziyuglucoside I isolated from а Sanguisorba officinalis root extract and its application as a cosmetical ingredient // Biosci. Biotechnol. Biochem. – 2008. – V. 72, No 2. – P 303–311. 12. Цицина С.И. Результаты исследований некоторых лекарственных растений, содер- жащих флавоновые соединения // Тр. ботан. садов АН КазССР. – Алма-Ата: Наука, 1969. – Т. 11. – С. 111–114. 13. Cheng D., Cao X., Zou P., Yang P. Isolation and identification of the flavonoids from garden burnet (Sanguisorba officinalis) // Zhongcaoyao. – 1995. – V. 26, No 11. – P. 570–571. (на кит. яз.) 14. Sha M., Cao A., Wang B., Liu C., Geng J., Liu W. Determination of hyperin in Sanguisorba officinalis L. by high performance liquid chromatography // Se Pu. – 1998. – V. 16, No 3. – P. 226–228. (на кит. яз.) 15. Елина Г.А. Аптека на болоте. – СПб.: Наука, 1993. – 496 с. 16. Zhang L., Zhao H. Preparation comprising polysaccharide of Sanguisorba officinalis and its production methods and use for treatment obesity // Faming Zhuanli Shenqing Gongkai Shuomingshu; Chem. Abstrs. – 2006. – V. 145. – AN 443863. 17. Муравьева Д.А., Самылина И.А., Яковлев Г.П. Фармакогнозия. – М.: Медицина. – 2002. – 656 с. 18. Землинский С.Е. Лекарственные растения СССР. – М.: Медгиз, 1958. – 610 с. 19. Брезгин Н.Н. Лекарственные растения центральной части России. – М.: Слог, 1993. – 316 с. 20. Серых Г.И. Кровохлебка лекарственная – Sanguisorba officinalis L. // Атлас ареалов и ресурсов лекарственных растений СССР / Гл. ред. П.С. Чиков. – М.: Картография, 1983. – С. 252. 21. Гаммерман А.Ф., Гром И.И. Дикорастущие лекарственные растения СССР. – М.: Медицина, 1976. – 286 с. 22. Nordborg G. Studies in Sanguisorba officinalis L. // Botaniska Notiser. – 1963. – V. 116, No 2. – P. 267–288. 23. Зайцева Т.А. Эколого-географическая изменчивость золотой розги и кровохлебки лекарственной в связи с вопросами интродукции: Автореф. дис. … канд. биол. наук. – М., 1979. – 28 с. 24. Государственная фармакопея СССР. 11-е изд. Вып. 1: Общие методы анализа. – М.: Медицина, 1987. – 336 с. 25. Курсанов А.Л. Дубильные вещества чайного листа в связи с проблемой повышения качества чая // Изв. АН СССР. Сер. биол. – 1951. – №. 2. – С. 44–52. 26. Скляревская Н.В. Фармакогностическое изучение надземной части сабельника бо- лотного (Comarum palustre L.), произрастающего на Северо-Западе России: Авто- реф. дис. … канд. фарм. наук. – СПб., 2009. – 24 с. 27. Разаренова К.Н., Жохова Е.В. Сравнительная оценка содержания дубильных ве- ществ в некоторых видах рода Geranium L. флоры Северо-Запада // Химия расти- тельного сырья. – 2011. – № 4. – С. 187–192. 28. Рябинина Е.И., Зотова Е.Е., Пономарева Н.И., Шведов Г.И. Исследование процесса экстракции таннидов из Mеlissa officinalis L. // Прикладные информационные ас- пекты медицины. – 2009. – Т. 12, № 1. – С. 78–85. 29. Федосеева Л.М. Изучение дубильных веществ подземных и надземных вегетатив- ных органов бадана толстолистного (Bergenia crassifolia (L.) Fitsch.), произрастаю- щего на Алтае // Химия растительного сырья. – 2005. – № 2. – С. 45–50. 30. Ермакова И.М., Зайцева Т.А. Кровохлебка лекарственная // Биологическая флора Московской области. – М.: Изд-во Моск. ун-та, 1993. – Вып. 9, Ч. 2. – С. 39–70. | ||||||||||||||||||||||||||||||||||
