Отчет о нир Йодометрическое определение дубильных веществ в растительном сырье
 Скачать 253.5 Kb. Скачать 253.5 Kb.
|
Дубильные вещества выделяют из ЛРС в виде смеси полимеровимеющих среднюю молекулярную массу порядка от 500 до 3000. Они представляют собой как правило, аморфные соединения, очень гигроскопические, образующие при растворении в воде коллоидные растворы, имеют вяжущий вкус. Плохо растворимы в холодной воде. Из органических растворителей растворимы в ацетоне, этиловом спирте, смеси этилового спирта и этилового эфира, отчасти в этиловом эфире, этилацетате, пиридине, бутаноле. Нерастворимы в хлороформе, петролейном эфире, бензоле и сероуглероде. Многие дубильные вещества оптически активны, легко окисляются на воздухе, приобретая более или менее темную окраску. В растворе дают слабокислую реакцию. В кристаллическом состоянии известны только катехины,они плохо растворимы в холодной воде, лучше - в горячей. Они легко окисляются при нагревании и на свету. Окисление катехинов особенно быстро протекает в щелочной среде, а также при действии окислительных ферментов. Способны образовывать прочные молекулярные связи с белками и другими полимерами (пектиновые вещества, целлюлоза). Под действием фермента таназы и кислот гидролизуемые дубильные вещества распадаются на составные части, конденсированные – укрупняются. Осаждаются растворами белка, алкалоидов, основного ацетата свинца, бихромата калия, сердечных гликозидов. Как вещества фенольной природы, дубильные вещества легко окисляются перманганатом калия в кислой среде и другими окислителями, образуют окрашенные комплексы с солями тяжелых металлов, трехвалентного железа, бромной водой. В лекарственных смесях их нельзя смешивать с солями тяжелых металлов, белковыми веществами и алкалоидами, так как образуются осадки. Качественный анализ. Для получения суммы дубильных веществ растительное сырье экстрагируют горячей водой в соотношении 1:30 или 1:10. Качественные реакции на дубильные вещества можно подразделить на 2 группы:
Для обнаружения дубильных веществ в растительном сырье используют следующие реакции:
Эти реакции дают одинаковый результат независимо от группы дубильных веществ. Реакции, позволяющие определить группу дубильных веществ. 1.Реакция Стиасни – с 40 % раствором формальдегида и конц. HCl - Конденсированные дубильные вещества образуют осадок кирпично-красного цвета 2.Бромная вода (5 г брома в 1 л воды) - к 2-3 мл испытуемого раствора прибавляют по каплям бромную воду до появления в растворе запаха брома; в случае присутствия конденсированных дубильных веществ образуется оранжевый или желтый осадок. 3. Окрашивание с солями трехвалентного железа, железоаммонийными квасцами – черно-синее (дубильные вещества гидролизуемой группы, которые являются производными пирогаллола) или черно-зеленое (дубильные вещества конденсированной группы, которые являются производными пирокатехина). 4.Катехины дают красное окрашивание с ванилином (в присутствии конц. HCl или 70 %-ной H2SO4 развивается яркая красная окраска). Катехины образуют при этой реакции окрашенный продукт следующего строения: 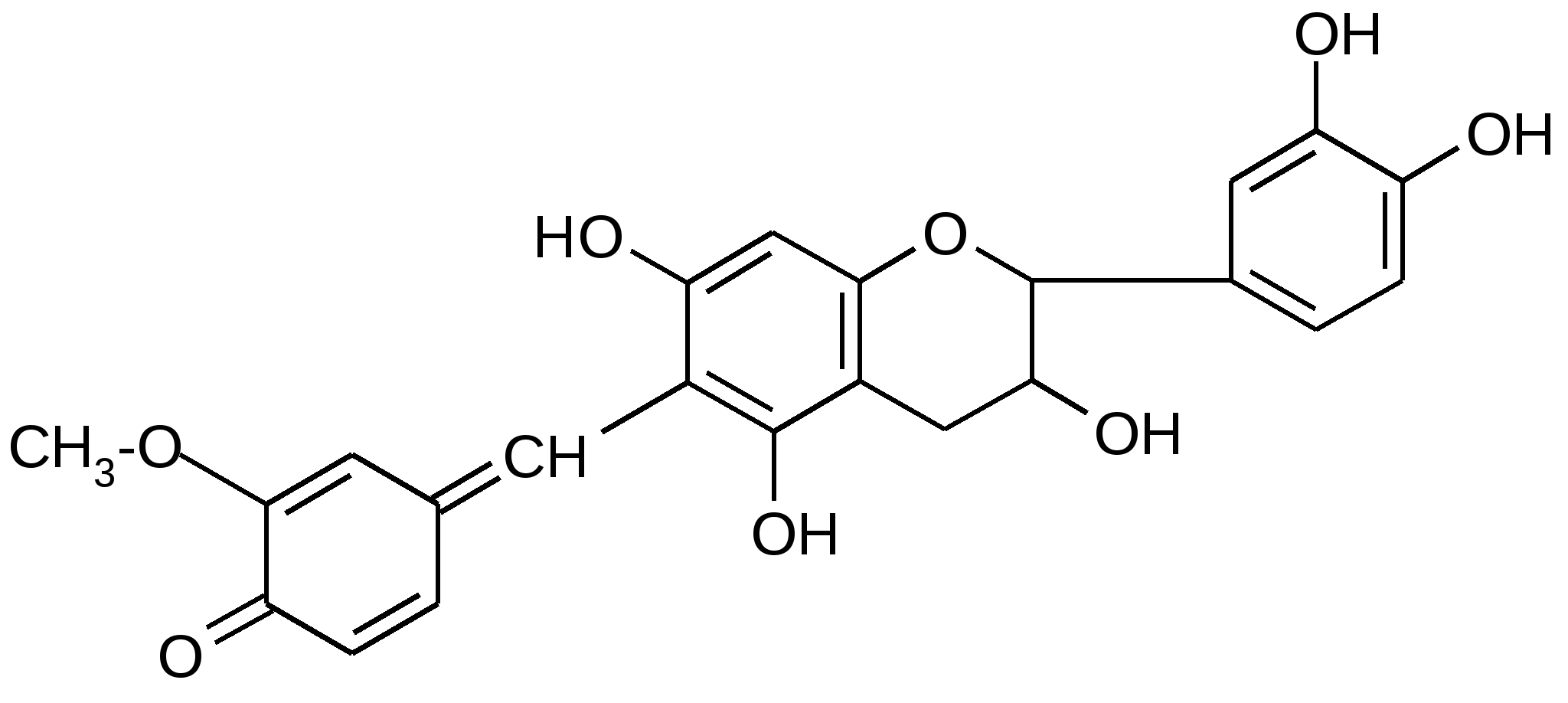
При кипячении растворов дубильных веществ с нитрозометилуретаном танниды пирокатехинового ряда осаждаются полностью, а присутствие пирогалловых таннидов можно обнаружить в фильтрате путем прибавления железоаммиачных квасцов и натрия ацетата – фильтрат окрашивается в фиолетовый цвет.
7. Для обнаружения связанной эллаговой кислоты (или гаксаоксидифеновой) уксусную кислоту заменяют 0,1 н. серной или соляной кислотой (кармино-красная окраска, переходящая в синюю). 8. Дубильные вещества с белками создают непроницаемую для воды пленку (дубление). Вызывая частичное свертывание белков, они образуют на слизистых оболочках и раневых поверхностях защитную пленку. 9. При соприкосновении с воздухом (например, резке свежих корневищ) дубильные вещества легко окисляются, превращаясь во флобафены или красени, которые обусловливают темно-бурую окраску многих кор и других органов, настоев. Флобафены нерастворимы в холодной воде, растворяются в горячей воде, окрашивая отвары и настой в бурый цвет. 10. С 10 %-ным раствором среднего ацетата свинца (одновременно добавляют 10 %-ный раствор уксусной кислоты) : образуется белый осадок, нерастворимый в уксусной кислоте – дубильные вещества гидролизуемой группы (осадок отфильтровывают и в фильтрате определяют содержание конденсированных дубильных веществ, с 1 %-ным раствором железоаммонийных квасцов – черно-зеленое окрашивание); белый осадок, растворимый в уксусной кислоте – дубильные вещества конденсированной группы. 11. Для идентификации отдельных соединений используют хроматографический анализ, рассматривая в УФ-свете. Обработку хроматограмм производят раствором железа хлорида или ванилиновым реактивом Структуру устанавливают с помощью ИК-спектров, ПМР-спектров. Реакция с 1 %-ным спиртовым раствором железоаммониевых квасцов является фармакопейной, проводится с отваром из сырья – кора дуба, корневище змеевика, соплодия ольхи, плоды черники; А также непосредственно в сухом сырье – кора дуба, кора калины, корневища бадана. Количественное определение.
Официальным в дубильно-экстрактовой промышленности является весовой единый метод (ВЕМ): В водных вытяжках из растительного материала вначале определяют общее количество растворимых веществ (сухой остаток) путем высушивания определенного объема вытяжки до постоянной массы; затем из вытяжки удаляют дубильные вещества, обрабатывая ее обезжиренным кожным порошком; после отделения осадка в фильтрате вновь устанавливают количество сухого остатка. Разность в массе сухого остатка до и после обработки вытяжки кожным порошком показывает количество подлинных таннидов.
К ним относятся: 1) Желатиновый метод - Метод Якимова и Курницкой – основан на способности дубильных веществ образовывать нерастворимые комплексы с белками. Водные извлечения из сырья титруют 1 % раствором желатина, в точке эквивалентности комплексы желатино-таннаты растворяются в избытке реактива. Титр устанавливают по чистому таннину. Точку валентности определяют путем отбора наименьшего объема титрованного раствора, вызывающего полное осаждение дубильных веществ. Метод наиболее точный, т.к. позволяет определить количество истинных дубильных веществ. Недостатки: длительность определения и трудность установления точки эквивалености. 2) Перманганатометрический метод (метод Левенталя в модификации Курсанова). Это фармакопейный метод, основан на легкой окисляемости перманганатом калия в кислой среде в присутствии индикатора и катализатора индигосульфокислоты, которая в точке эквивалентности раствора меняется от синего до золотисто-желтого. Особенности определения, позволяющие оттитровать только макромолекулы дубильных веществ: титрование проводится в сильно разбавленных растворах (извлечение разбавляеттся в 20 раз) при комнатной температуре в кислой среде, перманганат добавляется медленно, по каплям, при интенсивном перемешивании. Метод экономичный, быстрый, прост в исполнении, но недостаточно точен, так как перманганат калия окисляет частично и низкомолекулярные фенольные соединения. 3) Для количественного определения таннина в листьях сумаха и скумпии используется метод осаждения дубильных веществ сульфатом цинка с последующим комплексонометрическим титрованием трилоном Б в присутствии ксиленолового оранжевого. 3. Физико-химические методы. 1) Фотоэлектроколориметрические - основаны на способности ДВ образовывать окрашенные соединения с солями трехвалентного железа, фосфорно-вольфрамовой кислотой, реактивом Фолина-Дениса и др. 2) Хроматоспектрофотометрические и нефелометрические методы используют в научных исследованиях. Заготовка. Заготовку сырья проводят в период максимального накопления ДВ. У травянистых растений, как правило, минимальное содержание дубильных веществ отмечается весной в период отрастания, затем их содержание увеличивается и достигает максимума в период бутонизации и цветения (например, корневища лапчатки). К концу вегетации количество ДВ постепенно снижается. У кровохлебки максимум ДВ накапливается в фазу развития разеточных листьев, в фазу цветения их содержание снижается, а осенью увеличивается. Фаза вегетации влияет не только на количество, но и на качественный состав ДВ. Весной, в период сокодвижения, в коре деревьев и кустарников и в фазу отрастания у травянистых растений преимущественно накапливаются гидролизуемые ДВ, а осенью в фазу отмирания растений - конденсированные ДВ и продукты их полимеризации - флобафены (красени). Производится в период наибольшего содержания в растениях дубильных веществ, исключить попадания воды на сырье. Условия сушки. После сбора сырье необходимо быстро высушить, так как под влиянием ферментов происходят окисление и гидролиз дубильных веществ. Собранное сырье сушат на воздухе в тени или в сушилках при температуре 50-60 градусов. Подземные органы и кору дуба можно сушить на солнце. Условия хранения. Хранят в сухом помещении хорошо проветриваемых помещениях без доступа прямых солнечных лучей по общему списку в течение 2-6 лет, в плотной упаковке, желательно в целом виде, так как в измельченном состоянии сырье подвергается быстрому окислению вследствие увеличения поверхности соприкосновения с кислородом воздуха. Пути использования сырья, содержащего дубильные вещества. Кроме источников танина, все изучаемые объекты включены в приказ 19.07.99 г., разрешающий безрецептурный отпуск сырья из аптек. В экстемпоральной рецептуре и в домашних условиях сырье используют в виде отваров и в составе сборов. Из листьев скумпии кожевенной, сумаха дубильного, чая китайского, галлов китайских и турецких получают танин и комбинированные препараты «Танальбин» (комплекс таннина с белком казеином) и «Тансал» (комплекс танальбина с фенилсалицилатом). Из соплодий ольхи получают препарат «Альтан». Медицинское применение сырья и препаратов, содержащих дубильные вещества. Сырье ипрепараты, содержащие ДВ, применяются наружно и внутрь как вяжущие, противовоспалительные, бактерицидные и кровоостанавливающие средства. Действие основано на способности ДВ связываться с белками с образованием плотных альбуминатов. При соприкосновении с воспаленной слизистой оболочкой или раневой поверхностью образуются тонкая поверхностная пленка, защищающая от раздражения чувствительные нервные окончания. Происходит уплотнение клеточных мембран, сужение кровеносных сосудов, уменьшается выделение экссудатов, что приводит к уменьшению воспалительного процесса. Благодаря способности ДВ образовывать осадки с алкалоидами, сердечными гликозидами, солями тяжелых металлов их используют как антидоты при отравлении этими веществами. Наружно при заболеваниях полости рта, зева, гортани (стоматиты, гингивиты, фарингиты, ангины), а также при ожогах применяют отвары коры дуба, корневищ бадана, змеевика, лапчатки, корневищ и корней кровохлебки, и препарат «Альтан». Внутрь при желудочно-кишечных заболеваниях (колитах, энтероколитах, поносах, дизентерии) применяют препараты танина («Танальбин», «Тансал», «Альтан», отвары плодов черники, черемухи (особенно в детской практике»), соплодий ольхи, корневищ бадана, змеевика, лапчатки, корневищ и корней кровохлебки. Как кровоостанавливающие средства при маточных, желудочных и геморроидальных кровотечениях применяют отвары коры калины, корневищ и корней кровохлебки, корневищ лапчатки, соплодий ольхи. Отвары готовят в соотношении 1:5 или 1:10. Нельзя применять сильно концентрированные отвары, так как при этом, пленка альбуминатов высыхает, появляются трещины и возникает вторичный воспалительный процесс. Экспериментально установлено противоопухолевое действие дубильных веществ водного экстракта экзокарпия плодов гранатника (при лимфосаркоме, саркоме и других заболеваниях) и препарата «Ханерол», полученного основе эллаготаннинов и полисахаридов соцветий кипрея обыкновенного (иван-чай) при раке желудка и легких. Материалы и методы Материалом для изучения содержания и динамики накопления дубильных веществ послужили корневища кровохлебки лекарственной, взятые из двух популяций, расположенных на территории Республики Чувашии. Одна из популяций (далее лесная популяция) расположена возле с. Анчиккасы, в светлом участке соснового разнотравного леса, частично лишенном деревьев. Увлажнение умеренное, грунтовое и атмосферное. Особи популяции произрастают на месте скопления весенних вод, быстро исчезающих с повышением температуры. Подстилка ярко выражена, состоит из опада листьев и хвои, но толщиной не более 1–2 см и местами отсутствует вовсе. Почва на данном участке серая лесная. Подстилка и верхний слой корней составляют порядка 5 см. Гумусовый слой серого цвета проникает на глубину порядка 15–20 см. Далее идет подстилающий переходный слой (горизонт А2) до глубины порядка 50 см. Материнской породой является крупнозернистый песок. Другая популяция (далее луговая популяция) расположена на заливном разнотравном лугу возле с. Малое Чурашево. Увлажнение высокое, грунтовое и атмосферное. Почва на исследуемом участке представляет собой чернозем. Гумусовый слой проникает на довольно большую глубину порядка 50 см, что легко объясняется аллювиальным происхождением. Подстилающей породой является красная глина. Имеется подстилка из прошлогодних остатков трав. Для изучения использовались следующие параметры: количество листьев на одном растении, количество листочков на листе, длина листа, высота побега. Как видно из табл. 1, популяции кровохлебки лекарственной имеют сходные показатели для таких параметров, как количество листьев и количество листочков. Наиболее интересным является сравнение особей кровохлебки лекарственной по длине листа и высоте генеративных побегов. В среднем растения и др. Табл. 1 Статистические параметры особей генеративного онтогенетического состояния двух популяций кровохлебки лекарственной
Таким образом, наши исследования подтверждают выделение теневой и световой формы кровохлебки лекарственной, которое было предложено рядом авторов. Световая форма отличается меньшими размерами. Теневая форма имеет относительно большие размеры, но часто находится в угнетенном состоянии и не цветет. Среди отличий также называются меньшая продуктивность семян и смещение вегетативных фаз развития в течение сезона. Сбор, сушку и хранение корневищ кровохлебки лекарственной проводили по стандартной методике. Для сбора выбирали растения с цветоносом, то есть генеративные особи. Растения выкапывали целиком, надземную часть отре-зали. Корневища тщательно промывали, очищали от всякого рода примесей и растительных остатков. Затем разрезали на небольшие кусочки длиной 5–6 см и сушили в проветриваемом помещении, избегая попадания прямых солнечных лучей. Сухие корневища хранили в плотно закрытых пакетах, избегая повышен- ной влажности. Статистическую обработку данных проводили с применением пакетов MS Excel и STATISTICA 6.0. Экспериментальная часть Для сравнительной характеристики содержания дубильных веществ были применены три методики: перманганатометрический метод Левенталя , модификация этого метода Курсановым и общепринятый спектрофотометрический метод. Фармакопейный метод Левенталя количественного определения дубильных веществ в растительном сырье основан на их легкой окисляемости калия перманганатом в присутствии индигосульфокислоты при комнатной температуре. Индигосульфокислота является индикатором и регулятором реакции. Методика Курсанова имеет тот же принцип действия, но отличается получением извлечения из корневища. В основе спектрофотометрического метода определения количества полифенолов лежит установление оптической плотности спиртово- водной вытяжки растительного сырья при длине волны 275 нм. Все эти методы следует признать приблизительными, полуколичественными ввиду разнообразия этой группы веществ. Но, тем не менее, они имеют широкое распространение и подходят для знакомства с материалом и для сравнительных целей. Методика Левенталя. 1.0 г сырья измельчали и просеивали сквозь сито с диаметром отверстий 3 мм. Точную навеску сырья помещали в плоскодонную колбу, приливали 150 мл нагретой до кипения воды и кипятили с обратным холодильникомна плитке в течение 30 мин при перемешивании. Жидкость охлаждали до комнатной температуры и фильтровали через вату. 5 мл извлечения отбирали пипеткой, прибавляли 100 мл воды и 15 мл индигосульфокислоты. Титровали при постоянном перемешивании 0.02 моль/л раствором перманганата калия до появления золотисто-желтого окрашивания. Модификация Курсановa. Навеску 2 г измельченного растительного материала переносили в стакан, прибавляли 75 мл дистиллированной воды и нагревали до 80 °С. Охлажденную смесь количественно переносили в мерную колбу емкостью 250 мл, стакан ополаскивали 2–3 раза дистиллированной водой и содержимое колбы доводили водой до метки. Полученную смесь оставляли настаиваться 30 мин, затем фильтровали через складчатый фильтр. В большую фарфоровую чашку емкостью 1 л отмеряли 10 мл фильтрата, добавляли 750 мл дистиллированной воды и 25 мл раствора индигокармина и 10 мл разбавленной H2S04 (1 : 4). Смесь титровали 0.05 н. раствором КМnО4, перемешивая стеклянной палочкой. Титрование вели со скоростью одной капли в секунду до появления слаборозовой окраски, хорошо заметной по краям чашки. Цвет смеси в фарфоровой чашке постепенно изменялся: из синего он становился темно- зеленым, светло-зеленым, зеленовато-желтым, а затем и золотисто-желтым. Спектрофотометрический метод. 0.8 г измельченного сырья заливали 100 мл воды и нагревали на кипящей водяной бане 30 мин. Далее давали 30 мин отстояться при комнатной температуре. Полученное извлечение фильтровали через складчатый фильтр. 5 мл извлечения помещали в мерную колбу на 50 мл, доводили до метки спиртом этиловым 70%. 2.5 мл полученного раствора помещали в мерную колбу вместимостью 25 мл и снова доводили до метки спиртом этиловым 70%. Измеряли оптическую плотность данного раствора в кювете с толщиной слоя 10 при длине волны 275–278 нм. Измерения проводились относительно спирта этилового. Параллельно проводили замеры стандартного раствора танина. Для этого около 0.0025 г танина помещали в колбу вместимостью 50 мл, доводили до метки спиртом этиловым 70%, 2.5 мл полученного разведения помещали в мерную колбу на 25 мл и доводили до метки спиртом этиловым 70%. |
