жердева инд задание. Молекулярная адсорбция из растворов. Факторы, влияющие на молекулярную адсорбцию вещества из раствора от равновесной концентрации адсорбтива, от природы растворителя, от природы адсорбента, от природы адсорбтива, от температуры
 Скачать 232.51 Kb. Скачать 232.51 Kb.
|
|
Тема 6 , рубежный контроль Молекулярная адсорбция из растворов. Факторы, влияющие на молекулярную адсорбцию вещества из раствора: от равновесной концентрации адсорбтива, от природы растворителя, от природы адсорбента, от природы адсорбтива, от температуры. Молекулярная адсорбция – адсорбция из растворов неэлектролитов (веществ, которые на ионы не распадаются и электрический ток не проводят) или слабых электролитов (веществ, которые проводит электрический ток вследствие диссоциации на ионы). В этих случаях растворенные вещества адсорбируются на поверхности твердого тела в виде молекул. Молекулярную адсорбцию рассчитывают по следующей формуле:  Особенностью молекулярной адсорбции является то, что вместе с растворенным веществом адсорбируются молекулы растворителя. Факторы, влияющие на молекулярную адсорбцию: равновесная концентрация растворенного вещества; природа растворителя; природа адсорбента; природа растворенного вещества; температура адсорбции. Влияние равновесной концентрации адсорбтива (сS)на молекулярную адсорбцию описывается изотермами адсорбции, которые можно свести к следующим видам: изотерма Ленгмюра, которая отвечает мономолекулярной адсорбции и описывается уравнением Ленгмюра:   изотерма адсорбции, которая сопровождается абсорбцией; изотерма адсорбции для случаев, когда адсорбент достаточно хорошо адсорбирует растворитель; изотерма отрицательной адсорбции, когда концентрация молекул растворенного вещества в адсорбционном слое меньше, чем в объеме раствора. Влияние природы растворителя на молекулярную адсорбцию Чем хуже адсорбируется растворитель, тем лучше будет адсорбироваться растворенное вещество. А растворитель адсорбируется тем хуже, чем больше его поверхностное натяжение () на границе Т-Ж. Отсюда следуют две закономерности: адсорбция на твердом адсорбенте идет лучше из водных растворов и хуже из органических растворов; правило Шилова: чем лучше растворитель растворяет вещество, тем хуже вещество адсорбируется из раствора. Влияние природы адсорбента на молекулярную адсорбцию Пора– это минимальное пространство между частицами вещества. Пористость– отношение объема пор к общему объему материала. Из свойств адсорбента на адсорбцию влияют его полярность и пористость. Экспериментальные данные позволили сформулировать правило: неполярные твердые тела лучше адсорбируют неполярные адсорбтивы. Степень влияния пористости определяется соотношением размеров пор адсорбента и молекул растворенного вещества. Если молекулы растворенного вещества малы и легко проникают в поры твердого тела, то адсорбция идет лучше. Крупные молекулы не могут попасть в узкие поры адсорбента, и адсорбция уменьшается. Влияние природы адсорбтива на молекулярную адсорбцию ПАВ в силу своей дифильности растворяются как в полярных, так и в неполярных растворителях. В зависимости от вида растворителя должен выбираться подходящий адсорбент. Так для адсорбции ПАВ из водных растворов следует использовать гидрофобные (неполярные) твердые тела, например, уголь. При адсорбции молекулы ПАВ строго ориентированы: углеводородный радикал взаимодействует с поверхностью угля, а полярная часть — с водой. Можно отметить следующие правила: 1. С увеличением молярной массы растворенного вещества его адсорбционная способность возрастает. 2. Ароматические соединения адсорбируются лучше, чем алифатические. 3. Непредельные органические соединения адсорбируются лучше, чем предельные. 4. При адсорбции предельных органических кислот и спиртов качественно соблюдается эмпирическое правило Дюкло-Траубе: Адсорбционная способность увеличивается в 3— 3,5 раза при удлинении углеводородной цепи на одно звено (-СН2-). Следует заметить, что указанные правила не выполняются для адсорбции на мелкопористых адсорбентах. 5) Влияние температуры и времени на адсорбцию Адсорбция из растворов идет медленнее адсорбции газов, так как диффузия в жидкостях протекает значительно медленнее. Она может быть ускорена перемешиванием. Особенно медленно происходит адсорбция больших молекул на мелкопористых адсорбентах, так как в этих случаях равновесие устанавливается медленно или вовсе не наступает. Повышение температуры приводит к уменьшению адсорбции. Эмульгаторы: природа, механизм действия, примеры. Типы эмульсий: чем они определяются, как их определяют? Схемы. Обращение фаз эмульсий. Роль эмульсий в биологии и медицине. Эмульгаторы - поверхностно-активные вещества, способные понижать поверхностную энергию на границе раздела фаз с образованием стабильных дисперсных систем, состоящих из внутренней дисперсной фазы, а также внешней непрерывной дисперсионной среды. Действие эмульгаторов основано на способности поверхностно-активных веществ (ПАВ) снижать энергию, необходимую для создания свободной поверхности раздела фаз. Концентрируясь на поверхность раздела смешивающихся фаз, ПАВ снижают межфазное поверхностное натяжение и обеспечивают длительную стабильность композиции. В зависимости от природы ПАВ они ускоряют образование и стабилизируют тип эмульсии, в дисперсионной среде в которой они лучше растворимы. Гидрофильные и гидрофобные эмульгаторы. В наиболее важном с практической точки зрения случае эмульгаторы представляют собой дифильные вещества, молекулы которых имеют в своём составе, как полярную (гидрофильную) группу, так и неполярную (гидрофобную) часть. В качестве примера дифильных веществ можно привести лецитин: 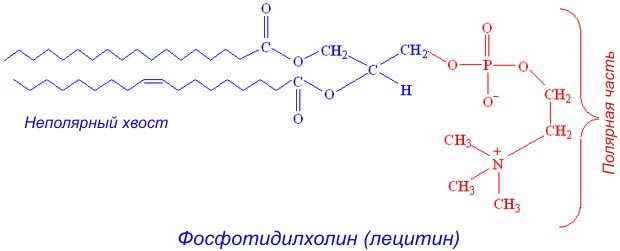 Именно благодаря наличию такой двойственной структуры становится возможной стабилизация, поскольку дифильные вещества имеют возможность одновременно взаимодействовать, как с водой и водорастворимыми веществами, так и с маслами или веществами жирной природы. Эмульгаторы, молекулы которых имеют относительно длинную гидрофобную часть, обладают преимущественно гидрофобными свойствами. Такие эмульгаторы называют гидрофобными. И, наоборот, эмульгаторы с относительно короткой гидрофобной частью, имеют большее сродство с водой и их, поэтому называют гидрофильными. Гидрофильные эмульгаторы необходимы для стабилизации эмульсий типа «масло в воде». При добавлении гидрофильного эмульгатора в такую эмульсию вокруг капельки масла образуется сплошной слой эмульгатора, сообщающий ей некоторую гидрофильность и повышающий её устойчивость (Рис. а). 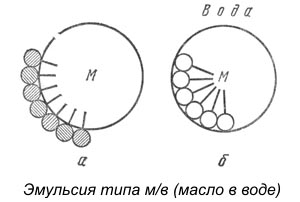 Добавление в такую же смесь гидрофобного эмульгатора, большая часть молекулы которого погружается в капельку масла, не обеспечивает устойчивости эмульсии, поскольку часть поверхности капельки остаётся «открытой» и легко может происходить слияние с другими капельками. Биологическое значение эмульсийПищевые продукты Примером эмульсий является молоко, которое представляет собой взвешенные в воде частички жира, эмульгированные белком (казеиногеном). При стоянии молока образуется слой концентрированной эмульсии (сливки). Сбивание сливок приводит к разрушению белковой оболочки, жир коалесцирует в крупные комочки сливочного масла, которое тоже представляет собой эмульсию, но уже типа «вода в масле». Аналогичными этому типу эмульсиями являются: Маргарин, Майонез, Мороженное и пр. Маргарин – эмульсия из мелкораздробленных гидрогенезированных растительных жиров. Эмульсии в физиолгии человека Эмульсии нередко встречаются в организме человека: 1. Жиры в крови и лимфе находятся в эмульгированном состоянии (эмульгатор – белки крови). 2. При пищеварении в кишечнике также образуется жировая эмульсия, но здесь стабилизатором служат соли желчных и жирных кислот. Опыты показали, что растворы солей желчных кислот могут обладать поверхностным натяжением менее 1 эрг/см2, т.е. настолько низким, что может идти самопроизвольное раздробление жира (без его механического измельчения). Таким образом, желчь имеет важное значение для переваривания и всасывания жиров в жилудочно-кишечном тракте. 3. Эритроциты в крови можно по ряду свойств рассматривать так же, как частички гидрофобной эмульсии. На их поверхности отсорбированы молекулы белков, аминокислот и ионы электролитов. Все они сообщают эритроцитам определённый отрицательный заряд, а противоионы создают некоторый диффузный слой. При паталогических процессах в организме, когда в крови увеличивается содержание некоторых видов белков (либо особого глюкопротеида, относящегося к альфа-глобулинам, либо при инфекционных заболеваниях гамма-глобулинов) происходит процесс, очень напоминающий ионообменную адсорбцию: место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещённых ими ионов. В результате заряд эритроцитов понижается, они быстрее объединяются и оседают (ускоряется реакция оседания эритроцитов – РОЭ). Этот процесс зависит ещё от ряда факторов: содержания других белковых фракция и мукополисахаридов, концентрации эритроцитов в кровии, от наличия в крови микробов, наконец, расположения сосуда, в котором наблюдается РОЭ (в частности, скорость её ниже в наклонно расположенном капиляре). Оседание эритроцитов происходит сходно с процессом седиментации гидрофобного коллоида. ИЭТ белка 5,1. Каков заряд молекул белка, растворенного в буферном растворе, приготовленном из 488 мл 0,2 М раствора КН2РО4 и 512 мл 0,2 М раствора Na2НР04? 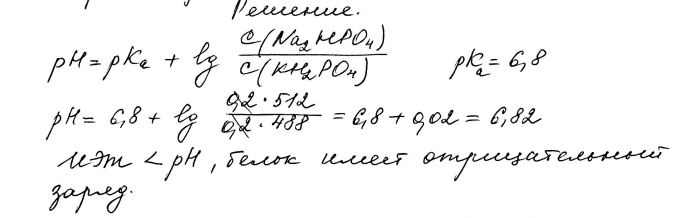 |
