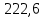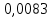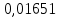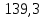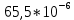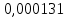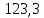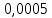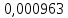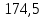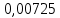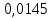Отчет Определение произведения растворимости малорастворимой соли по электрической проводимости раствора
 Скачать 40.2 Kb. Скачать 40.2 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Институт высоких технологий Кафедра химической технологии Отчет «Определение произведения растворимости малорастворимой соли по электрической проводимости раствора» по дисциплине: физическая химия Выполнил студент группы ХТТб-19-1 _______________ И. А. Пахомов  (Подпись) « »_________20___ Приняла _______________ Е. Г. Филатова  (Подпись) « »_________20___ Иркутск 2020 г. Определение произведения растворимости малорастворимой соли по электрической проводимости раствора Цель работы: Ознакомление с кондуктометрическим методом определения растворимости малорастворимых солей Задание: определить константу электролитической ячейки; измерить сопротивления растворов малорастворимых солей, рассчитать их удельную и эквивалентную электрические проводимости, рассчитать их произведения растворимости. Приборы и материалы: кондуктометр с электролитической ячейкой; термометр; стаканчики на 100–200 см3 – 4 шт. Реактивы: растворы PbCl2; PbCO3; BaF2; NiCO3; дистиллированная вода. Теоретическое введение Удельная электрическая проводимость раствора характеризует электропроводность объема раствора, заключенного между плоскопараллельными электродами площадью 1 м2 (каждый), расположенными на расстоянии 1 м друг от друга. Электрическая проводимость (или электропроводность), как явление, заключается в направленном перемещении ионов к электродам в электрическом поле, она обеспечивается потоком мигрирующих ионов, когда градиент химического потенциала исключен. Удельную электрическую проводимость можно определить экспериментально, измеряя сопротивление раствора с помощью реохордного моста (моста переменного тока) или с помощью кондуктометра. Кондуктометрический метод предполагает, что электролитическая ячейка включена в одно из плечей моста Уитстона. Если сопротивление электролитической ячейки известно из измерений, электрическую проводимость находят по уравнению 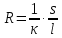 . Для любой электролитической ячейки отношение . Для любой электролитической ячейки отношение 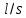 постоянно, его называют константой ячейки. Подстановка значений постоянно, его называют константой ячейки. Подстановка значений 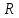 и и 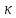 в уравнение дает значение в уравнение дает значение 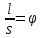 . С таким обозначением константы ячейки оно принимает вид . С таким обозначением константы ячейки оно принимает вид 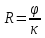 . . Удельная электрическая проводимость раствора зависит от концентрации раствора: при снижении концентрации величина 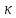 стремится к удельной электрической проводимости чистой воды, которая составляет приблизительно 10–5 См/м и обусловлена только присутствием ионов H3O+ и OH–, возникающих в результате диссоциации воды: 2H2O =H3O++ OH–. С ростом концентрации электролита стремится к удельной электрической проводимости чистой воды, которая составляет приблизительно 10–5 См/м и обусловлена только присутствием ионов H3O+ и OH–, возникающих в результате диссоциации воды: 2H2O =H3O++ OH–. С ростом концентрации электролита 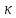 вначале возрастает, что связано с увеличением числа ионов в растворе, однако чем больше ионов в растворе, тем сильнее проявляется ион-ионное взаимодействие, приводящее к замедлению их движения и ассоциации (взаимодействию). вначале возрастает, что связано с увеличением числа ионов в растворе, однако чем больше ионов в растворе, тем сильнее проявляется ион-ионное взаимодействие, приводящее к замедлению их движения и ассоциации (взаимодействию).По закону Кольрауша удельная электрическая проводимость отражает суммарный эффект: 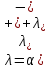 , где величины , где величины 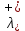 и и 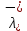 называются ионными электрическими проводимостями или подвижностями ионов.В растворах сильных электролитов степень диссоциации равна единице и тогда закон Кольрауша принимает вид называются ионными электрическими проводимостями или подвижностями ионов.В растворах сильных электролитов степень диссоциации равна единице и тогда закон Кольрауша принимает вид 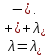 При бесконечном разведении электролита ( 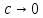 ) электрическая проводимость стремится к своему предельному значению, отвечающему отсутствию ион-ионного взаимодействия, она обозначается как ) электрическая проводимость стремится к своему предельному значению, отвечающему отсутствию ион-ионного взаимодействия, она обозначается как 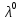 или или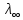 . При бесконечном разведении, когда . При бесконечном разведении, когда 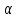 → 1, уравнение можно записать в виде → 1, уравнение можно записать в виде 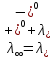 , где , где 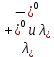 – предельные электрические проводимости (или предельные подвижности) ионов. – предельные электрические проводимости (или предельные подвижности) ионов.Произведение растворимости 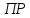 - это произведение активностей, а не концентраций ионов в насыщенном растворе электролита. - это произведение активностей, а не концентраций ионов в насыщенном растворе электролита. . . Произведение растворимости характеризует способность электролита растворяться и является важной аналитической характеристикой, например, величину 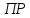 необходимо знать для реакций с образованием осадков. При данной температуре произведение растворимости является постоянной величиной, которую можно найти в справочнике физико-химических величин. необходимо знать для реакций с образованием осадков. При данной температуре произведение растворимости является постоянной величиной, которую можно найти в справочнике физико-химических величин.Порядок выполнения работы С помощью стаканчика в тщательно промытую дистиллированной водой электролитическую ячейку налить такое количество раствора хлористого калия, чтобы электроды были погружены в раствор. Измерить электрическое сопротивление налитого в ячейку раствора. При проведении замеров пользоваться инструкцией к прибору. Аналогичные замеры электрической проводимости и проделать с растворами углекислого свинца, углекислого никеля и фтористого бария. Записать полученные результаты в таблицу. Растворы хранятся над осадком собственной соли в бутылях, поэтому наливают в стаканчике осторожно, не взмучивая осадка. При переходе к следующему растворы в ячейку промывать дистиллированной водой Аналогично измерить удельную электрическую проводимость дистиллированной воды. Таблица Предельные подвижности ионов в водных растворах
Рассчитать величины 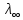 по закону Кольрауша по закону Кольрауша 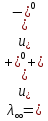 , где u+ и u- - число катионов и анионов, образующихся при диссоциации (стехиометрические коэффициенты уравнения диссоциации). Например, для PbCl2, который диссоциирует по схеме: PbCl2 = Pb2+ +2 Cl- , стехиометрические коэффициенты составляют u+ = 1 и u- = 2 , где u+ и u- - число катионов и анионов, образующихся при диссоциации (стехиометрические коэффициенты уравнения диссоциации). Например, для PbCl2, который диссоциирует по схеме: PbCl2 = Pb2+ +2 Cl- , стехиометрические коэффициенты составляют u+ = 1 и u- = 2Рассчитать молярные концентрации эквивалентов вещества по формуле: 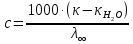 , где , где 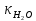 – удельная электрическая проводимость воды, равная 4,85 ·10-8 См/см при 293 К. Если экспериментально определенное значение получилось выше, используют значения и справочника. – удельная электрическая проводимость воды, равная 4,85 ·10-8 См/см при 293 К. Если экспериментально определенное значение получилось выше, используют значения и справочника.Рассчитанная по приведенному выше соотношению концентрация является концентрацией насыщенного раствора (растворимостью), по ней можно рассчитывать произведение растворимости. Для дальнейшего расчета необходимо найти ионные концентрации с+ и с- по соотношениям: 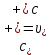 и и 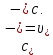 Вычислять ионные концентрации нужно из молярных, а не мольных концентраций эквивалентов, поэтому в таблице приведена еще одна колонка, куда записываются молярные концентрации растворов солей. Молярные концентрации для всех используемых солей в два раза меньше молярных концентраций эквивалентов (число эквивалентности равно двум). После вычислений ионных концентраций рассчитать произведения растворимости солей по формуле: 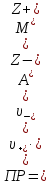 Найти справочные значения произведений растворимости используемых солей, сравнить и сделать вывод о возможностях кондуктометрических измерений. Результаты
PbCl2 = Pb2+ + 2 Cl- , u+ = 1 и u- = 2 PbCO3 = Pb2+ + CO3, u+ = 1 и u- = 1 NiCO3 = Ni2+ + CO3, u+ = 1 и u- = 1 BaF2 = Ba2+ + 2 F- , u+ = 1 и u- = 2 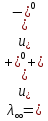 см2 ∙См/моль см2 ∙См/моль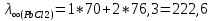 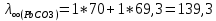 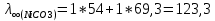 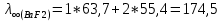 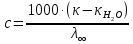 ; ; 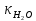 = 4,85 ·10-8 См/см при 293 К. = 4,85 ·10-8 См/см при 293 К.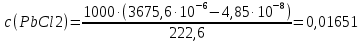 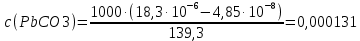 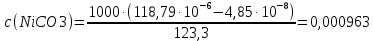 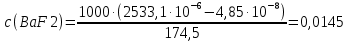 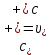 и и 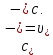 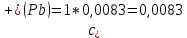 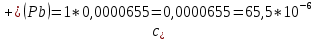 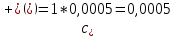 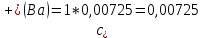 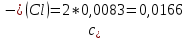 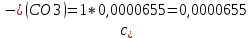 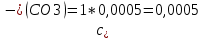 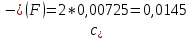  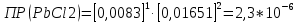 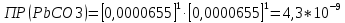 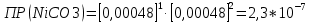 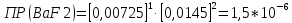 Вывод: В данной лабораторной работе мы ознакомились с кондуктометрическим методом определения растворимости малорастворимых солей. Получилось определить константу электролитической ячейки, измерить сопротивления растворов малорастворимых солей, рассчитать их удельную и эквивалентную электрические проводимости и рассчитать их произведения растворимости. Почему насыщенные растворы малорастворимых солей относятся к предельно разбавленным растворам? Малорастворимые соли над своим осадком находятся в состоянии насыщения и в то же время это состояние раствора соответствует предельно разбавленным условиям. При растворении соли в насыщенном растворе устанавливается равновесие между твердой солью и его растворам. Что такое произведение растворимости и какую информацию несет эти величина? Произведение растворимости 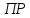 - это произведение активностей ионов в насыщенном растворе электролита. - это произведение активностей ионов в насыщенном растворе электролита.  . Характеризует способность электролита растворяться. При данной температуре произведение растворимости является постоянной величиной, которую можно найти в справочнике физико-химических величин. . Характеризует способность электролита растворяться. При данной температуре произведение растворимости является постоянной величиной, которую можно найти в справочнике физико-химических величин.В чем заключается методика экспериментального измерения электролитической проводимости растворов электролитов? Удельная электрическая проводимость раствора характеризует электропроводность объема раствора, заключенного между плоскопараллельными электродами площадью 1 м2 (каждый), расположенными на расстоянии 1 м друг от друга. Можно определить экспериментально, измеряя сопротивление раствора с помощью реохордного моста (моста переменного тока) или с помощью кондуктометра. Какой вид имеет уравнение закона Кольрауша для предельно разбавленных растворов? 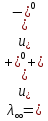 , где u+ и u- - число катионов и анионов, образующихся при диссоциации (стехиометрические коэффициенты уравнения диссоциации). , где u+ и u- - число катионов и анионов, образующихся при диссоциации (стехиометрические коэффициенты уравнения диссоциации).На чем основан метод определения растворимости соли по удельной электрической проводимости раствора? По величине удельной электрической проводимости насыщенного раствора труднорастворимой соли можно найти ее концентрацию, а следовательно, вычислить растворимость и произведение растворимости. От каких факторов зависит произведение растворимости малорастворимой соли? Одноименный ион. Если в растворе находится избыток одноименного иона труднорастворимой соли, то растворимость осадка определяется концентрацией в растворе другого иона соли. Растворимость осадка в присутствии одноименного иона понижается. Ионная сила раствора. Противоположное влияние на растворимость оказывает присутствие в растворе сильного электролита, не содержащего одноименного иона с осадком. Повышение растворимости соли в этом случае называется солевым эффектом. Влияние рН. Для осадков гидроксидов и малорастворимых солей, в состав которых входят анионы слабых кислот, повышение кислотности раствора увеличивает их растворимость в воде. Расчеты позволяют определить растворимость соединений при определенном значении рН раствора, а так же вычислить рН, при котором возможно образование или растворение осадка. Комплексообразование. На растворимость осадка может оказывать влияние образование растворимых комплексных соединений. В этом случае растворимость увеличивается в результате протекания конкурирующей реакции, например, в присутствии аммиака растворимость хлорида серебра растет |

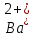
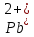
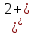
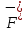
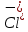
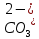
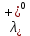 , см2 ∙См/моль
, см2 ∙См/моль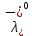 , см2 ∙См/моль
, см2 ∙См/моль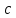 , МЭ
, МЭ