|
ВАРИАНТ 7
Задача 7. Какое количество воды и нитрата калия необходимо для приготовления 400 г 20%-ного раствора?
Решение
Массовая доля вещества в растворе находится по формуле

откуда масса нитрата калия KNO3
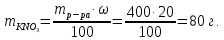
Тогда количество воды:
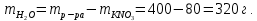
Ответ: 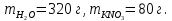
31. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2.
если соляная кислота взята в небольшом избытке, то:
Sn(OH)2 + 2HCl -> SnCl2 + 2H2O
- если соляная кислота взята в большом избытке, то образуется комплекс:
Sn(OH)2 + 4HCl -> H2[SnCl4] + 2H2O
- если соляная кислота взята в недостатке или стехиометрически, то образуется основная соль:
Sn(OH)2 + 2HCl -> SnCl2 + 2H2O
SnCl2 + H2O -> Sn(OH)Cl + HCl
1б)если щелочь в избытке, то будет комплекс:
BeSO4 + 4KOH -> K2[Be(OH)4] + K2SO4
- в противном случае:
BeSO4 + 2KOH -> Be(OH)2 + K2SO4
1в)2NH4Cl + Ba(OH)2 -> 2NH3 + BaCl2 + 2H2O
чтобы написать ионно-молекулярные уравнения реакций используйте таблицу растворимости и помните что ионы распадаются только сильные электролиты
Задача 99. Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния?
Решение
Временная жесткость воды обусловлена наличием соли гидрокарбоната магния.
Найдем молярную массу гидрокарбоната магния:
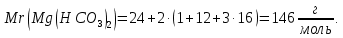
Найдем молярную массу эквивалента гидрокарбоната магния:
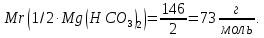
Тогда жесткость воды равна
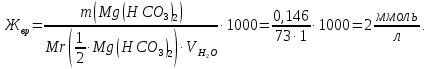
Ответ: 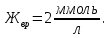
118. Напишите окислительно-восстановительную реакцию KMnO4+HCl→KCl+MnCl2+Cl2+H2O, подберите коэффициенты, составив ионно-электронный баланс. Какие свойства проявляет нитрит калия в данном процессе:
Zn+KNO2+KOH+H2O→K2[Zn(OH)4]+NH3.
Задача 175. Потенциал электрода Pt, H2/[NaOH] = x моль/л равен – 767 мв. Какова нормальность раствора едкого натра?
Решение
Электродный потенциал металла
Е = –767 мВ = –0,767 В.
Стандартный электронный потенциал
Е° (2Н+/Н2) =0, поэтому в общем случае потенциал водородного электрода по уравнению Нернста при 25°C равен:
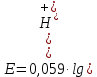
Учитывая, что –lg [Н+] = рН, получим формулу для определения рН по потенциалу водородного электрода:


Отсюда,

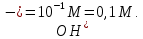
рОН = 14-13=1, [ОН-] = 10^-1M = 0,1М
Т.е. См(КОН)=0,1М
Титр определяем по формуле:
Т = Сн ∙ Мэ(КОН) / 1000
См = Сн ∙ fэ
Щелочь однокислотная, поэтому fэ = 1,
а Мэ(КОН)=М(КОН), отсюда:
T(КOH)=0,1моль ∙ 56 г/моль / 1000 мл = 0,0056 г/мл
Задача 210. На сколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах.
Решение
Массу уменьшения серебряного анода находим из уравнения Фарадея, имея в виду, что 38 мин 20 с = 2300 с и МЭ(Ag) = 107,868 г/моль, получим:
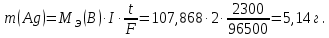
где m(B) – масса выделившегося вещества, г;
VЭ – эквивалентный объём газа, л/моль;
МЭ(В) – масса эквивалента вещества, г/моль;
I– сила тока, А;
t– время, с;
F – число Фарадея, 96500 Кл/моль.
Электронные уравнения процессов, происходящих на графитовых электродах при электролизе АgNO3:
Стандартный электродный потенциал системы Ag+ +  = Ag0 (+0,80 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае на катоде будет происходить электрохимическое восстановление меди Ag+: = Ag0 (+0,80 В) значительно положительнее потенциала водородного электрода в кислой среде (0,00 В). В этом случае на катоде будет происходить электрохимическое восстановление меди Ag+:
Ag+ +  = Ag0 = Ag0
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О - 4 = О2↑ + 4Н+, = О2↑ + 4Н+,
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал, характеризующий систему из кислородной кислоты. Ионы NO3-, движущиеся при этом к аноду, будут накапливаться в анодном пространстве.
Ответ: масса серебряного анода уменьшиться на 5,14 г.
Задача 236. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
Решение
Для предотвращения коррозии свинцовой оболочки кабеля целесообразней выбрать для протекторной защиты металл, который является более активным, чем свинец. Из предложенных металлов (цинк, магний и хром) наиболее активным металлом является магний, поэтому целесообразней использовать для протекторной защиты свинцового кабеля именно магний. Объясняется это тем, что потенциал магния (-2,36 В) наиболее электроотрицателен, чем потенциалы цинка (-0,763 В) и хрома (-0,913 В). При таком контакте возникает гальваническая пара Mg - Pb и коррозии подвергается протектор, а не сам свинцовый кабель. При этом протекают следующие электрохимические процессы:
Анодный процесс: Mg0 - 2 = Mg2+; = Mg2+;
Катодный процесс: в нейтральной или щелочной среде: ½ O2 + H2O + 2 = 2OH-; = 2OH-;
Таким образом, магний разрушается, окисляясь до ионов Mg2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Mg(OH)2.
Ответ: магний (Mg).
269. Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2] –, [Ag(NH3)2]+, [Ag(SCN)2] –. Зная, что они соответственно равны 1,0·10–21; 6,8·10–8; 2,0·10–11, укажите, в каком растворе, содержащем эти ионы, при равной молярной концентрации ионов Ag+больше?
| |
 Скачать 23.81 Kb.
Скачать 23.81 Kb.