ТЭД. ТЭД- теория. Основные положения теории электролитической диссоциации. Сильные и слабые электролиты. Ионный состав раствора, степень диссоциации. Реакции ионного обмена, причины протекания до конца
 Скачать 77 Kb. Скачать 77 Kb.
|
|
Основные положения теории электролитической диссоциации. Сильные и слабые электролиты. Ионный состав раствора, степень диссоциации. Реакции ионного обмена, причины протекания до конца. Электролиты – это вещества, растворы и расплавы которых проводят электрический ток. Частицы, которые проводят ток в растворе – это ионы. Они образуются из твердых веществ при их растворении. Ионы – заряженные частицы: Cl-, Cu2+, NO3- Катионы – ионы с зарядом + Анионы – ионы с зарядом – Процесс распада электролитов на ионы в процессе растворения или расплавления называется ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИЕЙ. К электролитам относятся: 1) вещества, имеющие ионную кристаллическую решетку (соли, гидроксиды) – содержат ионы уже в твёрдом состоянии; 2) вещества с ковалентной сильно полярной связью (кислоты), в процессе растворения образующие ионы. Неэлектролитами является большинство органических веществ (спирты, эфиры, альдегиды, углеводороды, углеводы), оксиды Как происходит процесс растворения электролита? Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой - положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным - к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности. Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации. При растворении молекулы с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. 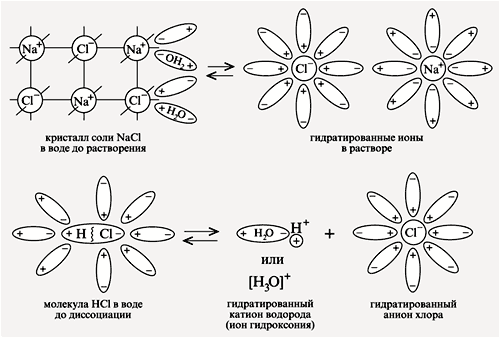 При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Характеристикой глубины протекания процесса диссоциации является степень диссоциации. Степень диссоциации – это отношение числа продиссоциировавших молекул к общему числу молекул растворённого электролита: N(продисс) α = ----------------- N(общ) Степень диссоциации меняется от 0 до 1 (или от 0% до 100%). Если степень диссоциации равна 0 – вещество относится к неэлектролитам. Степень диссоциации веществ – величина, зависящая от различных факторов: чем выше температура, тем степень диссоциации выше; чем больше концентрация вещества, тем степень диссоциации меньше. По степени диссоциации электролиты делят на сильные и слабые:
Процесс диссоциации можно записать следующим образом: 1. Если электролит – сильный, он диссоциирует полностью в одну ступень, все молекулы превращаются в ионы: Cu(NO3)2 Cu2+ + 2NO3- (α=1) Ва(OH)2 Ba2+ + 2OH- (α=1) KAl(SO4)2 K+ + Al3+ +2SO42- (α=1) 2. Если электролит – слабый, он диссоциирует по ступеням, процесс диссоциации обратимый, степень диссоциации на каждой следующей ступени гораздо меньше, чем на предыдущей: H2S ⇄ H+ + HS- (α < 1) HS- ⇄ H+ + S2- (α << 1) Mg(OH)2 ⇄ Mg(OH)+ + OH-(α < 1) Mg(OH)+ ⇄ Mg2+ + OH- (α << 1) 3. Если в составе вещества есть связи разных типов, то сначала диссоциируют ионные связи, затем наиболее полярные: NaHCO3 Na+ + HCO3- (α=1) HCO3- ⇄ H+ + CO32- (α < 1) Cu(OH)Cl CuOH+ + Cl- (α=1) CuOH+ ⇄ Cu2+ + OH- (α < 1) Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакций происходит обмен ионами – они называются ионными. Примеры: ZnO + Н2SО4 = ZnSО4 + Н2О, AgNО3 + КВr = АgВr↓ + КNО3, СrСl3 + 3NаОН = Сr(ОН)3 ↓+ 3NаСl В каком случае возможна химическая реакция между двумя электролитами? Правило Бертолле Реакции обмена в растворах электролитов возможны только тогда, когда в результате реакции образуется: 1. нерастворимое или малорастворимое вещество, 2. газообразное вещество 3. малодиссоциирующее вещество, то есть слабый электролит. Составление уравнений реакций ионного обмена:1.Записываем молекулярное уравнение реакции, не забудьте расставить коэффициенты: 3NaOH + FeCl3 = Fe(OH)3 + 3NaCl 2.С помощью таблицы растворимости определяем растворимость каждого вещества. р р н р 3NaOH + FeCl3 = Fe(OH)3 + 3NaCl 3.Составляем полное ионное уравнение. Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул. 3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3Cl- 4.Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа. 5.Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции). Fe3+ + 3OH- = Fe(OH)3 Правила написания ионной формы:1.В виде ионов не представляют: неэлектролиты (оксиды, простые вещества); осадки; газы; воду; слабые кислоты и основания. 2. Ионы кислотных остатков кислых солей (НСО3-, Н2РО4-) и основных солей Al(OH)2+ - пишут целиком. 3.Суммарный заряд в правой и левой части уравнения должен быть одинаковым. |
