химия ент. Химия ент. Слабый электролит
 Скачать 52 Kb. Скачать 52 Kb.
|
|
Слабый электролит неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H3PO4, H2SiO3, HCNS, HСlO и др.); вода (H2O); гидроксид аммония (NH4OH); большинство органических кислот (например, уксусная CH3COOH, муравьиная HCOOH); Степень диссоциации ортофосфорной кислоты,если из 800 молекул диссоциации подверглось 50 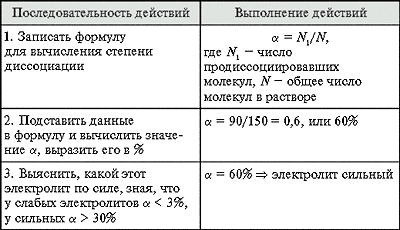 50/800=0,0625*100=6,25% Элемент Э в формуле H2ЭO4 Ответ: Si Уксусная кислота является гомологом кислоты Ответ :С3Н7СООН Бутановая (масляная) Молекулярная масса вещества,если относительная плотность его паров по водороду 80 Состав английской соли, применяемой в медицине для лечения некоторых заболеваний нервной системы и для снижения высокого кровяного давления: (Mg) = 9,86%; (S) = 13,01%; (O) = 71,4%; (H) = 5,73%. Определите его формулу. Ответ: MgSO4 · 7H2O Расположите оксиды в порядке увеличения их кислотных свойств: Р2O5, SO3, N20, Аl2O3, Cl2O7, MgO. Ответ: Na2O, MgO, Аl2O3, Р2O5, SO3, Сl2O7. Электролит средней силы:азотистая кислота макромолекула целлюлозы состоит из остатков:В-глюкозы Переработка каменного угля в печах без доступа воздуха - Коксование Вычислите объём (н. у.),который занимают 32 г метана CH4 V = n * Vm n = m/M M(CH4) = 12 + 1*4 = 16 г/моль n(CH4) = 32 г / 16 г/моль = 2 моль V(CH4) = 2 моль * 22,4 дм3/моль = 44,8 дм3 Ответ: 44,8 дм3 (или же 44,8 л) Наиболее сильной кислотой является высший гидрооксид элемента: Для фосфора: P2O5 (оксид фосфора V), ему соответствует H3PO4 (фосфорная кислота) с наиболее выраженными кислотными свойствами. Для кремния: SiO3 (оксид кремния VI), ему соответствует H2SiO3 (кремниевая кислота) с наиболее выраженными кислотными свойствами. Для хлора: Cl2O7 (оксид хлора VII), соответствующая ему кислота — HClO4. Для серы: SO3 (оксид серы VI), ему соответствует H2SO4 (серная кислота). по электропроводности алюминий уступает:золоту,серебру,меди электронная формула меди: 1s2 2s2 2p6 3s2 3p6 4s1 3d10 бесцветный газ с резким удушающим запахом, легче воздуха, хорошо растворим в воде:NH3 общей формуле углеводов Сn(H2O)m (n=m) не соотвествует формула:дезоксирибозы электролит средней силы:азотистая кислота Переработка каменного угля в герметичных печах без доступа воздуха-это коксование Наиболее сильной кислотой является высший гидрооксид эелемента:сера Вещество х1 в цепочке превращений CH4---1500*--Х1----t0.Cакт---Х2----+Cl2.hv---Х3 Х1-С2Н2,Х2-С6Н6,Х3-С6Н6Сl6 Дихлоралкан:С2Н4Cl2 реакция в результате которой образуется газ это реакция: NaHCO3 + HCl = NaCl + H2O + CO2 Na2S + H2SO4 ----> Na2SO4 + H2S Zn + HCl Характеристика аллюминия:Имеет постояную валентность,металл 3 а группы,p-элемент Этилацетат реагирует с:водой,КОН Полному гидролизу подвергается соль:сульфид алюминия Полупроводниковыми свойствами обладает:алмаз Общим для крахмала и целлюлозы является:степень полимеризации сложные эфиры являются межклассовыми изомерами:карбоновых кислот амфотерные свойства цинк проявляет при взаимодействии с:HCL.KOH Химическое явление:Гниение листьев Ион металла окрашивающий пламя в желтый цвет:натрий Длина связи между атомами углерода и молекуле бензола:0,140 Одноосновной предельной насыщенной карбоновой кислотой с молярной массой 88 г/моль являются обе кислоты в паре:С3Н7СООН масляная и 2 метилпропановая не образует структурных изомеров:метан,этан,пропан аллотропные модификации углерода:карбин,графит,алмаз,фуллерен В реакцию этерификации вступило 6г предельной одноосновной кислоты и 4,6 г этилового спирта.Полученный эфир и его изомер : этиловый эфир уксусной кислоты-метилпропионат, этилтаноат-метилпропаноат этилацетат-метиловый эфир пропионовой кислоты влияние концентрации реагирующих веществ на скорость реакции подчиняется закону:закон действующих масс Простые вещества в ряду:графит и карбин Наибольший радиус атома имеет:франции Для определения возраста исторических предметов используется радиоактивный изотоп углерода: С14 Общая формула полисахаридов:(С6Н10О5)n Молярная масса первого члена гомологического ряда трехатомных спиртов:С3Н8О3-92 Качественной реакцией на ионы меди +2 является взаймодействие с:KOH Преимущество бензина каталитического крекинга от термического:устойчив при хранении Вещества образующие при полной диссоциации катионы металла и водорода анионы кислотного остатка;NaHCO3,KHSO4 Слабым электиролитом является:H2S,CH3COOH В парообразном состоянии молекулы серы в зависимости от температуры могут состоять из: 6, 4-х и 2-х атомов. Содержит двойную связь:алкен,алкадиен,кетоны Соль гидролизующаяся только по катиону:NH4Cl,Cu(NO3)2.Al2(SO4)3 Свойства оксида углерода (4):Тяжелее воздуха,парниковый воздух,не имеет запаха Водород взаймодействует с:алкеном,этаналь, Непредельные карбоновые кислоты:пропеновая(акриловая),бутеновая (винилуксусная),кротоновая,олеиновая,линовая,леноленовая,арахидоновая,фуморовая Предельные карбоновые кислоты:пальмитиновая,стеариновая Количество гидроксильных группе в молкуле глюкозы:5 Степень гидролиза можно рассчитать по формуле:число молекул подвергшихся гидролизу / общее число молекул На смещение химического равновесия в системе не оказывает влияния:степень измельчения вещества Металлы побочных подгрупп это элементы:d-f Характерно для бензола:жидкость легче воды Состав аниона образованного на второй ступени диссоциации ортофосфорной кислоты: Первая ступень – это образование – дигидрофосфат – ионов H3PO4 ⇆ H2PO4- Вторая ступень – это образование гидрофосфат – ионов H2PO4- ⇆ H+ + HPO42- Третья ступень – это образование фосфат – ионов HPO42- ⇆ H + PO43- Атомы щелочных металлов:расположены в периодичекой системе только в главной подгруппе,имеют на наружном энергетическом уровне 1 электрон,являются элементами и малых и больших периодов Формула толуола:С7Н8,С6Н5СН3 Фенолфталеин становится малиновым в растворе:Na2CO3.K2SiO3.K2S. Главное квантовое число харктеризует :общий запас энергии электрона Строение внешнего энергетического уровня атомов элементов va группы:ns2np3 Качественной реакцией на альдегиды является реакция с :аммиачным раствором оксида серебра Молекулярная формула дивинила (каучук,бутадиен-1,3):С4Н6 Какой объем (н. у) ацителена получится из карбида кальция массой 80 г содержащего 10% примесей: CaC2+2H2O=Ca (OH) 2+C2H2 m CaC2 чист = 80 г * (1-0,1) = 72 г n CaC2 = 72 г/64 г/моль=1,125 моль n C2H2=n CaC2=1.125 моль V C2H2 = 1.125 моль*22,4 л/моль=25,2 л Как многоатомный спирт глюкоза реагирует с гидроксидом меди(II) с образованием :ярко-синего раствора гликозида меди(II) Аллотропные модификации серы;ромбическая,моноклинная,пластическая Циклоалканы:СnH2n Не образуют структуных изомеров;метан,этан,пропан |
