генная инженерия. Отчет. Отчет по лабораторным работам по дисциплине Генная инженерия в декоративном растениеводстве
 Скачать 1.68 Mb. Скачать 1.68 Mb.
|
|
Тема 4. Организация и оборудование биотехнологической лаборатории. Для организации биотехнологической лаборатории необходимы просторные изолированные помещения, а также современное оборудование и высококачественные реактивы. Для удобства проведения дезинфекции полы стены и потолок в помещениях должны иметь водостойкое и ультрофиолетоустойчивое покрытие. Оборудование моечного помещения: мойки с горячей и холодной водой; дистиллированная вода; дистилляторы и бидистилляторы; сушильные шкафы с режимом работы для сушки посуды – до 100-130оС, для инструментов – до 170оС; шкафы для хранения чистой посуды и инструментов, емкости для хранения моющих средств, вытяжные шкафы с эксикаторами для хромпика (H2SO4 98% + K2CrO7). Оборудование помещения для приготовления питательных сред: лабораторные столы; холодильники для хранения маточных растворов солей, гормонов и витаминов; аналитические и торсионные весы; иономер; магнитные мешалки; плитки, газовые горелки; набор посуды (колбы, стаканы, мерные цилиндры, мензурки, пробирки и др.), необходимый набор химических реактивов надлежащей степени чистоты (ХЧ, Ч, ЧДА). Оборудование помещения для стерилизации: автоклавы с режимом работы – давление 1-2 атмосферы и температура 120оС; стеллажи для штативов с питательными средами; шкафы для хранения стерильных материалов. Данное помещение должно быть оборудовано приточновытяжной вентиляцией и иметь канализационный слив для отвода конденсата из автоклава. Оборудование помещения для инокуляции растительных эксплантов на питательные среды: ламинар-боксы, лабораторные столы, стеллажи, бактерицидные лампы, шкафы для материалов и оборудования. Оборудование культуральных помещений: световое отделение – источники освещения со спектром близким к спектру дневного света (от 3 до 10 kLx), кондиционер для регуляции температуры (25±2оС) и влажности воздуха (70 %), стеллажи для штативов с культивируемым материалом; темновое отделение – с тем же оборудованием, исключая источники освещения. Для культивирования эксплантов на питательной среде желательно использовать термостаты или хладотермостаты, способные с высокой точностью поддерживать задаваемые режимы температуры и влажности воздуха. Необходимый набор посуды, инструментов и материалов в биотехнологической лаборатории: мерные колбы, колбы Эрленмейера, химические стаканы, мерные цилиндры, чашки Петри, пробирки, бутылки, пипетки, стеклянные палочки, стеклянные и мембранные фильтры, ланцеты (в том числе глазные, хирургические, анатомические), ножницы, пинцеты, ножи, бритвенные лезвия, препарировальные иглы, шпатели, бумага (оберточная, пергаментная, фильтровальная), фольга алюминиевая, вата, марля, шпагат. Тема 5. Создание стерильных условий. Стерилизация растительного материала Стерилизация – полное уничтожение микроорганизмов и их покоящихся форм (например, спор). В случае нарушения условий стерильности в биотехнологической лаборатории на средах хорошо развиваются микроорганизмы (грибы, бактерии), нарушающие состав среды и подавляющие рост растительных эксплантов. Существуют разные методы стерилизации: – влажным паром (автоклавирование); – сухим паром, (сухожаровой шкаф); – облучение ультрафиолетовыми лучами; – обработка химическими веществами (спирт, серная кислота, перманганат калия, хлорамин и т. д.); – стерилизация обжиганием в пламени горелки; – стерилизация кипячением. Стерилизация посуды. Большинство культур в лабораторных условиях выращивают в пробирках, колбах Эрленмейера различного объема и чашках Петри одно- или многоразового использования. Вначале посуду тщательно моют с использованием детергентов, а также раствора двухромовокислого калия в серной кислоте (хромпика). Вымытую посуду ополаскивают водопроводной, затем дистиллированной водой и высушивают в сушильном шкафу. Чтобы избежать заражения стерильных предметов из воздуха, перед стерилизацией их закрывают ватными пробками, заворачивают в оберточную (пергаментную) бумагу или закрывают фольгой (у стаканов, колб достаточно завернуть только горлышко). При сухом способе стерилизации чашки Петри, колбы, стаканы, завернутые в плотную бумагу, стерилизуют в сушильном шкафу при температуре 140 оС в течение 2 часов, при температуре 180 оС – 30 минут. При более высоких температурах ватные пробки буреют, а бумага становится ломкой. Стерилизация инструментов. Инструменты (скальпели, пинцеты, иглы и т. д.) стерилизуют в сушильном шкафу. Шприцы, ножницы, пробочные сверла удобнее кипятить. Металлические предметы нельзя автоклавировать: под воздействием пара они ржавеют и тупятся. Непосредственно перед работой и в процессе её инструменты помещают в стакан со спиртом и обжигают в пламени спиртовки. 20 Стерильный инструмент используют только для одноразовой манипуляции! Перед повторным употреблением его снова окунают в спирт и обжигают в пламени спиртовки. Стерилизация материалов. Вату, марлю, ватные пробки, фильтровальную бумагу, халаты, косынки стерилизуют в автоклаве под давлением 2 атм в течение 25–30 мин. Тема 6. Приготовление и стерилизация питательных сред. Растение - груша. Изобретение относится к биотехнологии и может применяться в сельском хозяйстве для микроклонального размножения груши. Предлагаемая питательная среда, составленная по прописи основной среды Мурасиге-Скуга (1962), дополнительно содержит в качестве стимулятора роста настойку лимонника 15-30 капель на 1 л среды. Изобретение позволяет сократить сроки получения полноценных регенерантов, в несколько раз повысить коэффициент размножения и существенно снизить себестоимость питательной среды. 2 табл. 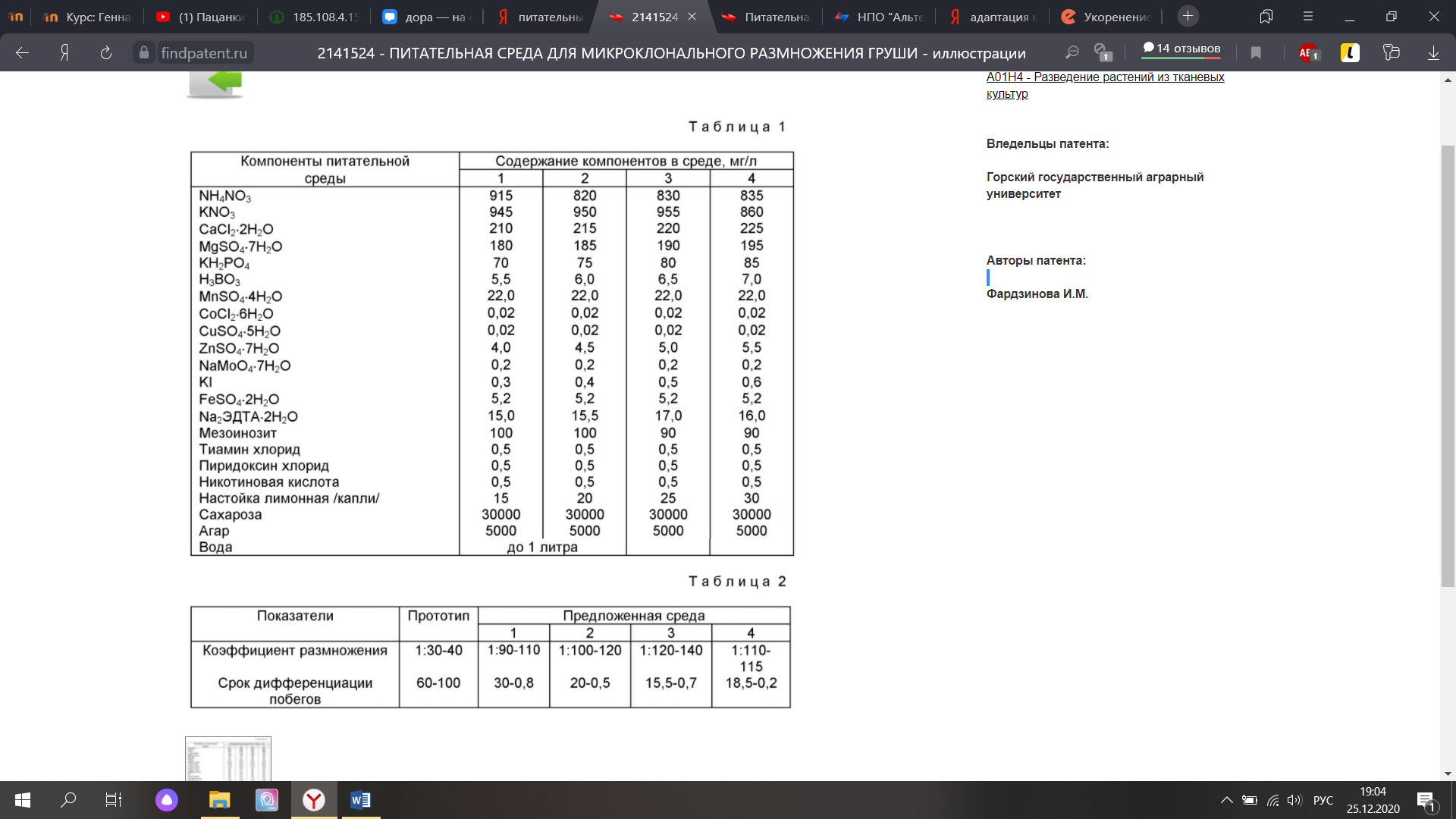 Сущность изобретения: питательная среда на основе половинной концентрации макро- и микросолей среды Мурасиге-Скуга содержит в качестве стимулятора роста настойку лимонника 15 - 30 капель на 1 литр среды. 2 табл. Известны питательные среды, используемые для биотехнического размножения груши: /Lane D.W. (1979) Regeneration of pear plauts from shoot meristem tips.-Pl.Sci.Letter, 16, 337-342; Здруйковская-Рихтер А.И. Воспитание зародышей груши на искусственной питательной среде. Тр. Гос. Никит. бот. сада, 36 /1962/. https://findpatent.ru/patent/214/2141524.html Недостатками этих сред являются длительный период дифференциации эксплантов и развития побегов, сравнительно невысокий коэффициент размножения, дороговизна применяемых стимуляторов роста. Наиболее близкой по технической сущности к изобретению является среда Мурасиге-Скуга /1962/-Туровская-Микроразмножение груши. Садоводство, 1987, 6, с. 22-24. Состав среды прототипа следующий, мг/л: NH4NO3 - 1650 KNO3 - 1900 CaCl2 Тиамин хлорид - 0,2 Пиридоксин хлорид - 0,5 Никотиновая кислота - 0,5 Аскорбиновая кислота - 1,5 Мезоинозит – 100 6-БАП - 1,0 Целью изобретения является сокращение срока размножения, уменьшение себестоимости питательной среды. Цель достигается тем, что предлагаемая питательная среда для микроклонирования, содержащая половинную концентрацию макро- и микросолей по прописи среды Мурасиге-Скуга, в качестве стимулятора роста содержит настойку лимонника 15 - 30 капель на 1 л среды, выпускаемую медицинской промышленностью для лечебных целей. Благодаря новой совокупности компонентов достигается положительный эффект, а именно значительно сокращаются сроки размножения побегов и тем самым повышается коэффициент размножения, а также повышается эффективность выхода стандартных черенков для следующего этапа - укоренения. Формула изобретения Питательная среда для микроклонального размножения груши, мг/л: Аммоний азотнокислый - 815 – 835 Калий азотнокислый - 945 – 960 Кальций хлористый двухводный - 210 – 225 Магний сернокислый семиводный - 180 – 195 Калий фосфорнокислый однозамещенный - 70 – 85 Борная кислота - 5,5 - 7,0 Марганец сернокислый четырехводный - 22,0 Кобальт хлористый шестиводный - 0,02 Медь сернокислая пятиводная - 0,02 Цинк сернокислый семиводный - 4,0 - 5,5 Натрий молибденовокислый семиводный - 0,2 Калий йодистый - 0,5 - 0,6 Железо сернокислое семиводное - 5,2 Этилдиаминтетрауксусный натрий двухводный - 1,5 Мезоинозит - 100,0 6-Бензиламинопурин - 1,0 Тиамин хлорид - 0,5 Пиридоксин хлорид - 0,5 Никотиновая кислота - 0,5 Настойка лимонника (капли) - 15 – 30 Сахароза – 30000 Агар – 5000 Вода - Остальное Тема 7. Стерилизация эксплантов и введение в культуру in vitro В культуру in vitro вводили меристематические верхушки размером 0,2-0,4 см, которые изолировали из развивающихся почек, освобождая их от покровных тканей, что обеспечивало достаточно эффективную стерилизацию. https://findpatent.ru/patent/214/2141524.html В качестве стерилизующих агентов использовали 0,2 % раствор ртути HgCl2 с экспозициями 3 и 4 минуты, 5% гипохлорид натрия «Доместос» в соотношении 1:2 с экспозицией 3 минут, «Доместос» в соотношении 1:5 с экспозицией 15 мин., раствор гипохлорид натрия «Белизна», содержащий гипохлорид натрия, «Белизна» 1:2 с экспозицией 3 мин., «Белизна» 1:5 с экспозицией 5 мин., «Деохлор» 1% 5 мин., чистящие средства «Vanish» без разведения 15 мин., «Мистер Мускул» без разведения. В работах Harvey A.E., Grasham J.L. применение 5,25% гипохлорита натрия и 3% перекиси водорода оказалось эффективным для поверхностной стерилизации годичных стеблей. В результате эксперимента установлено, что наиболее оптимальными стерилизующими агентами верхушек побегов груши при введении в асептическую культуру являются обработка: а) Белизна 1:5 с экспозицией 5 мин. выход стерильных эксплантов составил при этом 93%; б) Доместос 1:2 с экспозицией 4 минуты, выход стерильных эксплантов составил при этом 80%; в) Доместос 1:5 с экспозицией 15 минут жизнеспособных эксплантов составило 60%. В наших исследованиях было установлено, что из всех испытанных стерилизующих агентов лучшим стерилизующим и менее опасным являлся гипохлорид натрия «Белизна» в соотношении 1:5 с экспозицией 5 минут. Тема 8. Получение каллуса и его культивирование Для растения in vivo каллюс – это группа клеток, возникающая при травмах и защищающая место поранения (раневая паренхима). В ней накапливаются питательные вещества для регенерации анатомических структур или утраченного органа. Каллюс в условиях in vitro представляет собой ткань, состоящую из дедифференцированных клеток, характеризующихся постоянным неорганизованным ростом и пролиферацией. На питательных средах с большим содержанием ауксинов или их синтетических аналогов клетки экспланта дедифференцируются и переходят к пролиферации. Клетки утрачивают прежние функции и морфологию. Причем, чем меньше структурно и химически дифференцирована клетка, тем легче получить каллюс. Каллюсные ткани способны образовываться практически из любой части растения: из асептически проросшего семени, отрезков стеблей и корней, изолированной паренхимы корнеплода, изолированной сердцевины стеблей, из тканей, которые содержат камбий (стебель и корень), из листьев, органов цветка, зародышей, плодов. Каллюс, выращиваемый поверхностным способом, представляет собой аморфную массу тонкостенных паренхимных клеток, не имеющих строго определенной структуры. Клетки каллюса либо бесцветны, либо имеют желтоватый или зеленоватый оттенок. В зависимости от происхождения, условий культивирования и плотности каллюсных тканей различают каллюсы: 1) рыхлые, с сильно оводненными, легко отделяющимися друг от друга клетками; 2) средней плотности, с зонами меристематической активности; 3) плотные, с зонами редуцированного камбия и сосудов. Получение первичного каллюса из асептических проростков. В биотехнологии для образования первичной каллюсной ткани принято использовать экспланты, полученные либо из непосредственно выращенного в естественных условиях растения, либо из асептических проростков. Последние получают путем проращивания стерильных семян в пробирках с питательной средой. В дополнительной стерилизации экспланты, отобранные из незагрязненных инфекцией пробирок, не нуждаются. Получение первичного каллюса из листовых эксплантов интактного растения. Экспланты листьев большинства видов в условиях in vitro способны к образованию каллюса в раневой зоне. Культуру клеток листа используют также для размножения некоторых видов растений. Для культивирования листьев большинства растений, как правило, используют среду Мурасиге-Скуга, Уайта, Эйлера, Гамборга (В5). Получение каллюса из зрелых зародышей. Эксплантом для индукции первичного каллюсогенеза может быть любой орган растения. Однако максимально легко вводятся в культуру меристематические ткани. Поэтому прорастающие семена, где в растущем зародыше все ткани представлены меристематическими, часто используют для получения первичных каллюсных тканей. Тема 9. Адаптация микрорегенерантов, полученных методом «in vitro», к условиям внешней среды Проводили исследования развития меристем боковых почек у сорта груши Кюре. В асептических условиях извлекали меристемы 1 - 2 мм длиной и помещали их на питательные среды используемых составов /табл. 1./ Питательные среды готовили общепринятыми методами. Пробирки с эксплантами ставили на рост в термокамеру со следующими условиями: температура 25 - 27oC, освещенность 2000 лк, длительность светового дня 16 часов, влажность 70%. Через 15 - 20 дней каждый эксплант дифференцировал до 25 побегов длиной 1,5 - 2,5 см. Для дальнейшего размножения побеги рассаживали на свежую питательную среду того же состава, и через 20 дней от единичного побега образовывался целый конгломерат побегов, количество которых доходило до 40 - 45. Для укоренения побеги помещали на питательную среду, содержащую лишь неорганические соли по рецепту среды Мурасиге-Скуга, в результате чего корни образовывались в течение 10 - 15 дней. В табл. 2 представлены основные параметры развития регенерантов при выращивании на испытуемых питательных средах с различным содержанием компонентов. Из табл. 2 следует, что питательная среда предлагаемого состава обеспечивает значительное по сравнению с прототипом сокращение сроков размножения до 15,5-0,8 дней вместо 60-100 и увеличение коэффициента размножения до 1: 120-140 вместо 1:30-40, а также повышение эффективности выхода стандартных черенков для укоренения в грунте. Использование изобретения позволяет сократить сроки размножения побегов, повысить эффективность выхода стандартных черенков при коэффициенте размножения 1:120-140, повысить процесс дифференциации эксплантов независимо от генотипа, увеличить общую производительность селекционного процесса от помещения эксплантов на питательную среду до укоренения и высадки растений в грунт, значительно снизить себестоимость питательной среды. https://findpatent.ru/patent/214/2141524.html  |
