Фотометрическое определение железа (III) в виде роданидного комплекса. 2 курс 1 лаба (роданид). Отчет по лабораторной работе 1 Фотометрическое определение железа (iii) в виде роданидного комплекса
 Скачать 79.07 Kb. Скачать 79.07 Kb.
|
 МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ  Факультет переработки минерального сырья Кафедра физической химии Отчет по лабораторной работе №1 «Фотометрическое определение железа (III) в виде роданидного комплекса» Выполнили: студенты гр. ТХН-17 _________ / Герасёв С. А. / (подпись) / Суслов А. П. / / Чунарёв В. С / (Ф.И.О.) Проверил: профессор _________ / Литвинова Т. Е./ (подпись) (Ф.И.О.) Дата: Цель работы – измерить оптические плотности отдельных растворов фотометрическим методом и построить градуировочный график, по нему же определить концентрацию катионов Fe3+ в пробе. Ход эксперимента 1. Приготовить рабочий раствор соли железа. 1.1. В маркированный химический стакан объемом 50 мл налить стандартный раствор соли железа.1.2. Из маркированного химического стакана в мерную колбу объемом 200 мл мерной пипеткой отобрать 5 мл стандартного раствора соли железа.1.3. Долить дистиллированную воду до метки на горле колбы.1.4. Закрыть колбу пробкой и перемешать, переворачивая колбу не менее 20 раз.2. Приготовить серию контрольных растворов.2.1. В мерные колбы объемом 50 мл № 2 – 6 градуированной пипеткой объемом 10 мл отобрать 2 – 4 – 6 – 8 – 10 мл рабочего раствора соли железа.2.2. В каждую колбу при помощи мерных пипеток добавить по 2 мл раствора азотной кислоты и по 5 мл раствора роданида калия (мерной пипеткой объемом 5 мл).2.3. Во все колбы долить дистиллированную воду до меток на горлах колб.2.4. Закрыть колбы пробками и перемешать, переворачивая колбы не менее 20 раз.3. Приготовить раствор сравнения.3.1. В мерную колбу объемом 50 мл № 1 при помощи мерных пипеток отобрать 2 мл раствора азотной кислоты и 5 мл 1 М раствора роданида калия.3.2. Довести объем содержимого мерной колбы до метки дистиллированной водой и перемешать.В мерной колбе № 1 получится практически бесцветный раствор сравнения, относительно которого измеряют оптические плотности окрашенных контрольных растворов роданидного комплекса железа (мерные колбы на 50 мл с № 2 по № 6).4. Подготовить пробу.4.1. В мерную колбу объемом 50 мл № 7 отобрать мерной пипеткой 5 мл исследуемого раствора.4.2. При помощи мерных пипеток к пробе раствора в мерной колбе добавить 2 мл раствора азотной кислоты и 5 мл раствора роданида калия (мерной пипеткой объемом 5 мл).4.3. Долить дистиллированную воду до метки на горле колбы.4.4. Закрыть колбу пробкой и перемешать раствор, переворачивая колбу не менее 20 раз.5. Выполнить измерение оптической плотности.5.1. Измерять оптическую плотность следует при длине волны 480 нм.5.2. Вначале измерить оптические плотности контрольных растворов, затем, ополоснув кювету, измерить оптическую плотность пробы.5.3. Начинать измерения оптической плотности контрольных растворов следует с самого разбавленного (наименее окрашенного).5.4. В кювету толщиной 1 см налить до метки раствор сравнения и насухо протереть стенки кюветы салфеткой.5.5. Кювету с раствором сравнения поместить в дальнее отделение кюветодержателя.5.6. В другую кювету толщиной 1 см налить до метки окрашенный раствор, содержащий роданидный комплекс железа (III) и насухо протереть стенки кюветы салфеткой.5.7. Кювету с окрашенным раствором поместить в ближнее отделение кюветодержателя.5.8. Кюветодержатель поместить в кюветное отделение прибора.5.9. Измерить оптическую плотность, следуя инструкции к пользованию прибором.5.10. Результаты измерений занести в таблицу № 1.5.11. Достать кюветодержатель, повторить операции с 5.6 по 5.10 со всеми растворами.5.12. Результаты измерений занести в протокол лабораторной работы.Экспериментальные данные1. Концентрация стандартного раствора соли железа (III): Сст.(Fe3+) = 2 г/л. 2. Объем стандартного раствора соли железа , использованный для приготовления рабочего раствора соли железа: Vст.(Fe3+) = 5 мл. 3. Объем приготовленного рабочего раствора соли железа (III): Vраб. = 200 мл. 4. Объем пробы исследуемого раствора, взятый для анализа Va = 5 мл. 5. Аналитическая длина волны λ =480 нм. 6. Толщина кюветы l = 1 см. 7. Значения оптической плотности контрольных растворов и пробы: Таблица 1
Обработка результатов измерений 1. Вычислить концентрацию рабочего раствора соли железа по формуле 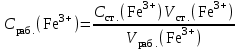 , г/л. , г/л. 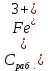 2. Рассчитать массу железа в контрольных растворах по формуле  , ,где 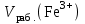 – объем рабочего раствора соли железа, взятый для получения контрольного раствора, мл, приведенный в табл. 1; – объем рабочего раствора соли железа, взятый для получения контрольного раствора, мл, приведенный в табл. 1; 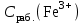 – концентрация рабочего раствора соли железа, вычисленная по формуле, мг/мл. – концентрация рабочего раствора соли железа, вычисленная по формуле, мг/мл. 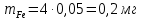   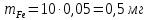 . .Данные для построения градуировочной зависимости: Таблица 2
 Получено уравнение зависимости y = 5,095x + 0,0325, где y – значения оптической плотности раствора, а x – масса Fe в растворе.  6. Рассчитать массовую концентрацию железа в пробе раствора по формуле 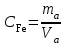 , ,где 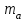 – масса железа, определенная по градуировочному графику, мг; – масса железа, определенная по градуировочному графику, мг; 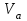 – объем пробы раствора, взятый для анализа, мл. – объем пробы раствора, взятый для анализа, мл.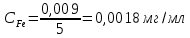 Вывод: в ходе работы фотометрическим методом были определены оптические плотности отдельных растворов. Измерения были проведены путём сравнения приготовленных проб с контрольным раствором при заданной длине волны λ=480 нм. С помощью градуировочного графика по значению полученной оптической плотности D = 0,608 было получено значение массы железа в пробе 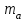 =0,009 мг. =0,009 мг. |
