ЛР1. 2588. Казаков. Химия. Отчет по лабораторной работе 1 по дисциплине Химия Тема Химические свойства кислот, оснований, солей. Студент гр. 2588 Казаков А. А
 Скачать 42.6 Kb. Скачать 42.6 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физический химии отчет по лабораторной работе №1 по дисциплине «Химия» Тема: Химические свойства кислот, оснований, солей.
Санкт-Петербург 2022 Цель работы: Изучение химические свойства кислот, оснований, солей. Основные теоретические положения: Основания (NaOH, Fe(OH)₂, Cu(OH)₂) это гидроксиды металлов, при диссоциации которых образуются гидроксид-ионы (ОН ) и основные остатки: Cu(OH)₂ ⇄ (CuOH)⁺ OH⁻ Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода ( Н⁺ ) и анионы кислотных остатков: H₂CO₃ ⇄ H⁺ + 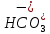 ; ;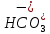 ⇄ H⁺ + ⇄ H⁺ + 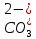 ; ;Соли (Na₂CO₃, KHSO₃ Ca(H₂PO₄)₂) – электролиты, при диссоциации которых образуются катионы основных остатков и анионы кислотных остатков Классификация оснований:
Классификация кислот:
Классификация солей:
Химические свойства оснований: Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии. Взаимодействуют с кислотными оксидами с образованием соли и воды: 2NaOH + SiO₂ → Na₂SiO₃ + H₂O. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной: 2KOH + H₂SO₄ → K₂SO₄ + 2H₂O. Реагируют с солями, образуя новые соль и основание: 2NaOH + CuSO₄ → Cu(OH)₂ + Na₂SO₄. Способны при нагревании разлагаться на воду и основной оксид: Cu(OH)₂ = CuO + H₂O. Химические свойства кислот: Диссоциация При диссоциации кислот образуются катионы водорода и анионы кислотного остатка. HNO₃ → H⁺ + NO⁻₃ HCl → H⁺ + Cl⁻ Разложение Кислородсодержащие кислоты разлагаются на оксиды и воду. H₂CO₃ → H₂O + CO₂↑ Бескислородные на простые вещества 2HCl → Cl₂ + H₂. Реакция с металлами Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород. Mg + 2HCl → MgCl₂ + H₂↑ В состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода. Au + HNO₃ + 4HCl → HAuCl₄ + NO + 2H₂O. Реакции с основаниями В результате образуются соль и вода, происходит выделение тепла. Na₂CO₃ + 2CH₃ — COOH → 2CH₃ — COONa + H₂O + CO₂↑. Реакции кислот с солями Одним из условий протекания реакций является образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl↑ В ходе реакции образуется соль и происходит выделение воды. K₂O + 2HNO₃ → 2KNO₃ + H₂O Восстановительные свойства бескислородных кислот В восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены. 4HCl + MnO₂ → MnCl₂ + Cl₂↑ + 2H₂O Химические свойства средних солей: Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу: NaCl → Na+ + Cl- Термическое разложение: CaCO₃ = CaO + CO₂ Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства. В остальных случаях разложение солей аммония сопровождается выделением аммиака: NH₄Cl = NH₃ + HCl Взаимодействие солей с металлами: Fe + CuSO₄ = FeSO₄ + Cu Более активные металлы вытесняют менее активные металлы из растворов солей. Некоторые соли подвержены гидролизу: Na₂CO₃ + H₂O = NaOH + NaHCO₃ Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями: K₂CO₃ + 2HCl = 2KCl + CO₂+H₂O Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона: 10FeSO₄ + 2KMnO₄ + 8H₂SO₄ = 5Fe₂(SO4)₃ + 2MnSO₄ + K₂SO₄ + 8H₂O Химические свойства кислых солей: Диссоциация. Кислые соли диссоциируют ступенчато: NaHCO₃ → Na⁺ +HCO₃⁻ HCO₃⁻ → H⁺ + CO₃²⁻ Термическое разложение с образованием средней соли: Ca(HCO₃)₂ = CaCO₃ + CO₂ + H₂O Взаимодействие солей со щелочью. В результате образуется средняя соль: Ba(HCO₃)₂ + Ba(OH)₂ = 2BaCO₃ + 2H₂O Химические свойства основных солей: Термическое разложение: [Cu(OH)]₂CO₃ = 2CuO + CO₂ + H₂O Реакции солей с кислотами — образование средней соли: Sn(OH)Cl + HCl = SnCl₂ + H₂O Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато. Химические свойства комплексных солей: Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды: Na[Al(OH)₄] + 4HCl(изб.) = NaCl + AlCl₃ + 4H₂O, Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды: Na[Al(OH)₄] + HCl = NaCl + Al(OH)₃ + H₂O, Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду: Na[Al(OH)₄] + H₂S = NaHS + Al(OH)₃ + H₂O, При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид: K₃ [Cr(OH)₆] + 3SO₂ = 3KHSO₃ + Cr(OH)₃, Реакция солей, образованных сильными кислотами с катионами Fe³⁺, Al³⁺ и Cr³⁺, приводит к взаимному усилению гидролиза. Продукты реакции — два амфотерных гидроксида и соль активного металла: K₃ [Cr(OH)₆] +Al(NO₃)₃ = Al(OH) ₃ + Cr(OH) ₃ + 3KNO₃ Разлагаются при нагревании: K₃ [Cr(OH)₆] =KCrO₂ + 2H₂O + 2KOH Экспериментальные результаты Название веществ, встретившихся в лабораторной работе:
Обработка результатов эксперимента СuSO4 + NaOH Cu(OH)2 + Na2SO4 Cu2+ + SO42- + 2Na+ + 2OH- Cu(OH)2 + 2Na+SO42- Cu2+ + 2OH- Cu(OH)2 MgSO4 + 2NaOH Mg(OH)2 + Na2SO4 2Na+ + 2OH- + Mg+2 +SO42- Mg(OH)2+2Na+ + SO4 Mg2+ + 2OH- Mg(OH)2 FeCl3 + 3NaOHFe(OH)3 + 3NaCl Fe3+ + 3Cl- + 3Na+ + 3OH- Fe(OH)3 + 3Na+ + 3Cl- Fe3+ + 3OH- Fe(OH)3 Cu(OH)2 + 2HCl CuCl2 + 2H2O Cu(OH)2 + 2H+ + 2Cl- Cu2+ + 2Cl- + 2H2O Cu(OH)2 + 2H+ Cu2+ + 2H2O Mg(OH)2 + 2HCl MgCl2 + 2H2O Mg2+ + 2OH- + 2H+ + 2Cl- Mg2+ + 2Cl- + 2H2O 2OH- + 2H+ 2H2O Fe(OH)3 + 3HCl FeCl3 + 3H2O Fe(OH)3 + 3H+ + 3Cl- Fe3+ + 3Cl- + 3H2O Fe(OH)3 + 3H+ Fe3+ + 3H2O NaOH + HCl NaCl + H2O Na+ + OH- + H+ + Cl- Na+ + Cl- + H2O OH- + H+ H2O NiSO4 + 2NaOH Ni(OH)2 + Na2SO4 Ni+2 + SO4-2 + 2Na+ + 2OH- 2Na+ + SO4-2 + Ni(OH)2 Ni+2 + 2OH- Ni(OH)2 Ni(OH)2 + 2HCl NiCl2 + 2H2O Ni(OH)2 + 2H+ + 2Cl- Ni2+ + 2Cl- + 2H2O Ni(OH)2 + 2H+ Ni2+ + 2H2O ZnSO4 + 2NaOH Zn(OH)2 + Na2SO4 Zn2+ + SO42- + 2Na+ + 2OH- Zn(OH)2 + 2Na+ + SO42- Zn2+ + 2OH- Zn(OH)2 Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 + 2H+ + 2Cl- Zn2+ + 2Cl- + 2H2O Zn(OH)2 + 2H+ Zn2+ + 2H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] Na+ + 2OH- + Zn(OH)2 2Na+ + [Zn(OH)4]2- 2OH- + Zn(OH)2 [Zn(OH)4]2- Cr2(SO4)3 + 6NaOH 2Cr(OH)3 + 3Na2SO4 2Cr+3 + 3SO4-2 + 6Na+ + 6OH- 2Cr(OH)3 + 6Na+ + 3SO4-2 2Cr+3 + 6OH- 2Cr(OH)3 Cr(OH)3 + 3HCl CrCl3 + 3H2O Cr(OH)3 + 3H+ + 3Cl- Cr3+ + 3Cl- + 3H2O Cr(OH)3 Cr3+ + 3H2O Cr(OH)3 + 3NaOH Na3[Cr(OH)6] Cr(OH)3 + 3Na+ + 3ОН- 3Na+ + [Сr(ОН)6]3- Cr(OH)3+ 3ОН- [Сr(ОН)6]3- Al2(SO4)3 + 6NaOH 2Al(OH)3 + 3Na2SO4 2Al+3 + 3(SO4)-2 + 6Na+ + 6OH- 2Al(OH)3↓ + 6Na+ + 3(SO4)-2 Al+3 + 3OH- Al(OH)3↓ Al(OH)3 + 3HCl AlCl3 + 3H2O Al(OH)3 + 3H+ + 3Cl- Al3+ + 3Cl- + 3H2O Al(OH)3 + 3H+ Al3+ + 3H2O Al(OH)3 + NaOH Na[Al(OH)4] Al(OH)3 + Na+ + OH− Na+ + [Al(OH)4]− Al(OH)3 + OH− [Al(OH)4]− Na2SO4 + BaCl2 + 2NaCl + BaSO4 2Na+ + SO42- + Ba2++ 2Cl- 2Na+ + 2Cl- + BaSO4 SO42- + Ba2+ BaSO4 Na2CO3 + CaCl2 CaCO3 + 2NaCl 2Na+ + CO32- + Ca2+ + 2Cl- CaCO3 + 2Na+ + 2Cl- CO32- + Ca2+ CaCO3 CoCl2 + 2NaOH CoOHCl + 2NaCl Co2+ + 2Cl- + Na+ + OH- CoOHCl + Na+ + Cl- Co2+ + Cl- + OH- CoOHCl CoOHCl + NaOH Co(OH)2 + NaCl Co(OH)+ + Cl- + Na+ + OH- Co(OH)2 + Na+ + Cl- Co(OH)+ + OH- Co(OH)2 CoOHCl + HCl CoCl2 + H2O CoOHCl + H+ + Cl- = Co2+ + Cl- + H2O CoOHCl + H+ = Co2+ + H2O Выводы Ознакомился с техникой безопасности, провёл опыты, по результатам которых заполнил протокол наблюдений. На основе справочных данных и с помощью опытов изучил химические свойства оснований, кислот и солей Химические свойства оснований: Щёлочи взаимодействуют с кислотами, кислотными оксидами, солями; Нерастворимые основания взаимодействуют с кислотами и разлагаются при нагревании. Химические свойства кислот: Реагируют с основаниями с образованием солей и воды; Реагируют с солями с образованием осадка. Химические свойства солей: Взаимодействуют с кислотами, в результате реакции образуется осадок; Взаимодействуют с щелочами, в результате реакции образуется осадок. |
