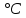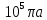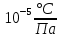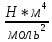Исследование эффекта Джоуля-Томсона. Отчет по лабораторной работе 12 По дисциплине
 Скачать 145.65 Kb. Скачать 145.65 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и технической физики Отчет по лабораторной работе №12
Оценка: ___________________ Дата: _____________________
Санкт-Петербург 2021 Цель работы – определить изменение температуры газа при протекании через малопроницаемую перегородку при разных значениях давления и температуры; экспериментально вычислить коэффициенты Ван-дер-Ваальса. Краткое теоретическое содержание Явление изучаемое в работе – Изменение температуры газа при адиабатическом истечении Определения Эффект Джоуля-Томсона – изменение температуры газа, медленно протекающего из области высокого в область низкого давления в условиях хорошей тепловой изоляции. В разреженных газах, которые приближаются по своим свойствам к идеальному газу, при таком течении температура газа не меняется. Эффект Джоуля-Томсона демонстрирует отличие исследуемого газа от идеального. Адиабатический, процесс – термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. Уравнение Ван-дер-Ваальса – модельное уравнение состояния реального газа, учитывающее, в отличие от уравнения состояния идеального газа, взаимодействие молекул между собой, а именно: мощное отталкивание на малых расстояниях между центрами масс молекул и притяжением на больших расстояниях. Критическая температура – это такая температура, при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми, т.е. находятся в динамическом равновесии. Температура инверсии – температура, при которой происходит изменение знака в эффекте Джоуля-Томпсона. Теплота – количество энергии, получаемое или отдаваемое системой при теплообмене. Основные законы и соотношения Уравнение Ван-дер-Ваальса 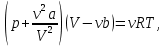 (1) (1) Где p – давление, ν – количество вещества, a и b – коэффициенты Ван-дер-Ваальса, R – универсальная газовая постоянная, T – температура. Первый закон термодинамики δQ = dU + δA, (2) где dU – бесконечно малое изменение внутренней энергии системы; δQ – бесконечно малое количество теплоты; δA – элементарная работа. Коэффициент Джоуля-Томсона 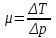 , (4) , (4)где μ – молярная масса вещества, 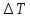 – изменение температуры, – изменение температуры, 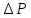 – изменение давления. – изменение давления. Схема установки 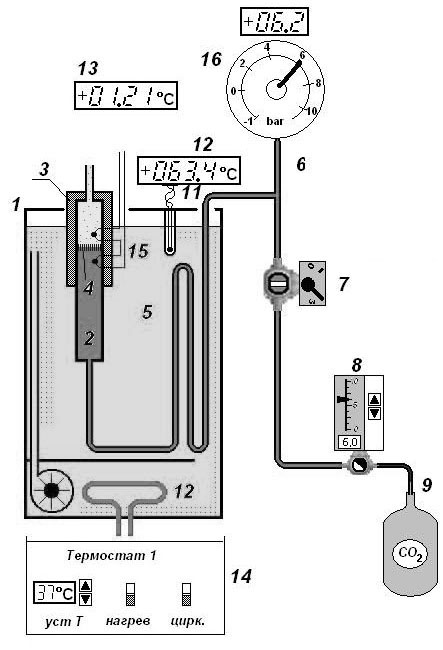 корпус трубка трубка 4. пористая перегородка 5. теплообменник 6. магистраль 7. кран 8. редуктор 9. баллон 10. кран 11. термопара 12. индикатор температуры 13. индикатор изменения температуры 14. пульт управления 15. термопара 16. манометр Рис. 1 Схема установки Экспериментальная установка Основные расчетные формулы 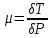 , , 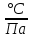 – коэффициент Джоуля-Томпсона – коэффициент Джоуля-ТомпсонаГде 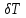 изменения температуры [ изменения температуры [ 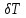 ]=℃; ]=℃;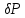 изменения давления [ изменения давления [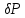 ]=Па; ]=Па;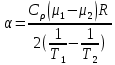 , H* , H*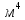 / /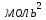 - коэффициент Ван-дер-Ваальса - коэффициент Ван-дер-ВаальсаГде Сp-молярная теплоемкость [Cp]=41Дж/(моль*К); R-универсальная газовая постоянная [R]= Дж/(моль*К); 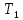 - заданная температура [T1]= ℃; - заданная температура [T1]= ℃;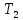 - заданная температура [T2]= ℃; - заданная температура [T2]= ℃;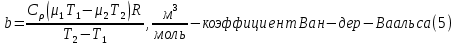 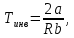 К - температура инверсии К - температура инверсии Формулы погрешности косвенных измерений: Абсолютная погрешность измерений коэффициента Джоуля-Томсона: 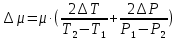 Абсолютная погрешность измерений температуры инверсии: 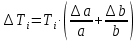 Абсолютная погрешность измерения температуры критической:  Относительная погрешность измерений коэффициента Джоуля-Томсона: 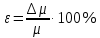 Среднеквадратичная погрешность измерений постоянных Ван-дер-Ваальса: 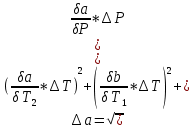 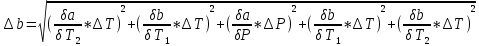 Таблицы с результатами Результаты измерений и вычислений Таблица 1
Погрешности прямых измерений Абсолютная погрешность прямых измерений изменения температуры 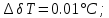 Абсолютная погрешность прямых измерений изменения давления 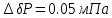 ; ;Примеры вычислений 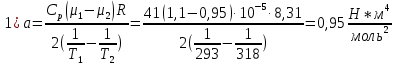 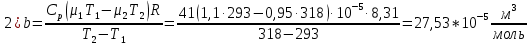 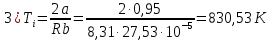 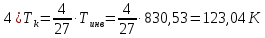 Расчет погрешностей 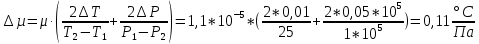 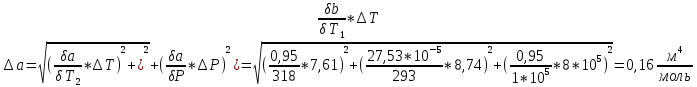 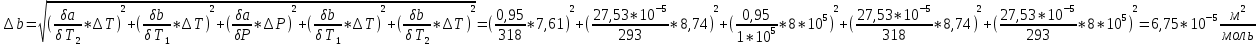 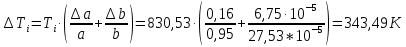 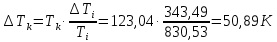 Графический материал График построен на основании таблицы №1, зависимость линейная. 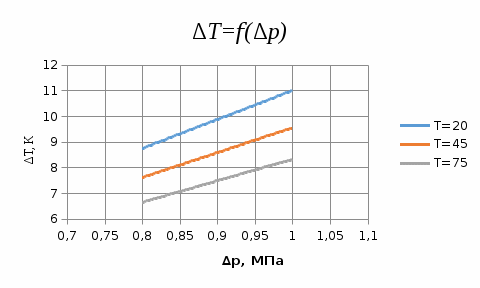 Рисунок 2 – График (Линейная аппроксимирующая функция) В данном эксперименте шаг изменения давления составляет 0,5 МПа Результаты a= (0,95 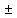 0,16) 0,16) 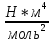 b= (27,53 b= (27,53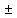 6,75) 6,75)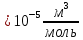 Вывод В этой лабораторной работе произведены измерения и вычисления, в результате которых были рассчитаны коэффициенты Ван-дер-Ваальса: a=0,95 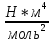 и b=27,53 и b=27,53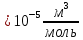 . Справочный материал: a=0,3608 . Справочный материал: a=0,3608 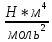 и b=4,28* и b=4,28*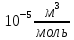 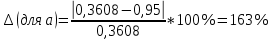 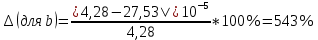 Теоретические и экспериментальные результаты значительно отличаются (на 163% и 543% соответственно), причиной этому могли быть неточность приборов и погрешность измерений. Можно сделать вывод, что для более точного экспериментального определения коэффициентов необходим большой выбор данных. |

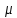
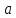
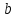
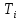
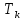
 Ед. изм
Ед. изм