Оценка основных параметров роста микроорганизмов в условиях периодического культивирования. Оценка основных параметров роста микроорганизмов в условиях пери. Отчет по лабораторной работе 2 Оценка основных параметров роста микроорганизмов в условиях периодического культивирования
 Скачать 71.21 Kb. Скачать 71.21 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Уфимский государственный нефтяной технический университет» Кафедра «Биохимия и технология микробиологических производств» Отчет по лабораторной работе №2: «Оценка основных параметров роста микроорганизмов в условиях периодического культивирования» Выполнил: ст. гр. БТБи-19-01 ____________ Д. Ф. Гайсина Проверил: ____________ А. В. Митягина Уфа 2022 Цель работы:оценить основные параметры ростамикроорганизмов в условиях периодического культивирования. Теоретическая задача: Культура растет на простой среде, содержащей 0,3% глюкозы. В момент времени τ = 0 культуру (как инокулят) разбавляют большим объемом идентичной стерильной среды. Процесс роста культуры контролируют по изменению оптической плотности во времени. Полученные данные приведены в столбце 1. В столбце 2 указано изменение ОД этой же культуры, но выросшей в сложной среде и разбавленной питательным раствором, содержащим 0,15% (м/об) глюкозы и 0,15% (м/об) лактозы.
* – определению оптической плотности предшествовало разбавление пробыравным объемом не содержащей клеток среды. Допустим, что ОД420 пропорционально клеточной массе, причем ОД420=0,175 соответствует концентрации абсолютно сухой биомассы (асб) 0,1 мг/мл. Рассчитать удельную скорость роста, продолжительность лаг-фазы, общие экономические коэффициенты, выраженные в г клеток / г субстрата при условии, что субстрат всегда утилизируется полностью. Объясните форму кривых роста. Решение Удельная скорость роста – прирост биомассы за малый промежуток времени, рассчитанный на единицу растущей биомассы: 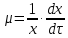 . .Поскольку в экспоненциальной фазе роста µ=const, то интегрирование уравнения приводит к выражению: 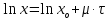 . .Это уравнение прямой линии в полулогарифмических координатах. Данная линия совпадает с прямолинейным участком кривой роста, характеризующим экспоненциальную фазу роста в полулогарифмических координатах. В связи с этим значение удельной скорости роста 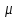 может быть определено как отношение может быть определено как отношение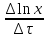 , т.е. , т.е. 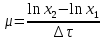 . .Т.к. ОД420=0,175 соответствует концентрации абсолютно сухой биомассы (асб) 0,1 мг/мл, тогда 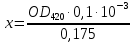 [г/мл]. [г/мл].Расчет удельной скорости роста для простого субстрата:
Расчет удельной скорости роста для составного субстрата:
График зависимости ОД420= f() для простого субстрата: 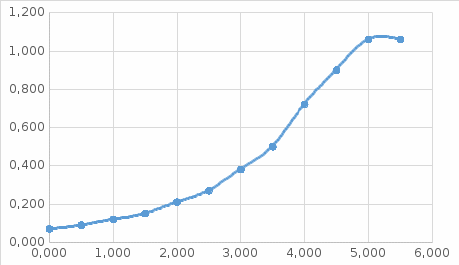 График зависимости ОД420= f() для составного субстрата: 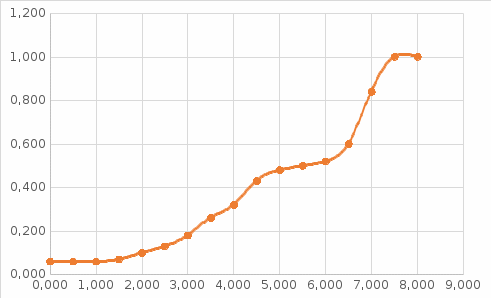 График зависимости 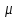 = f ()для простого субстрата: = f ()для простого субстрата: График зависимости 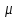 = f ()для составного субстрата: = f ()для составного субстрата: Анализ кинетических кривых. При росте на простой питательной среде лаг-фаза отсутствует, так как культуре нет необходимости перестраивать метаболизм и подготавливать субстрат к расщеплению. При росте на сложной питательной среде, содержащей глюкозу и лактозу, лаг-фаза присутствует и равняется одному часу. Это связано с тем, что лактоза является сложным соединением (дисахаридом), которое необходимо сначала подвергнуть ферментативному гидролизу. Общий экономический коэффициент рассчитывают по формуле: 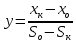 . .Т.к. потребляется весь субстрат, то 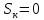 , а концентрация биомассы достигает максимального значения , а концентрация биомассы достигает максимального значения 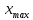 . Следовательно: . Следовательно: 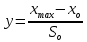 . .Расчет общего экономического коэффициентадля простого субстрата: 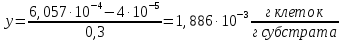 Расчет общего экономического коэффициентадля составного субстрата: 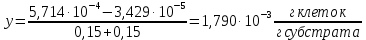 Экспериментальная задача Приготовление сред. Приготовили жидкую питательную среду следующего состава (%): глюкоза – 5 (вариант №3), (NH4)2SO4 – 0,5, ZnSO4 – 0,05, KH2PO4 – 0,64, K2HPO4 – 0,64, дрожжевой экстракт – 0,5, вода. Также приготовили жидкую питательную среду для инокулята следующего состава (%): глюкоза – 11 (вариант №6), (NH4)2SO4 – 0,5, ZnSO4 – 0,05, KH2PO4 – 0,64, K2HPO4 – 0,64, дрожжевой экстракт – 0,5, вода. Среды разлили по 50 мл в качалочные конические колбы (объем – 250 мл) и стерилизовалиавтоклавированием. Пересчет состава питательной среды на 50 мл: (NH4)2SO4: 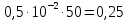 г гZnSO4: 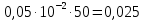 г гKH2PO4 и K2HPO4: 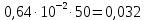 г гДрожжевой экстракт: 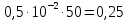 г гГлюкоза (вариант №3): 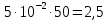 г гГлюкоза (вариант №6): 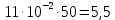 г гПосев микроорганизмов и определение начальной концентрации биомассы. Стерильные колбы со средой инокулировали посевным материалом. В качестве инокулята использовали суточную культуру дрожжей Rhodotorulaglutinis. После посева добились полного суспендирования биомассы культуры (аккуратно, круговыми движениями колбы) и, не нарушая стерильности, колбы отобрали 3 – 5 мл культуральной жидкости в пробирку. В отобранной пробе спектрофотометрически определили концентрацию биомассы, измеряя оптическую плотность культуральной жидкости при 520 нм(ОД520). Культивирование микроорганизмов, контроль роста культуры и определение выхода редуцирующих веществ. Колбу сразу же после посева и отбора нулевой пробы поместили в термостатированную качалку для культивирования микроорганизмов. Периодически (через каждый час) отбирали пробы культуральной жидкости и определяли в них концентрацию биомассы(ОД520) и концентрацию редуцирующих веществ (РВ).
Для определения редуцирующих веществ (РВ) в культуральной жидкости использовали фотометрический метод. Методика определения РВ фотометрическим способом. Приготовление реактивов: В работе используются 2 раствора: раствор 1 объемом 500 мл готовят растворением 8,65 г пентагидрата сульфата меди (II) в дистиллированной воде; раствор 2 объемом 500 мл готовят растворением 25 г сегнетовой соли, 2 г желтой кровяной соли и 37,5 г гидроксида натрия в дистиллированной воде. Проведение фотометрической реакции. В пробирке смешивают по 2 мл растворов 1 и 2 и 2 мл рабочего раствора, содержание РВ в котором находится в диапазоне 0,5-1,5 мг/мл (при необходимости рабочий раствор готовят разбавлением анализируемого раствора). Затем пробирку с реакционной смесью нагревают на кипящей водяной бане в течение 3 минут. Измерение оптических плотностей рабочего и холостого определений. Реакционную смесь, полученную после проведения реакции, сразу же переносят в кювету и измеряют оптическую плотность при 670 нм (рабочее определение). Также измеряли оптическую плотность при 670 нм аналогичной реакционной смеси, не подвергнутой нагреванию (холостое определение). Расчет концентрации РВ. Концентрацию РВ, мг/мл, в рабочем растворе вычисляют по формуле РВ'=(Ахол– Араб+0,012)/0,2946, где Ахол, Араб – оптические плотности при 670 нм, полученные в ходе соответственно холостого и рабочего определений; 0,012 – поправка, связанная с увеличением поглощения при 670 нм собственно меднощелочного раствора при нагревании в течение 3 мин; 0,2946 – абсолютное значение тангенса угла наклона градуировочной кривой. Расчет концентрации РВ (мг/мл) в анализируемом растворе производят с учетом степени разбавления: РВ=R∙РВ', где R – степень разбавления исходного объекта. Обработка полученных результатов. По результатам эксперимента построили графики роста культуры в периодических условиях. Определили продолжительность индукционного периода, удельную скорость роста культуры и экономический коэффициент.
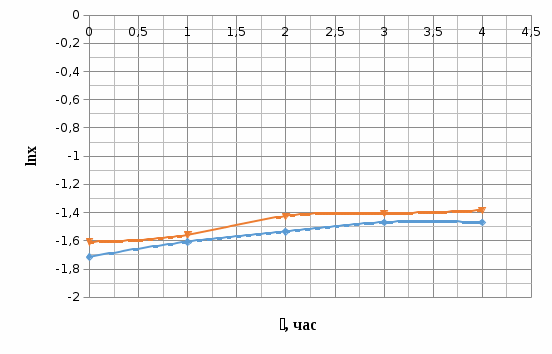 Индукционный период Фаза экспоненциального роста Фаза линейного роста роста Стационарная фаза Продолжительность индукционного периода – 0,5 часа. Удельная скорость в экспоненциальной фазе: 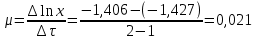 ч-1. ч-1.Общий экономический коэффициентпри потреблении всего субстрата: 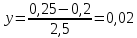 Расчет концентрации РВ:
R=50 во всех пробах (0,1 мл пробы + 4,9 мл воды) Вывод: в ходе данной лабораторной работы был изучен рост культуры дрожжей Rhodotorulaglutinis в условиях периодического культивирования, построен график роста культуры в периодических условиях для определения продолжительности индукционного периода, проведены расчеты основных параметров количественной оценки (удельной скорости роста в экспоненциальной фазе, общего экономического коэффициента, концентрации РВ). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

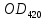
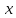 , г/мл
, г/мл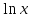
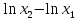
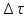 , ч
, ч