лабораторная работа по физической химии. Физическая химия. Лабораторная работа 2. Определение тепловых эф. Отчет по лабораторной работе 2 Определение тепловых эффектов по дисциплине Физическая химия
 Скачать 393.01 Kb. Скачать 393.01 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное образовательное учреждение высшего образования «Алтайский государственный технический университет им. И. И. Ползунова» Институт биотехнологии, пищевой и химической инженерии Кафедра «Химическая технология» Отчет защищен с оценкой________________ Преподаватель_________________________ (подпись) «__________» __________________ 2018 г. Отчет по лабораторной работе № 2 Определение тепловых эффектов. по дисциплине «Физическая химия» ЛР 18.03.01.18.000 ОТ Студентка группы ХТ-91 Никитина К.К. Преподаватель доцент, к.х.н. доцент. Коренева Н.В. Барнаул 2020 Экспериментальная часть 1.Общие принципы калориметрических измерений Все калориметрические измерения имеют много общего. Они заключаются: а) либо в определении тепловых эффектов процессов. В этом случае надо определить изменение температуры ΔТ в калориметре и, зная теплоёмкость калориметрической системы Ск, вычислить тепловой эффект процесса Q = Cк ⋅ ΔT б) либо в определении теплоёмкостей, для чего в систему вводят известное количество тепла и наблюдают изменение температуры, тогда: С 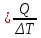 Простейший калориметр с изотермической оболочкой изображен на рисунке 1. 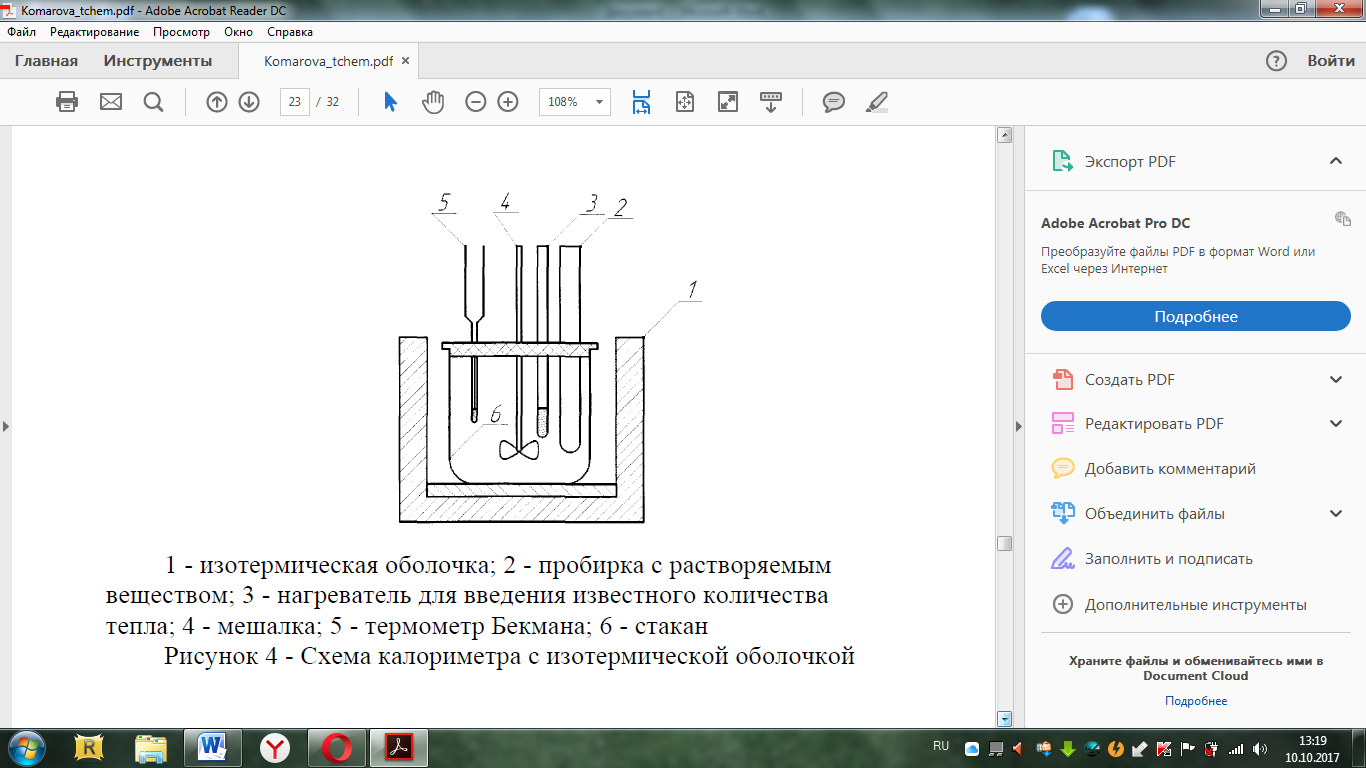 Рисунок 1 – схема калоториметра с изотермической оболочкой 2. Определение теплоемкости калориметрической системы Теплоемкость калориметрической системы – количество тепла, необходимое для ее нагревания на 1 градус, то есть Ck= 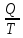 Для этого необходимо ввести в систему (или отнять от системы) известное количество тепла и замерить изменение температуры, вызванное этим процессом. В калориметрический сосуд наливают 150 - 200 мл дистиллированной воды, зная ее массу (произведение объема на плотность при данной температуре). В сухую пробирку насыпают 5 г соли КNO3, хорошо измельченной, взвешенной с точностью до 0,01 г. Теплота растворения КNO3 в воде равна 34,34 кДж/моль. Пробирку со взвешенной солью помещают в калориметр через отверстие в крышке калориметра. Туда же вставляют уже настроенный термометр Бекмана. Так как растворение соли КNO3 идет с поглощением тепла, то столбик ртути в термометре должен быть настроен так, чтобы он находился в верхней части шкалы термометра. Начинают перемешивать жидкость в калориметре, выбрав определенную постоянную частоту перемешивания, и наблюдают за изменением температуры через каждые 30 секунд, которая изменяется вследствие теплообмена всех частей калориметра со средой. Опыт делится на три периода: 1) Предварительный период - это время, в течение которого устанавливается равномерный ход температуры (примерно по 0,01 - 0,02 градуса за каждые 30 секунд). После установления такого хода температуры делают 8 - 10 замеров, затем быстро высыпают соль из пробирки в воду, вставляют пробирку в то же отверстие (или закрывают отверстие пробкой). Не переставая перемешивать, продолжают наблюдать и записывать температуру. Это начало главного периода. 2) Главный период - это время протекания изучаемого процесса (работа нагревателя или растворения соли). Главный период должен протекать по возможности быстро, чему способствует хорошее перемешивание при растворении соли. 3) Заключительный период. Конец главного периода обнаруживают по вновь установившемуся равномерному ходу 25 температуры. Это заключительный период, в котором делают 8 – 10 замеров. На основании данных по всем периодам строят график Т =f(t) и графически определяют значение ΔТ (рисунок 2). Рассмотрим пример (рисунок 2): пусть температура оболочки и стакана равна 25 0С, окружающего воздуха 15 0С, эффект процесса экзотермический. В предварительном периоде (АВ) будет происходить охлаждение калориметрической системы за счет теплообмена с окружающей средой. В главном (ВC) подъем температуры, в заключительном (CД) опять охлаждение за счет теплообмена с окружающей средой, причём с большей скоростью, так как разность температур стала большей. Считаем, что в первой половине главного периода теплообмен идет как в предварительном периоде, а во второй половине как в заключительном. Делим весь главный период на равные части (точка Е). Экстраполируем ход температуры в предварительном периоде до точки М, в заключительном до точки N. Полученные точки М и N экстраполируем на ось температуры и определяем ΔТ = Т2-T1. 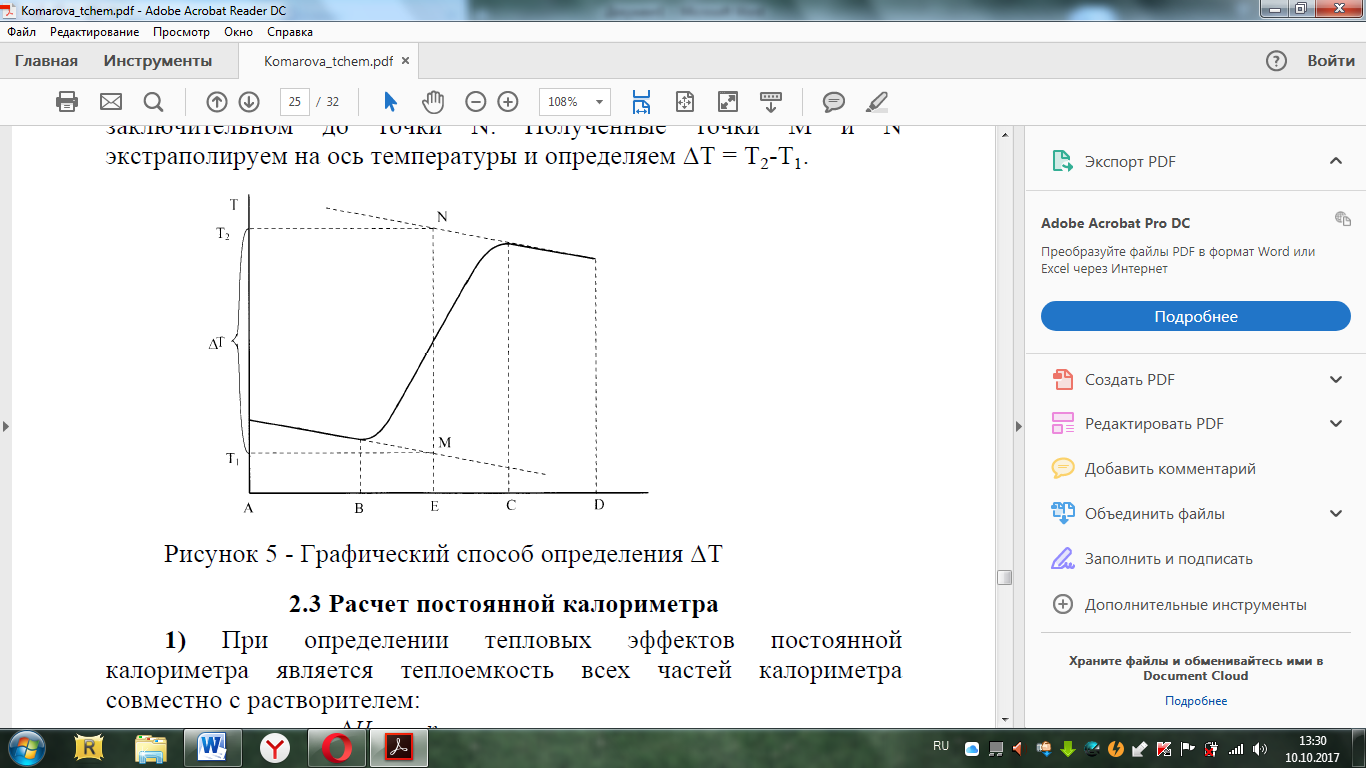 Рисунок 2 - Графический способ определения ΔТ 3.Расчет постоянной калориметра 1) При определении тепловых эффектов постоянной калориметра является теплоемкость всех частей калориметра совместно с растворителем: W= где ΔHKNO3 = 34,34·103 Дж/моль - теплота растворения КNO3, n - количество КNO3, моль; ΔТ — изменение температуры, в градусах, (ΔТ=Т2 – Т1). 2) Определение теплоемкости жидкостей . В этом случае постоянной сосуда является теплоемкость только частей калориметра без растворителя : W= где С(H2O) - удельная теплоемкость воды, равная при 298 К 4,183 Дж/г·К; m(Н2О) - масса воды, г. 4. Определение тепловых эффектов Работа 1: Определение теплоты растворения хорошо растворимой соли Цель работы: определить теплоту растворения соли (КСI, NaCl,NaNO3, K2SO4, NH4NO3, CuSO4, соль выдается преподавателем). Порядок выполнения работы: Собирают калориметр (рисунок 4) и определяют его постоянную (W, как описано в пунктах 2.2 и 2.3). Опыт повторяют с солью, тепловой эффект растворения которой следует определить. Для этого взвешивают 5 - 6 грамм мелко растертой исследуемой соли и проводят ее растворение аналогично соли КNO3. Полученные данные используют для нахождения ΔТ графическим методом для исследуемой соли. Теплота процесса растворения рассчитывается по формуле: Q = −W ⋅ ΔT , далее рассчитываем удельную (Дж/г) и молярную (Дж/моль) теплоты растворения: ΔH= 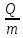 где m – масса соли, г. где m – масса соли, г.ΔH = 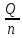 где n – количество вещества соли, моль. где n – количество вещества соли, моль.N= 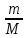 где М – молярная масса соли, г/моль. где М – молярная масса соли, г/моль.Ход работы:
|
