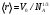Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Уфимский государственный нефтяной технический университет»
Кафедра «Машины и оборудование нефтегазовых промыслов»
Отчет
по лабораторной работе № 2
по дисциплине: «Оборудование для газовых промыслов»
по теме: «Эффект Джоуля – Томсона
 Выполнил: ст. гр. БМП-16-02 Э.Р. Янбердин Выполнил: ст. гр. БМП-16-02 Э.Р. Янбердин
Проверил: д.т.н., профессор А.А. Ишмурзин
Уфа 2020
 ЦЕЛЬ РАБОТЫ ЦЕЛЬ РАБОТЫ
Целью лабораторной работы является определение коэффициента Джоуля-Томсона для азота и (или) углекислого газа при условиях близких к нормальным, а также определение внутреннего давления этих газов, используя модель Ван-дер-Ваальса.
ЗАДАЧИ, РЕШАЕМЫЕ ПРИ ВЫПОЛНЕНИИ РАБОТЫ
Изучить зависимость разности температур с двух сторон от пористой пробки при стационарном течении через нее исследуемого газа от разности давлений.
Научиться определять коэффициент Джоуля-Томсона.
ВВЕДЕНИЕ
Эффектом Джоуля-Томсона называется изменение температуры газа при адиабатическом дросселировании, т.е. медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (местное препятствие газовому потоку).
Это явление было обнаружено в опытах, проведенных в 1852-1862 гг. Джеймсом Джоулем (Joule) и Уильямом Томсоном (Thomson, лорд Кельвин). Схема их опытов представлена на рисунке 1.
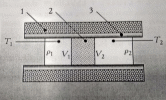
Рисунок 1 – Схема опыта Джоуля-Томсона
 В этих опытах исследуемый газ проходил по цилиндрической трубке (3), разделенной на две части с помощью пробки (дросселя) (2) из мелкопористого материала с маленькой теплоемкостью (например, ваты). Газ под действием разности давлений между двумя половинами трубки медленно протекал через дроссель. Пористая пробка обеспечивала малые скорости потока, что позволяет не учитывать его кинетическую энергию. Скорость потока должна быть много меньше не только скорости теплового движения молекул, но и разности этих скоростей слева и справа от пробки. Давления газа р1 и р2 по обе стороны пробки поддерживались постоянными. Газ обменивался теплом с пробкой и стенками трубки до тех пор, пока не устанавливалось стационарное состояние, в котором все соприкасающиеся части установки приобретали постоянную температуру, и, следовательно, теплообмен между ними прекращался. При таком стационарном течении газа по одну сторону пробки устанавливалась температура Т1, а по другую температура Т2. Теплоизолирующая оболочка (1), окружающая остальные части установки, обеспечивает адиабатические условия протекания газа, т.е. отсутствие теплообмена с окружающей средой. Стационарное течение газа через пробку называется процессом Джоуля-Томсона (дросселирование это его техническое название). Этот процесс отличается от адиабатического (изоэнтропического) процесса расширения газа, хотя и протекает в адиабатических условиях. Адиабатический процесс является В этих опытах исследуемый газ проходил по цилиндрической трубке (3), разделенной на две части с помощью пробки (дросселя) (2) из мелкопористого материала с маленькой теплоемкостью (например, ваты). Газ под действием разности давлений между двумя половинами трубки медленно протекал через дроссель. Пористая пробка обеспечивала малые скорости потока, что позволяет не учитывать его кинетическую энергию. Скорость потока должна быть много меньше не только скорости теплового движения молекул, но и разности этих скоростей слева и справа от пробки. Давления газа р1 и р2 по обе стороны пробки поддерживались постоянными. Газ обменивался теплом с пробкой и стенками трубки до тех пор, пока не устанавливалось стационарное состояние, в котором все соприкасающиеся части установки приобретали постоянную температуру, и, следовательно, теплообмен между ними прекращался. При таком стационарном течении газа по одну сторону пробки устанавливалась температура Т1, а по другую температура Т2. Теплоизолирующая оболочка (1), окружающая остальные части установки, обеспечивает адиабатические условия протекания газа, т.е. отсутствие теплообмена с окружающей средой. Стационарное течение газа через пробку называется процессом Джоуля-Томсона (дросселирование это его техническое название). Этот процесс отличается от адиабатического (изоэнтропического) процесса расширения газа, хотя и протекает в адиабатических условиях. Адиабатический процесс является  квазиравновесным. Все части порции газа в нем имеют одинаковые температуры и давления. Процесс Джоуля-Томсона является только стационарным, давления и температуры двух частей системы слева и справа от пробки различаются. квазиравновесным. Все части порции газа в нем имеют одинаковые температуры и давления. Процесс Джоуля-Томсона является только стационарным, давления и температуры двух частей системы слева и справа от пробки различаются.
Для описания этого процесса рассмотрим некоторую порцию газа (для простоты 1 моль), которая первоначально находилась слева от дросселя, занимая объем V1 при давлении р1 и температуре Т1. После протекания в правую часть камеры газ будет находиться при меньшем давлении р2, и займет объем V2. Применяя I-ое начало термодинамики с учетом того, что теплообмен отсутствует, получим:
U2 - U1 + A1 + A2 = 0, (1)
где U2 и U1 - значения внутренней энергии газа справа и слева от дросселя,
U2 - U1 - изменение внутренней энергии,
A1 + A2 - работа, совершенная газом при протекании через дроссель. Она складывается из двух частей: A1=-p1V1(работа, которая совершается над рассматриваемой порцией газа тем газом, который находится левее неё, поэтому она отрицательна) и А2 = p2V2 (работа, которую рассматриваемая порция совершает над тем газом, который находится правее нее, поэтому она положительна). Подстановка этих выражении в (1) приводит к соотношению:
U1 + p1V1 = U2 + p2V2 , (2)
Величина Н = U - pV называется энтальпией, или теплосодержанием, системы (в нашем случае порции газа). Соотношение (2) означает, что процесс Джоуля-Томсона проходит при постоянной энтальпии (является изоэнтальпическим, U+ pV= Const).
Для идеального газа U= СVТ,apV= RT (СVмолярная теплоемкость газа при постоянном объеме, R =8,31 Дж/моль К универсальная газовая постоянная) и, следовательно, СVT1+ RT1= CVT2 + RT2, что приводит к равенству температур с обеих сторон от дросселя Т1 = Т2.
 Для реальных газов работа при их расширении производится не только против сил внешнего давления, но и против сил межмолекулярного взаимодействия, которое не учитывается в идеальном газе. Поэтому p1V1, p2V2, U1, U2 и Т1, Т2 Для реальных газов работа при их расширении производится не только против сил внешнего давления, но и против сил межмолекулярного взаимодействия, которое не учитывается в идеальном газе. Поэтому p1V1, p2V2, U1, U2 и Т1, Т2
Величина:
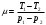 (3) (3)
называется коэффициентом Джоуля-Томсона. Различают дифференциальный (часто слово «дифференциальный» опускают) коэффициент Джоуля-Томсона, который определяют при малых перепадах давления 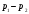 , и интегральный, который соответствует большим перепадам давления и большим степеням расширения газа и который нужен для описания работы технических устройств, использующих дросселирование. , и интегральный, который соответствует большим перепадам давления и большим степеням расширения газа и который нужен для описания работы технических устройств, использующих дросселирование.
Если газ при дросселировании охлаждается, то 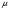 > 0 и эффект Джоуля-Томсона называется положительным. В противном случае > 0 и эффект Джоуля-Томсона называется положительным. В противном случае 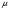 < 0 и эффект называется отрицательным. < 0 и эффект называется отрицательным.
Качественную картину процессов расширения реальных газов адиабатических условиях можно получить, анализируя кривую зависимости потенциальной энергии взаимодействия молекул от расстояния между ними (рисунок 2).
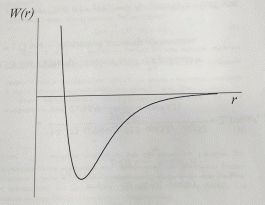
 Рисунок 2 – Зависимость энергии взаимодействия молекул W(r) от расстояния между ними r Рисунок 2 – Зависимость энергии взаимодействия молекул W(r) от расстояния между ними r
На больших расстояниях молекулы практически не взаимодействуют друг с другом и энергия близка к нулю. С уменьшением расстояния между молекулами начинают действовать силы притяжения, что соответствует понижению потенциальной энергии (правая часть кривой). На малых расстояниях порядка размера молекул (доли нанометра) появляются силы отталкивания, что соответствует повышению потенциальной энергии (левая часть кривой). Если средние межмолекулярные расстояния приходятся на правую часть кривой W(r), то при расширении (увеличении расстояний между молекулами) газ совершает работу против сил притяжения и охлаждается. Если, наоборот, межмолекулярные расстояния таковы, что преобладают силы отталкивания, то при расширении они совершают работу над молекулами, сообщают им дополнительную кинетическую энергию и газ нагревается.
 Количественные соотношения можно получить, воспользовавшись для описания реального газа уравнением Ван-дер-Ваальса: Количественные соотношения можно получить, воспользовавшись для описания реального газа уравнением Ван-дер-Ваальса:
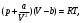 (4) (4)
где a, b - константы Ван-дер-Ваальса, которые являются характеристиками каждого газа, 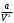 называется внутренним давлением газа и описывает силы притяжения между молекулами, константа b характеризует суммарный объем всех молекул 1 моля газа. называется внутренним давлением газа и описывает силы притяжения между молекулами, константа b характеризует суммарный объем всех молекул 1 моля газа.
Если воспользоваться этим уравнением состояния, то для коэффициента Джоуля-Томсона получится выражение:
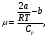 (5) (5)
где 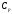 - молярная теплоемкость газа при постоянном давлении. Это выражение также показывает, что преобладание сил притяжения (первое слагаемое в числителе) ведет к положительному эффекту Джоуля-Томсона, а преобладание сил отталкивания, т.е. действие конечного размера или объема молекул (второе слагаемое), к отрицательному. - молярная теплоемкость газа при постоянном давлении. Это выражение также показывает, что преобладание сил притяжения (первое слагаемое в числителе) ведет к положительному эффекту Джоуля-Томсона, а преобладание сил отталкивания, т.е. действие конечного размера или объема молекул (второе слагаемое), к отрицательному.
В нормальных и близких к ним условиях средние расстояния между молекулами газа 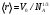 1 мм. (V0 = 22,4 л = 2,24х10-2 м3 молярный объем газа при нормальных условиях, NA – 6х1023 моль-1 - число Авогадро). Поэтому вторым слагаемым в (5) можно пренебречь и по измеренному значению 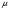 оценить постоянную Ван-дер-Ваальса а и внутреннее давление исследуемых газов. оценить постоянную Ван-дер-Ваальса а и внутреннее давление исследуемых газов.
СХЕМА УСТАНОВКИ
Общий вид установки показан на рисунке 3.
В неё входят: баллон с исследуемым газом (СО2 или N2); редуктор, подобный тем, которые используются для бытовых баллонов со сжиженным  пропаном, для понижения давления от 50 атм. до уровня, необходимого для работы установки; измерительная ячейка (рисунок 4); четырехканальное термометрическое устройство. пропаном, для понижения давления от 50 атм. до уровня, необходимого для работы установки; измерительная ячейка (рисунок 4); четырехканальное термометрическое устройство.

Рисунок 3 – Общий вид установки

Рисунок 4 – Измерительная ячейка
 Газ, выходя из баллона через редуктор, расширяется и охлаждается. Поэтому сначала он проходит через теплообменник 1, в котором снова доводится до комнатной температуры. Из теплообменника газ через пластиковый шланг 3 и манометр 4 поступает в левую половину 5 камеры дросселирования. Левая половина через пористую таблетку (фритту) 6 сообщается с правой половиной 7, в которой газ находится уже при атмосферном давлении. Дифференциальный манометр измеряет разность давлений между двумя частями камеры. Шкала манометра отградуирована в барах (1 бар = 105 Па). Два резистивных датчика температуры 2 и 9 используются для измерения температур в двух частях камеры и закрепляются с помощью заглушек с резьбовым уплотнением. Исследуемый газ поступает в ячейку из выпускного крана редуктора через шланг и оливку 10 и выходит через выпускное отверстие 8. Газ, выходя из баллона через редуктор, расширяется и охлаждается. Поэтому сначала он проходит через теплообменник 1, в котором снова доводится до комнатной температуры. Из теплообменника газ через пластиковый шланг 3 и манометр 4 поступает в левую половину 5 камеры дросселирования. Левая половина через пористую таблетку (фритту) 6 сообщается с правой половиной 7, в которой газ находится уже при атмосферном давлении. Дифференциальный манометр измеряет разность давлений между двумя частями камеры. Шкала манометра отградуирована в барах (1 бар = 105 Па). Два резистивных датчика температуры 2 и 9 используются для измерения температур в двух частях камеры и закрепляются с помощью заглушек с резьбовым уплотнением. Исследуемый газ поступает в ячейку из выпускного крана редуктора через шланг и оливку 10 и выходит через выпускное отверстие 8.
Датчики температуры подключаются к специальному четырехканальному термометрическому устройству. В данной работе используются только 2 канала из четырех. Термометрическое устройство может работать в двух режимах: обычном, в котором оно показывает температуры двух датчиков с точностью до 0,1 К, и в дифференциальном, в котором показывает температуру одного из датчиков, а также разность температур с точностью до 0,01 К.
ПОРЯДОК ПРОВЕДЕНИЯ ИЗМЕРЕНИЙ
1. Убедитесь в целостности всех соединительных шлангов и надежности их крепления. Перекройте выпускные краны баллона и редуктора вращением маховиков по часовой стрелке. Регулятор редуктора установите в положение «перекрыто» вращением его маховика против часовой стрелки. Все манометры (два на редукторе и один на измерительной ячейке) должны показывать нулевое давление.
2. Включите термометрическое устройство.
 3. Подключите датчики температуры к термометрическому устройству. 3. Подключите датчики температуры к термометрическому устройству.
4. Переключая режимы термометрического устройства, убедитесь в том, что температура каждого датчика близка к комнатной, а разность их температур не превышает 0,1 и 0,3 К. Установите такой режим термометрического устройства, в котором один из его каналов показывает температуру газа до пористой пробки, а второй разность температур с двух сторон от пробки.
5. Откройте выпускной кран баллона (вращать его маховик против часовой стрелки). Манометр высокого давления на редукторе должен показать около 50 атм.
6. Вращая маховик регулятора редуктора по часовой стрелке, установите на его манометре низкого давления 2-3 атм.
7. Откройте выпускной кран редуктора, вращая его маховик против часовой стрелки. При этом стрелка манометра на измерительной ячейке должна отклониться и должно быть слышно легкое шипение. Следите за тем, чтобы показания манометра не превышали 1 бара.
8. Вращая маховики регулятора и выпускного крана на редукторе, меняйте показания манометра 4 от 0 до 1 бара примерно через 0,1 бар и записывайте показания термометрического устройства. После изменения давления отсчеты температур делайте через 1,5 минуты, чтобы обеспечить установление стационарного состояния в ячейке.
9. Результаты измерений занесите в таблицу.
Таблица 1 – Данные измерений
 10. Перед выключением установки перекройте все газовые краны в следующем порядке: сначала на баллоне, затем на регуляторе редуктора и, наконец, выпускной кран редуктора. 10. Перед выключением установки перекройте все газовые краны в следующем порядке: сначала на баллоне, затем на регуляторе редуктора и, наконец, выпускной кран редуктора.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
1. По данным измерений постройте график зависимости 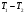 = f = f 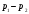
2. На этом графике найдите прямолинейный участок, угловой коэффициент которого равен коэффициенту Джоуля-Томсона. Вычислите его методом парных точек.
Таблица 2 – Данные обработки результатов
i
|
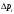
|
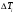
|
j
|
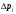
|
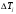
|
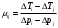
|
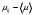
|
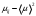
|
бар
|
К
|
бар
|
К
|
К/Па
|
К/Па
|
К/Па
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Определите погрешность полученного значения коэффициента Джоуля-Томсона.
4. По формуле 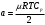 , которая следует из формулы (5), если в ней пренебречь константой Ван-дер-Ваальса b, оцените значение константы Ван-дер-Ваальса а. Значение молярной теплоемкости газа при постоянном давлении Ср вычислите из соотношения , которая следует из формулы (5), если в ней пренебречь константой Ван-дер-Ваальса b, оцените значение константы Ван-дер-Ваальса а. Значение молярной теплоемкости газа при постоянном давлении Ср вычислите из соотношения 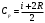 , где i число степеней свободы молекулы газа. , где i число степеней свободы молекулы газа.
5. По формуле 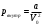 оцените значение внутреннего давления газа при нормальных условиях. оцените значение внутреннего давления газа при нормальных условиях.
 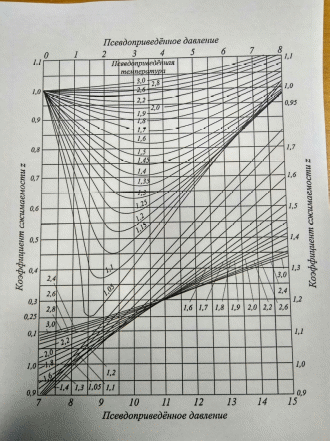
Рисунок 5 – Зависимость функций коэффициента Джоуля-Томсона от приведенных значений давления 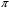 и температуры и температуры 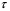
 Выводы: 1) мы изучили зависимость разности температур с двух сторон от пористой пробки при стационарном течении через нее исследуемого газа от разности давлений. Выводы: 1) мы изучили зависимость разности температур с двух сторон от пористой пробки при стационарном течении через нее исследуемого газа от разности давлений.
2) с изменением начального давления (при постоянной температуре) коэффициент Джоуля-Томсона для одного и того же газа также меняется. Поэтому для термодинамического расчета процесса низкотемпературной сепарации следует пользоваться интегральным или средним дифференциальным эффектом Джоуля-Томсона. |
 Скачать 0.92 Mb.
Скачать 0.92 Mb.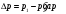
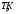
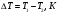
 10. Перед выключением установки перекройте все газовые краны в следующем порядке: сначала на баллоне, затем на регуляторе редуктора и, наконец, выпускной кран редуктора.
10. Перед выключением установки перекройте все газовые краны в следующем порядке: сначала на баллоне, затем на регуляторе редуктора и, наконец, выпускной кран редуктора.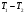 = f
= f 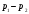
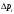
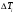
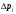
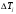
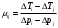
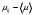
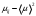
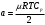 , которая следует из формулы (5), если в ней пренебречь константой Ван-дер-Ваальса b, оцените значение константы Ван-дер-Ваальса а. Значение молярной теплоемкости газа при постоянном давлении Ср вычислите из соотношения
, которая следует из формулы (5), если в ней пренебречь константой Ван-дер-Ваальса b, оцените значение константы Ван-дер-Ваальса а. Значение молярной теплоемкости газа при постоянном давлении Ср вычислите из соотношения 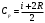 , где i число степеней свободы молекулы газа.
, где i число степеней свободы молекулы газа.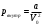 оцените значение внутреннего давления газа при нормальных условиях.
оцените значение внутреннего давления газа при нормальных условиях.

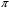 и температуры
и температуры 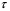
 Выводы: 1) мы изучили зависимость разности температур с двух сторон от пористой пробки при стационарном течении через нее исследуемого газа от разности давлений.
Выводы: 1) мы изучили зависимость разности температур с двух сторон от пористой пробки при стационарном течении через нее исследуемого газа от разности давлений.






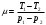 (3)
(3)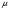 > 0 и эффект Джоуля-Томсона называется положительным. В противном случае
> 0 и эффект Джоуля-Томсона называется положительным. В противном случае 


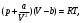 (4)
(4) 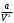 называется внутренним давлением газа и описывает силы притяжения между молекулами, константа b характеризует суммарный объем всех молекул 1 моля газа.
называется внутренним давлением газа и описывает силы притяжения между молекулами, константа b характеризует суммарный объем всех молекул 1 моля газа.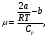 (5)
(5) 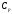 - молярная теплоемкость газа при постоянном давлении. Это выражение также показывает, что преобладание сил притяжения (первое слагаемое в числителе) ведет к положительному эффекту Джоуля-Томсона, а преобладание сил отталкивания, т.е. действие конечного размера или объема молекул (второе слагаемое), к отрицательному.
- молярная теплоемкость газа при постоянном давлении. Это выражение также показывает, что преобладание сил притяжения (первое слагаемое в числителе) ведет к положительному эффекту Джоуля-Томсона, а преобладание сил отталкивания, т.е. действие конечного размера или объема молекул (второе слагаемое), к отрицательному.