Химия laba3. Отчет по лабораторной работе 3 хтп15. 03. 04 02. 00 Лр исполнитель студент гр. Батз2121 Д. С. Садовенко А. Ш. Смаков
 Скачать 41.4 Kb. Скачать 41.4 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Филиал государственного образовательного учреждения высшего профессионального образования «Уфимский государственный нефтяной технический университет» в г. Салавате (Филиал ГОУ ВПО УГНТУ в г. Салавате) Кафедра химико-технологических процессов Общая и неорганическая химия Растворы. Приготовление растворов различных концентраций. Отчет по лабораторной работе №3 ХТП-15.03.04-1.02.00 ЛР Исполнитель: студент гр. БАТз-21-21 Д.С. Садовенко А.Ш. Смаков М.А. Яшунин Руководитель: Доцент И. Н. Михольская Салават 2022 Цель работы: Приготовление раствора заданной концентрации и определение процентной концентрации данного раствора. Экспериментальная часть: Опыт 1. Приготовление раствора заданной концентрации из навески. Этот способ применяется главным образом для приготовления растворов солей. Таблица 1 -Концентрация раствора K2Cr2O7.
Рассчитали массу вещества, необходимое для приготовления раствора заданной концентрации, и взвесили его на технических весах с точностью до 0,01 г. 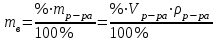 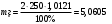 Взяли плоскодонную колбу и через воронку осторожно перенесли в нее навеску соли. Воду, отмеренную для растворения, вылили через воронку в колбу небольшими порциями так, чтобы всю соль с воронки смыть в колбу. Закрыли пробкой колбу, встряхнули её несколько раз, чтобы вся соль полностью растворилась. Измерили плотность полученного раствора ареометром и проверили по таблице правильность приготовления раствора. Для этого перелили приготовленный раствор в цилиндр и осторожно опустили ареометр. Затем вынули ареометр и промыли его под водопроводной водой. Плотность полученного раствора – 1,0121 г/см3. Опыт 2. Определение процентной (масс) концентрации раствора и пересчет её на молярную и процентную концентрацию. 1. В стеклянный цилиндр с раствором соли плавно опускаем ареометр, так чтобы он не касался стенок сосуда. Плотность равна р(KCl) = 1,015 г/см3. 2. По таблице 2 находим процентную концентрацию раствора. Если найденная плотность находится между двумя значениями в таблице, то процентную концентрацию находя интерполяцией по уравнению: 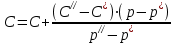 где 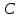 – процентная концентрация, – процентная концентрация,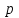 – плотность раствора, – плотность раствора, 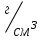 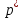 – ближайшее меньшее значение плотности в таблице, – ближайшее меньшее значение плотности в таблице,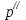 – ближайшее большее значение плотности в таблице, – ближайшее большее значение плотности в таблице,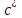 – % – концентрация раствора с плотностью, – % – концентрация раствора с плотностью,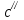 – % – концентрация раствора с плотностью. – % – концентрация раствора с плотностью.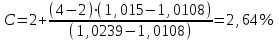 По рассчитанной процентной концентрации определяем молярность и нормальность раствора. 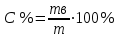 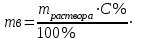 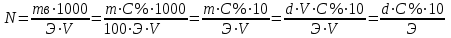 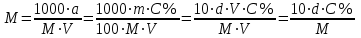 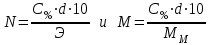 где 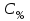 – рассчитанная процентная концентрация соли, – рассчитанная процентная концентрация соли,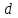 – соответствующая плотность, – соответствующая плотность,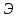 – значение эквивалента соли, – значение эквивалента соли,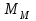 – молярная масса соли. – молярная масса соли.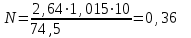 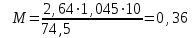 Вывод: мы научились приготовлять растворы заданной концентрации и определять процент концентрации данного раствора. |
