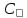ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ И ГИДРОЛИЗ СОЛЕЙ. Отчет по лабораторной работе 3 вариант 1 Электролитическая диссоциация. Гидролиз. Преподаватель
 Скачать 123.06 Kb. Скачать 123.06 Kb.
|
|
Федеральное государственное автономное образовательное учреждение высшего профессионального образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» Горного дела, геологии и геотехнологий институт Фундаментального научного образования кафедра ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №3 ВАРИАНТ 1 Электролитическая диссоциация. Гидролиз. Преподаватель ___________ Дубова И.В. Подпись дата инициалы, фамилия Студент ГГ20-09 _________ 10.11.20 Фефилов Е.А. Парфёнов Д.С. номер группы подпись дата инициалы, фамилия Красноярск 2020 Цель работы: Исследовать зависимость характера диссоциации в растворах электролитов от различных факторов. Исследовать факторы, влияющие на гидролиз солей. Теоретическое введение. Электролиты - вещества, способные диссоциировать на ионы в водных растворах и рас-плавах. Сильные электролиты: кислоты: H2SO4, HCl, HNO3, HClO4, HBr, HI, HCSN, HMnO4 основания: LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Сильные кислоты и сильные основания диссоциируют в растворах на ионы полностью. HCl = Н+ + Сl- KOH = K+ + OH– HNO3 = Н+ + NO3- NaOH = Na+ + OH- Слабые электролиты: кислоты: H2SO3, H2СO3, HF, HNO2, HClO, H2S, CH3COOH, HCN основания: NH4OH и все, кроме гидроксидов щелочных и щелочноземельных металлов. Слабые основания обычно не растворимы. NH4OH исключение - слабое, неустойчивое: NH4OH → NH3 + H2O Степень диссоциации зависит от природы растворителя; полярности связи, по которым про-исходит диссоциация; температуры; концентрации. По принципу Ле Шателье равновесие электролитической диссоциации слабого электролита может быть смещено. Как правило, при разбавлении раствора, при увеличении температуры степень диссоциации слабого электролита увеличивается. Силу слабого электролита характеризует константа диссоциации, которая для диссоциации уксусной кислоты: CH3COOH ⇄ H + + CH3COO Имеет вид: Она характеризует способность электролита распадаться на ионы. Чем больше значение константы диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и температуры и не зависит от концентрации. Связь между степенью диссоциации и константой выражается законом разбавления Оствальда: 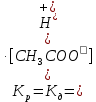 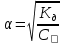
Гидролиз – это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. В общем случае обменное взаимодействие растворённого вещества с растворителем носит название – сольволиз. В большинстве случаев гидролиз сопровождается изменением pH раствора. Большая часть реакций гидролиза обратимы. Pb(NO3)2 + H2O ⇄ Pb(OH)(NO3) + HNO3 Pb2+ + NO3 + H2O ⇄ Pb(OH)(NO3) + H+ Na3PO4 + H2O ⇄ Na2HPO4 + NaOH PO43 + H2O ⇄ HPO4 + OH Некоторые реакции гидролиза протекают необратимо Al2S3 + 6H2O ⇄ 2Al(OH)3↓ + 3H2S Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов. Способность солей подвергаться гидролизу зависит от: • свойств ионов, образующих соль; • внешних факторов Отсутствие гидролиза в растворах Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiBr, K2SO4, NaClO4, BaCl, Ca(NO3)2 и др.), гидролизу не подвергаются, так как ни катион, ни анион соли не могут при взаимодействии с водой образовать молекулы слабых электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (pH = 7). Практически не гидролизуются также и труднорастворимые соли (CaCO3, Mg3(PO4)2 и др.) из-за очень низкой концентрации ионов в водных растворах этих солей. Гидролиз по катиону. Соли слабого основания и сильной кислоты гидролизуются по катиону NH4+Cl + H2O ⇄ NH4OH + HCl В ионно-молекулярной форме NH4+ + H2O ⇄ NH4OH + H+ Гидролиз солей, образованных многовалентным катионом, протекает ступенчато, через стадии образования основных солей. Первая ступень: Al(NO3)3 + H2O ⇄ Al(OH)(NO3)2 + HNO3 Al3+ + H2O ⇄ [Al(OH)]2+ + H+ Гидролиз протекает достаточно сильно по первой ступени, слабо – по второй ступени и совсем слабо – по третьей ступени (ввиду накопления ионов водорода процесс смещается в сторону исходных веществ). Более полному гидролизу способствует разбавление раствора и повышение температуры. (В этом случае можно учитывать гидролиз и по третьей ступени.) При гидролизе по катиону реакция раствора кислая pH < 7. Гидролиз по аниону. Соли, образованные сильным основанием и слабой (ассоциированной) кислотой, гидролизуются по аниону CH3COOK + H2O ⇄ CH3COOH + KOH. В ионно-молекулярной CH3COO + H2O ⇄ CH3COOH +OH Соли многоосновных кислот гидролизуются ступенчато (с образованием кислых солей). Первая ступень: K2CO3 + H2O ⇄ KHCO3 + KOH CO2 + H2O ⇄ HCO3 + OH Вторая ступень: KHCO3 + H2O ⇄ H2CO3 + KOH HCO3 + H2O ⇄ H2CO3 + OH Первая ступень гидролиза протекает достаточно сильно, а вторая – слабо, о чём свидетельствует pH раствора карбоната и гидрокарбоната калия. (Лишь при сильном разбавлении и нагревании следует учитывать гидролиз образующейся кислой соли.) Поскольку при взаимодействии с водой анионов слабых кислот образуются ионы OH, то водные растворы таких солей имеют щелочную реакцию (pH > 7). Гидролиз по катиону и аниону. Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону, и по аниону CH3COONH4 + H2O ⇄ CH3COOH + NH4OH Или в ионно-молекулярной форме CH3COO + NH4+ + H2O ⇄ CH3COOH + NH4OH Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота. Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т. е. от их констант диссоциации (Kд). Если Kд(основания) > Kд (кислоты), то pH > 7; если Kд (основания) < Kд (кислоты), то pH < 7. 1) Na2SO3 + H2O ⇄ NaHSO3 + NaOH SO32 + HOH ⇄ HSO3 + OH 2) Zn(NO3)2 + H2O ⇄ ZnOHNO3 + HNO3 Zn2+ + HOH ⇄ ZnOH+ + H+ 3) (NH4)2CO3 + H2O ⇄ NH4HCO3 + NH4OH NH4+ +CO32 + HOH ⇄ NH4OH + HCO3 Факторы, влияющие на смещение равновесия гидролиза. Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает. Концентрация продуктов гидролиза. Гидролиз обратимый процесс. В соответствие с принципом Ле Шателье, повышение концентрации ионов водорода приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции, рассмотренной в примере 2. Разбавление. В соответствии с принципом Ле Шателье, при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает. Добавки посторонних веществ. На положение равновесия влияет добавление веществ, которые могут реагировать с одним из участников реакции. Если в результате гидролиза образуются ионы водорода (гидролиз по катиону): Men+ +HOH сдвинуть равновесие вправо можно: 1) добавлением раствора гидроксида натрия (NaOH), содержащего гидроксид-ионы, которые будут взаимодействовать с ионами водорода; 2) добавлением раствора соли, образованной сильным основанием и слабой кислотой (например, раствор сульфита натрия Na2SО3). В результате концентрация ионов водорода уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. Опыт 1. Получение гидроксидов и изучение их свойств 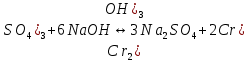 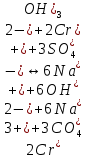 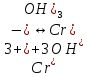 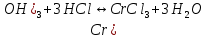 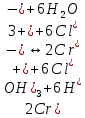 Cr(OH)3 + 3H+ +3Cl= Cr +3Cl- + 3H2O Вывод: Проводя данные опыты, я обнаружил, что полученные гидроксиды реагируют с кислотами. Такие гидроксиды называются амфотерными. Из полученных гидроксидов металлов более основными свойствами обладает гидроксид цинка, а более кислыми гидроксид хрома(3). На основе полученных данных я расположил гидроксиды в порядке увеличения их кислотности: Cr(OH)3 Опыт 3. Равновесие в растворах малорастворимых электролитов. 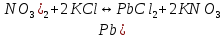 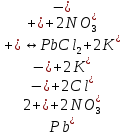 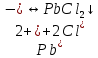 -белый цвет -белый цвет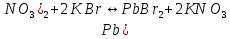 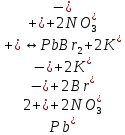 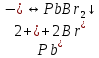 -жёлтый цвет -жёлтый цветПРAaBb=[Aa+]a[Bb-]b=[Pb2+][Br-]2 Вывод: по результатам опыта видно, что осадок образуется в том случае, когда произведение концентрации ионов малорастворимого электролита больше его произведения растворимости. В растворах малорастворимых сильных электролитов, к которым относятся данные малорастворимые соли, устанавливается равновесие между твердой фазой и раствором. Опыт 4. Гидролиз солей. Определение рН раствора. Na2SO3 + H2O NaHSO3 + NaOH 2Na+ + SO32- + H2O Na+ + OH- + Na+ + HSO3- SO32- + H2O OH- + HSO3- Среда щелочная pH > 7 Zn(NO3)2 + 2H2O Zn(OH)2 + 2HNO3 Zn2+ + 2NO3- + HOH ZnOH+ + NO3- + H+ + NO3- Zn2+ HOH ZnOHNO3++ HNO3 Среда кислая pH < 7 (NH4)2CO3 + 2H2O H2CO3 + 2NH4OH 2NH4+ + CO32-+H2O NH4OH + H2CO3 pH ≈ 7 NaCl-не гидролизуется, реакция не протекает pH = 7 Вывод: Произвели гидролиз различных солей, определили рН показатель в каждой реакции Контрольные вопросы и упражнения. 1). Методы определения состава вещества: Анализ – метод определения состава вещества путём разложения на более простые.  Пример : Пример : 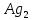 O 2Ag + O O 2Ag + O оксид серебра серебро кислород Синтез — получение сложного вещества из более простых. Синтез, так же как и анализ, играет большую роль при определении состава неизвестного соединения, например при исследовании веществ нередко сравнивают их свойства со свойствами идентичных веществ, полученных синтетическим путём  Пример : 2H + O Пример : 2H + O  водород кислород вода 2). Ионизация - это образование ионов - положительно или отрицательно заряженных частиц.   а). а). 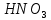 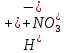   б). б). 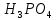 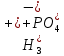   в). в). 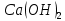 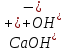 - первая ступень - первая ступень  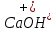 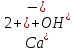 - вторая ступень - вторая ступень  г). г). 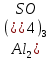 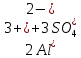   д). д). 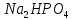 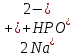   е). е). 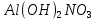 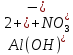 - первая ступень - первая ступень  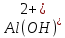 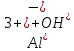 - вторая ступень - вторая ступень  ж). ж). 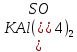 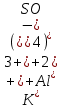   з). з). 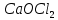 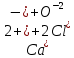 3). Теория Бренстеда – Лоури - это теория кислотно-основной реакции, которая была независимо предложена Йоханнесом Николаусом Бренстедом и Томасом Мартином Лоури в 1923 году. Фундаментальная концепция этой теории состоит в том, что когда кислота и основание реагируют друг с другом, кислота образует сопряженное основание , и основание образует сопряженную кислоту путем обмена протона (катион водорода или H + ). Эта теория является обобщением теории Аррениуса. 4). Дано: α = 0.01 С (  ) = 0.001 М (С – концентрация вещества) ) = 0.001 М (С – концентрация вещества)Найти: рН и pOH Решение:    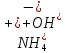 слабое основание слабое основаниеГидроксид аммония - слабое основание, диссоциирует не полностью. [ОН⁻] = √(Kд*См), где Кд - константа диссоциации, См - молярная концентрация. Табличное значение константы диссоциации Кд = 1,79*10⁻⁵ [OH⁻] = √(1,79*10⁻⁵*0,001) = √(1,79* 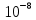 ) ≈ 1,338 · ) ≈ 1,338 · 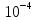 = 0,0001338 = 0,0001338рОН = - lg[OH⁻] = - lg0,0001338 ≈ -(-3,9) = 3,9 pH = 14 - pOH = 14 - 3,9 = 10,1 Ответ: рН = 10,1; рОН = 4,9 5). Дано: С (HCl) = 0.005 моль/л С (КОН) = 0.0042 моль/л Вычислить водородный показатель Решение: HCl=H++Cl- KOH=K++OH- pH=-lg[H+]=-lg 0,005=2,3 pOH=-lg[OH-]=-lg(4,2*10-3 )=2,38 pH=14-pOH=14,00-2,38=11,62 6). Гидролиз солей — это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита - кислоты (кислой соли), или основания (основной соли). Пример: Гидролиз по катиону:   FeCl₂ + HOH Fe(OH)Cl + HCl Fe₂ + 2 Cl- + H+ + OH- FeCl₂ + HOH Fe(OH)Cl + HCl Fe₂ + 2 Cl- + H+ + OH-   Fe(OH)Cl Fe OH+ + 2Cl- + Н+ Fe(OH)Cl Fe OH+ + 2Cl- + Н+ Гидролиз по аниону:   Na2CO3 + H2O NaHCO3 + NaOH Na2CO3 + H2O NaHCO3 + NaOH  NaHCO3 + NaOH CO32- + H+OH- NaHCO3 + NaOH CO32- + H+OH-  CO32- + H+OH- HCO3- + OH- pH>7 – щелочная среда CO32- + H+OH- HCO3- + OH- pH>7 – щелочная среда7). Дано: α = 0.01 С ({NH}-4OH) = 0.001 М (С – концентрация вещества) Найти: рН и pOH Решение: {NH}-4OH {NH}_4^++\ {OH}^- слабое основание Гидроксид аммония - слабое основание, диссоциирует не полностью. [ОН⁻] = √(Kд*См), где Кд - константа диссоциации, См - молярная концентрация. Табличное значение константы диссоциации Кд = 1,79*10⁻⁵ [OH⁻] = √(1,79*10⁻⁵*0,001) = √(1,79*{10}^{-8}) ≈ 1,338 · {10}^{-4} = 0,0001338 рОН = - lg[OH⁻] = - lg0,0001338 ≈ -(-3,9) = 3,9 pH = 14 - pOH = 14 - 3,9 = 10,1 Ответ: рН = 10,1; рОН = 4,9 8). А). нитрат натрия NaNO3 - соль образована сильным основанием и сильной кислотой, поэтому гидролиз не протекает. Б). хлорид бериллия BeCl2 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. Первая стадия гидролиза: Молекулярное уравнение:   BeCl2 + HOH BeOHCl + HCl BeCl2 + HOH BeOHCl + HClПолное ионное уравнение:     Be2+ + 2Cl + HOH BeOH+ + Cl- + H+ + Cl- Be2+ + 2Cl + HOH BeOH+ + Cl- + H+ + Cl-Краткое ионное уравнение:   Be2+ + HOH BeOH+ + H+ Be2+ + HOH BeOH+ + H+Вторая стадия гидролиза: Молекулярное уравнение:   BeOHCl + H2O Be(OH)2 + HCl BeOHCl + H2O Be(OH)2 + HClПолное ионное уравнение:   BeOHCl+ + Cl- + H2O Be(OH)2 + H+ + Cl- BeOHCl+ + Cl- + H2O Be(OH)2 + H+ + Cl-Краткое ионное уравнение:   BeOH+ + H2O Be(OH)2 + H+ BeOH+ + H2O Be(OH)2 + H+Так как в результате гидролиза образовались ионы водорода (H+), то раствор будет иметь кислую среду (рН < 7). В). Сульфат цинка ZnSO4 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. Молекулярное уравнение:   2ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4 2ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4Полное ионное уравнение:   2Zn2+ + 2SO42- + 2H2O 2ZnOH+ + SO42- + 2H+ + SO42- 2Zn2+ + 2SO42- + 2H2O 2ZnOH+ + SO42- + 2H+ + SO42-Краткое ионное уравнение:   Zn2+ + H2O ZnOH+ + H+ Zn2+ + H2O ZnOH+ + H+Молекулярное уравнение:   (ZnOH)2SO4 + 2H2O 2Zn(OH)2 + H2SO4 (ZnOH)2SO4 + 2H2O 2Zn(OH)2 + H2SO4Полное ионное уравнение:   2ZnOH+ + SO42- + 2H2O 2Zn(OH)2 + 2H+ + SO42- 2ZnOH+ + SO42- + 2H2O 2Zn(OH)2 + 2H+ + SO42-Краткое ионное уравнение:   ZnOH+ + H2O Zn(OH)2 + H+ ZnOH+ + H2O Zn(OH)2 + H+Так как в результате гидролиза образовались ионы водорода (Н+), то раствор будет иметь кислую среду (рН < 7). Г). Сульфид алюминия Al2S3 – соль слабого основания и слабой кислоты, гидролиз протекает практически полностью, так как оба продукта реакции уходя из зоны реакции в виде осадка или газа. Молекулярное уравнение:   Al2S3 + 6H2O 2AL(OH)3(стрелкавниз) +3H2S(стрелка вверх) Al2S3 + 6H2O 2AL(OH)3(стрелкавниз) +3H2S(стрелка вверх)рН = 7, раствор имеет нейтральную среду. Д). Сульфат аммония (NH4)2SO4 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. Первая стадия гидролиза. Молекулярное уравнение:   (NH4)2SO4 + H2O NH4OH + NH4HSO4 (NH4)2SO4 + H2O NH4OH + NH4HSO4Полное ионное уравнение:   2NH4- + SO42- + H2O NH4OH + NH4+ + H+ + SO42- 2NH4- + SO42- + H2O NH4OH + NH4+ + H+ + SO42-Краткое ионное уравнение:   NH4+ + H2O NH4OH + H+ NH4+ + H2O NH4OH + H+Вторая стадия гидролиза: Молекулярное уравнение:   NH4HSO4 + H2O NH4OH + H2SO4 NH4HSO4 + H2O NH4OH + H2SO4Полное ионное уравнение:   NH4+ + H+ + SO42- + H2O NH4OH + 2H+ + SO42- NH4+ + H+ + SO42- + H2O NH4OH + 2H+ + SO42-Краткое ионное уравнение:   NH4+ + H2O NH4OH + H+ NH4+ + H2O NH4OH + H+Так как в результате гидролиза образовались ионы водорода (Н+), то раствор будет иметь кислую среду (рН < 7) 9). Сульфид алюминия тут же подвергается необратимому гидролизу - гидролиз идет до конца, так как оба продукта (гидроксид алюминия и сероводород) покидают сферу реакции, в результате чего равновесие смещается вправо (поэтому сульфид алюминия в водных растворах не существует). 10) а) При гидролизе рассматриваемой соли: ZnCl2 соль слабого основания и сильной кислоты, гидролиз солей такого типа идёт по катиону: Zn2+ + H2O ⇄ ZnOH+ + H+ (в круглых скобках заряды ионов) Это была запись гидролиза в ионной форме, а в молекулярной: ZnCl2 + H2O ⇄ ZnOHCl + HCl Видим из ионного уравнения, что в растворе происходит накопление ионов водорода.Один из способов смещения равновесия в сторону прямой реакции (в данном случае - уси-ления гидролиза) удаление продуктов реакции; тогда, по принципу Ле-Шателье, интенсивнее пойдет процесс, направленный на восполнение этих продуктов, т.е. прямая реакция, гидролиз.1) Добавляем КОН. Он диссоциирует на К+и ОН-. А вот ионы ОН- будут взаимодей-ствивать с ионами водорода, которых в растворе гидролизующейся соли ZnCl2 в избытке. Результат взаимодействия - образование молекул воды: Н++ ОН- = Н2О, которая является малодиссоциирующим соединением. То есть, тем самым мы производим связывание ионво водорода и вывод их из зоны реакции, что сместит равновесие гидролиза в сторону его усиления. 2) Na2CO3. Тут надо смотреть, с образованием каких ионов идёт гидролиз данной соли. Это соль сильного основания и слабой кислоты. Гидролизуется карбонат натрия по аниону: СО32-+ Н2О ⇄ НСО3-+ ОН- Видим, что гидролиз карбоната натрия ведёт к накоплению в растворе этой соли гидроксид-ионов ОН-. Так что при сливании растворов карбоната натрия и хлорида цинка мы получим такой же результат, что и в предыдущем случае: ионы Н+ из раствора хлорида цинка и ионы ОН- из раствора карбоната натрия будут взаимоно нейтрализовывать друг друга с образованием воды. так что, тут тоже гидролиз усиливается и проходит до конца - с образованием соответству-ющих гидроксидов и кислот. |