Лабораторная работа ареометр. Отчет по лабораторной работе 4 По дисциплине Методы исследования физикохимических систем
 Скачать 143.81 Kb. Скачать 143.81 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования санкт-петербургский горный УНИВЕРСИТЕТ Кафедра металлургии Отчет по лабораторной работе №4 По дисциплине: Методы исследования физико-химических систем (наименование учебной дисциплины согласно учебному плану) Тема: Определение плотности жидкости ареометром Автор: студент гр. МЦ-19 _________________ Петровская Э.А. Шуйская В.С. (подпись) (Ф.И.О.) ОЦЕНКА: _________ Дата: _________ ПРОВЕРИЛ: ассистент __________________ / Куртенков Р.В. / (подпись) (Ф.И.О.) Санкт-Петербург 2021 год Цель работы и задачи: знакомство с устройством ареометр, измерение плотности жидкости с помощью ареометра, определение концентрации соли в растворах. Приборы и принадлежности: 1. Набор ареометров; 2. Стеклянные цилиндры; 3. Термостат 4. Исследуемые растворы. Порядок выполнения работы: 1. Налить исследуемый раствор соли в стеклянный цилиндр для измерения плотности. Установить в термостат и установить температуру 20 ℃. Нагреть до заданной температуры и выдержать цилиндры для установления температуры. Температуру проверить ртутным термометром. 2. Осторожно опускают в исследуемый раствор чистый сухой ареометр, шкала которого позволяет определить ожидаемую величину плотности. 3. Используя справочные данные (рисунок 2), определить концентрацию соли в исследуемых растворах. 4. Представить полученные концентрации солей в различных единицах измерения: а) % б) моль/л, в) г/л. Экспериментальные и расчетные данные занести в таблицу. 5. Вычислить относительную разницу между суммой объемов воды и кристаллической соли, взятых для приготовления наиболее концентрированного раствора, и объемом полученного раствора. Для расчета удобно выразить объемы веществ через их массы и плотности: 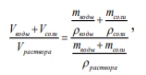 6. Объяснить причину возникновения этой разницы. 7. Повторить п. 1-6 для других растворов солей. 8. Для наиболее концентрированных растворов выполнить исследования влияния температуры на плотность раствора, Данные занести в таблицу. 9. Построить график зависимости плотности раствора от температуры, сделать вывод о возможности измерения плотности растворов при различной температуре и точности измерений. 10. Сделать выводы по всей работе. Обработка результатов работы: Таблица 1 – экспериментальные и расчетные данные
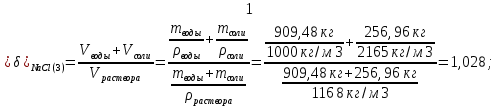 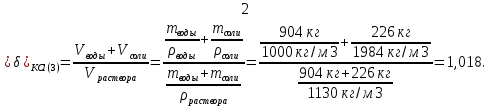 Такая относительная разница между суммой объемов воды и кристаллической соли, взятых для приготовления наиболее концентрированного раствора, и объемом полученного раствора является результатом нескольких процессов: - Межмолекулярное взаимодействие (ММВ), из-за которого растворы нельзя считать механическими смесями молекул. - В результате диссоциации происходит разрушение кристаллических решеток, имеющих свой объем, то есть исходных молекул вещества может и не существовать в растворе. В нашем случае хлориды натрия и калия в воде находятся в виде ионов Na+, К+ и Сl-. Проведем аналогичные расчеты для остальных растворов: 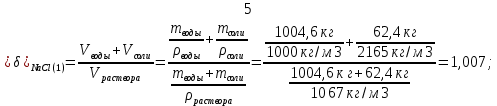 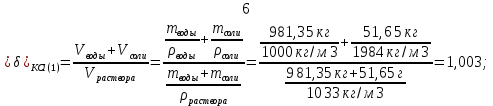 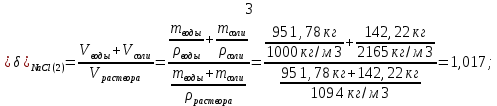 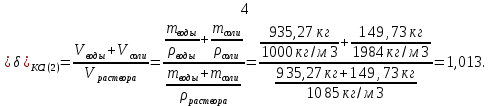
Полученные результаты подтверждают вышесказанное. Построим график зависимости плотности растворов от температуры (Рисунок 1): 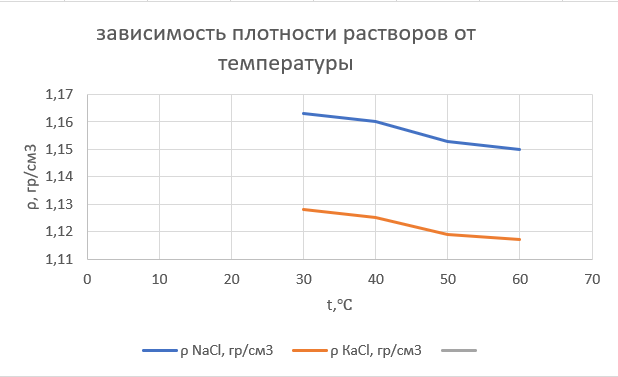 Рисунок 1 – График зависимости ρ(t) для анализируемых растворов Вывод: в ходе проделанной работы были освоены навыки работы с ареометром и термостатом, определены плотности анализируемых растворов и рассчитана относительная разница между суммой объемов воды и кристаллической соли, взятых для приготовления раствора, и объемом полученного раствора с пояснением причин такого явления. На значениях измерений плотности одних и тех же растворов при разной температуре был построен график зависимости плотности растворов от их температуры, имеющий линейный характер. Это говорит о том, что по плотности раствора при данной температуре может быть рассчитана приблизительная плотность при новой температуре (в интервале от 30 до 60 °С), причем угол наклона прямых на графике для анализируемых солей NaCl и KCl примерно равны. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
