Отчет по лабораторной работе 4 по теме Оценка эффективности термостабилизатора поливинилхлорида (пвх)
 Скачать 2.43 Mb. Скачать 2.43 Mb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное автономное образовательное учреждение высшего образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» Инженерная школа природных ресурсов Направление подготовки (специальность) – Химическая технология Отделение химической инженерии Отчет по лабораторной работе № 4 по теме: Оценка эффективности термостабилизатора поливинилхлорида (ПВХ) Дисциплина: Физико-химические основы старения, стабилизации и модификации полимеров Выполнил студент гр. 2ДМ11 ____________ Родиков П.Г. (Номер группы) (Подпись) (Ф.И.О.) _______________ 2022 г (Дата сдачи отчета) Отчет принят: к.х.н., доцент _________ Бондалетова Л.И. (Ученая степень, ученое звание, должность) (Подпись) (Ф.И.О.) _______________ 2022 г (Дата проверки отчета) Томск 2022 г. Содержание1ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 3 1.1 Задачи термосабилизации ПВХ 3 1.2 Термостабилизаторы ПВХ 7 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 9 3 Обсуждение результатов 12 Список литературы 14 Цель: оценить эффективность синтезированных стабилизаторов поливинилхлорида (ПВХ), сравнить стабилизирующие свойства смесей солей металов при термодеструкции ПВХ. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ1.1 Задачи термосабилизации ПВХСтабилизаторы, применяемые для замедления окислительной деструкции, называются антиоксидантами. В качестве антиоксидантов используют фенолы, ароматические амины, сульфиды, меркаптаны и др. Они ингибируют цепной процесс окисления двумя путями: либо обрывают цепь окисления, т. е. взаимодействуют со свободными радикалами на стадии их образования (антиоксиданты аминного и фенольного типа), либо предотвращают разложение гидропероксидов по радикальному механизму (сульфиды, тиофосфаты и др.). Антиоксиданты первой группы имеют в молекуле подвижный атом водорода, энергия связи которого с углеродом меньше, чем энергия связи подвижного атома водорода в полимере. Поэтому гидропероксидный радикал легче вступает в реакцию с ингибитором, чем с полимером. Образующиеся при этом свободные радикалы ингибитора малоактивны и не могут вызвать продолжение цепи радикальных реакций. Соединения, способные превращать пероксидные радикалы (ROO*) в нерадикальные продукты, называют ловушками пероксидных радикалов. Наиболее важными классами стабилизаторов этого типа являются ароматические амины и пространственно-затрудненные фенолы. В реакциях этих соединений с пероксидными радикалами образуются гидропероксиды и устойчивые ароматические аминные и пространственно-затрудненные феноксильные радикалы, инертные в реакции продолжения цепи окисления: 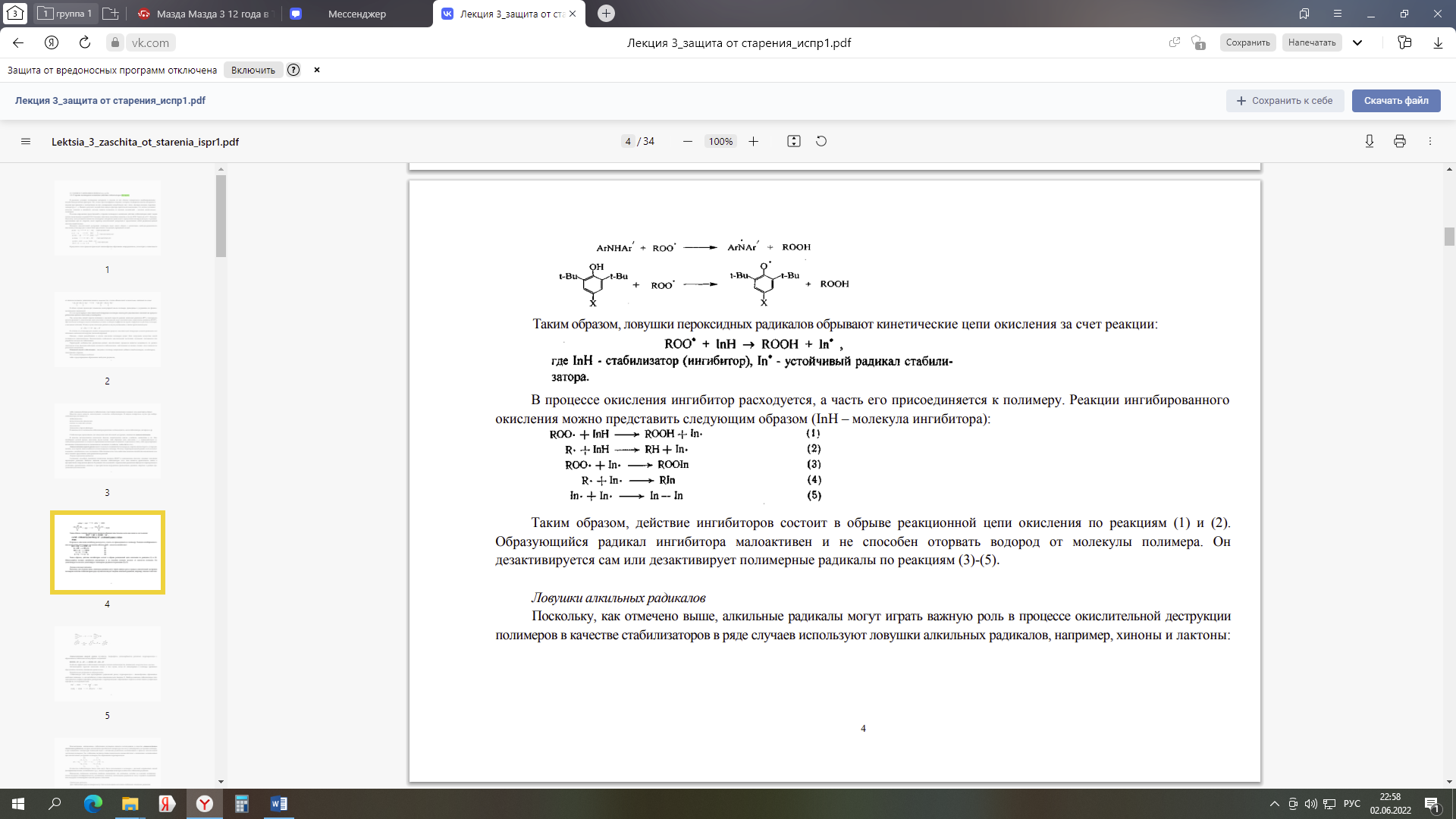 Таким образом, ловушки пероксидных радикалов обрывают кинетические цепи окисления за счет реакции: 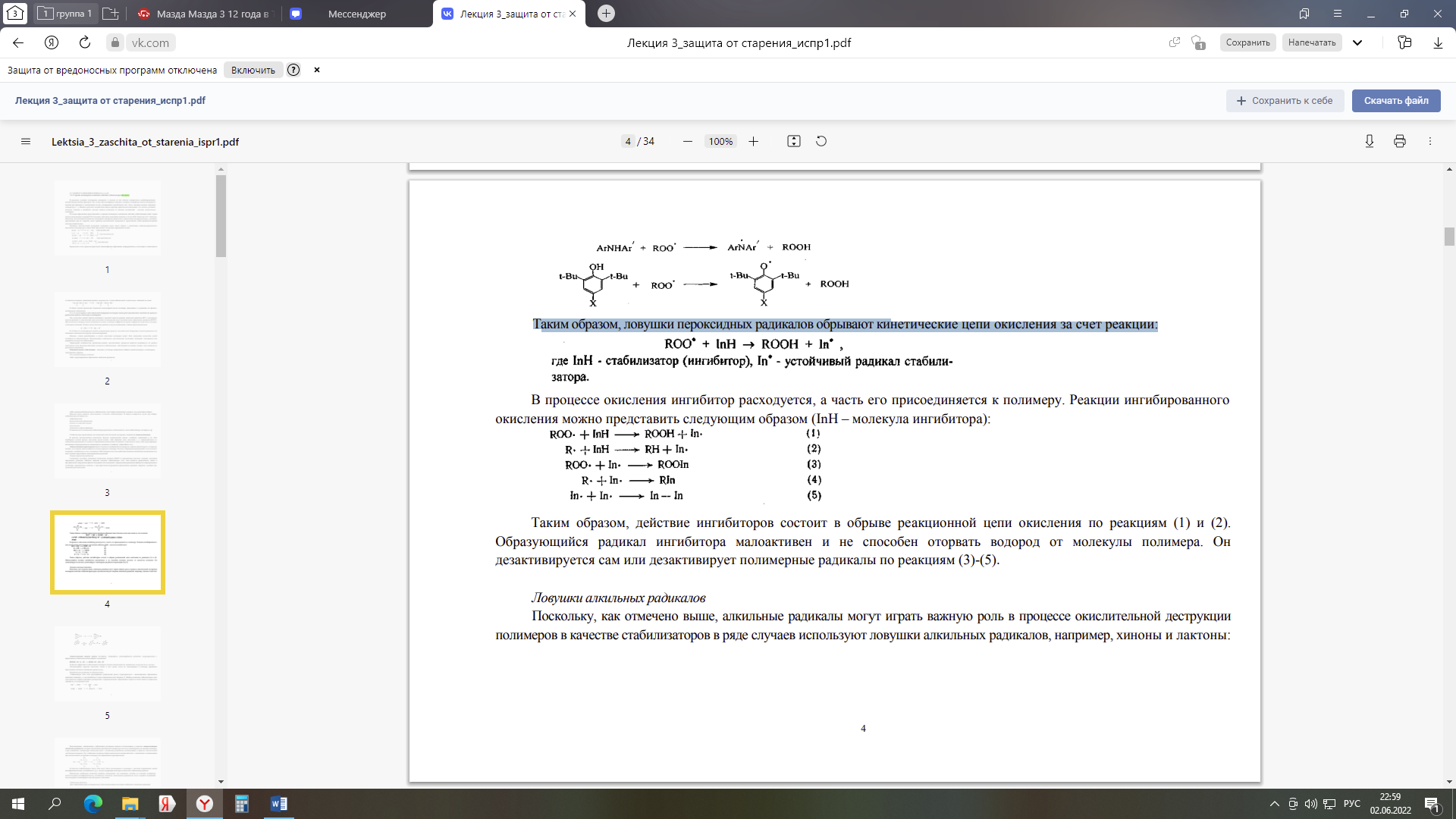 В процессе окисления ингибитор расходуется, а часть его присоединяется к полимеру. Реакции ингибированного окисления можно представить следующим образом (InH – молекула ингибитора): 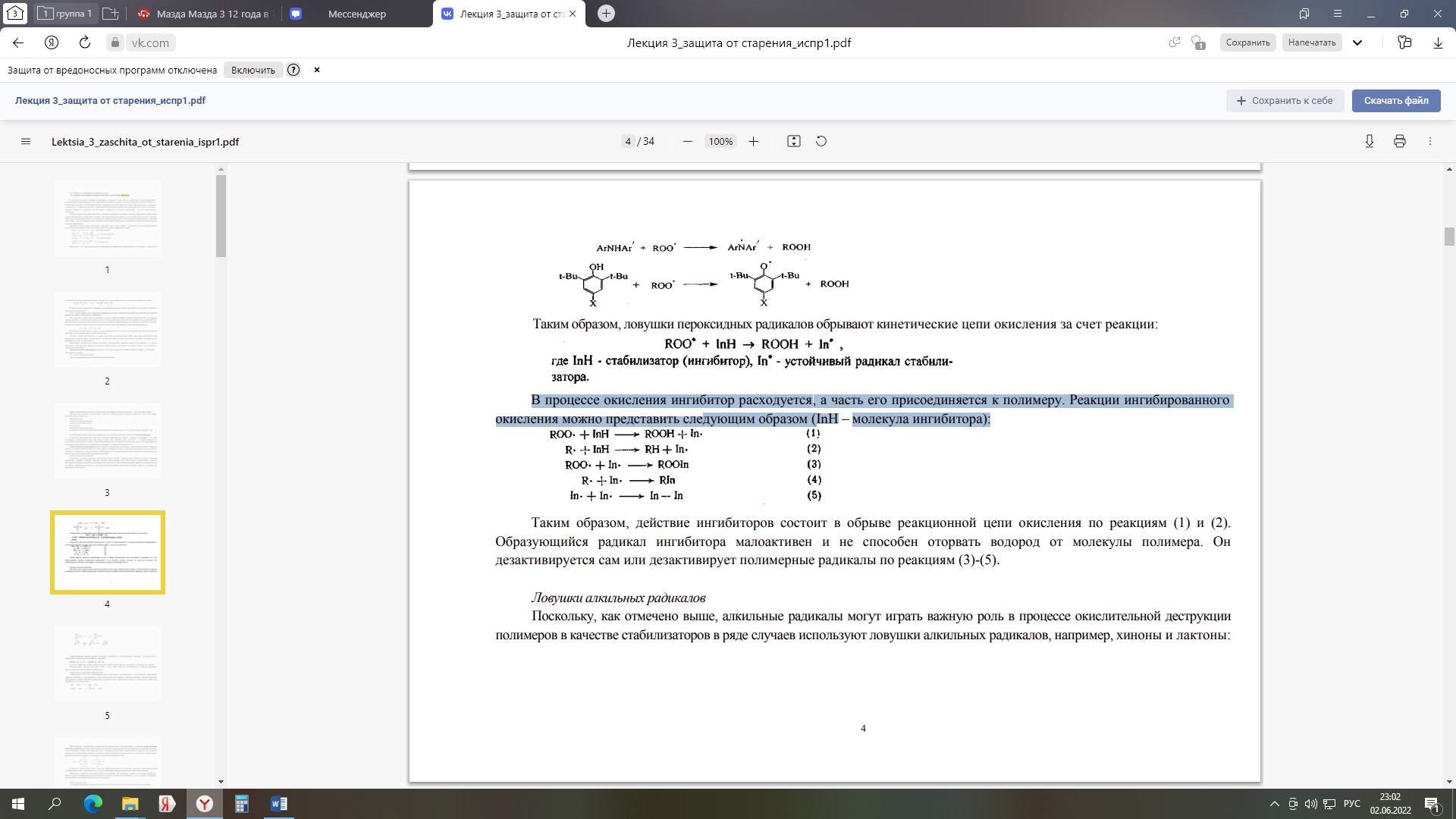 Таким образом, действие ингибиторов состоит в обрыве реакционной цепи окисления по реакциям (1) и (2). Образующийся радикал ингибитора малоактивен и не способен оторвать водород от молекулы полимера. Он дезактивируется сам или дезактивирует полимерные радикалы по реакциям (3)-(5). Поскольку, как отмечено выше, алкильные радикалы могут играть важную роль в процессе окислительной деструкции полимеров в качестве стабилизаторов в ряде случаев используют ловушки алкильных радикалов, например, хиноны и лактоны: 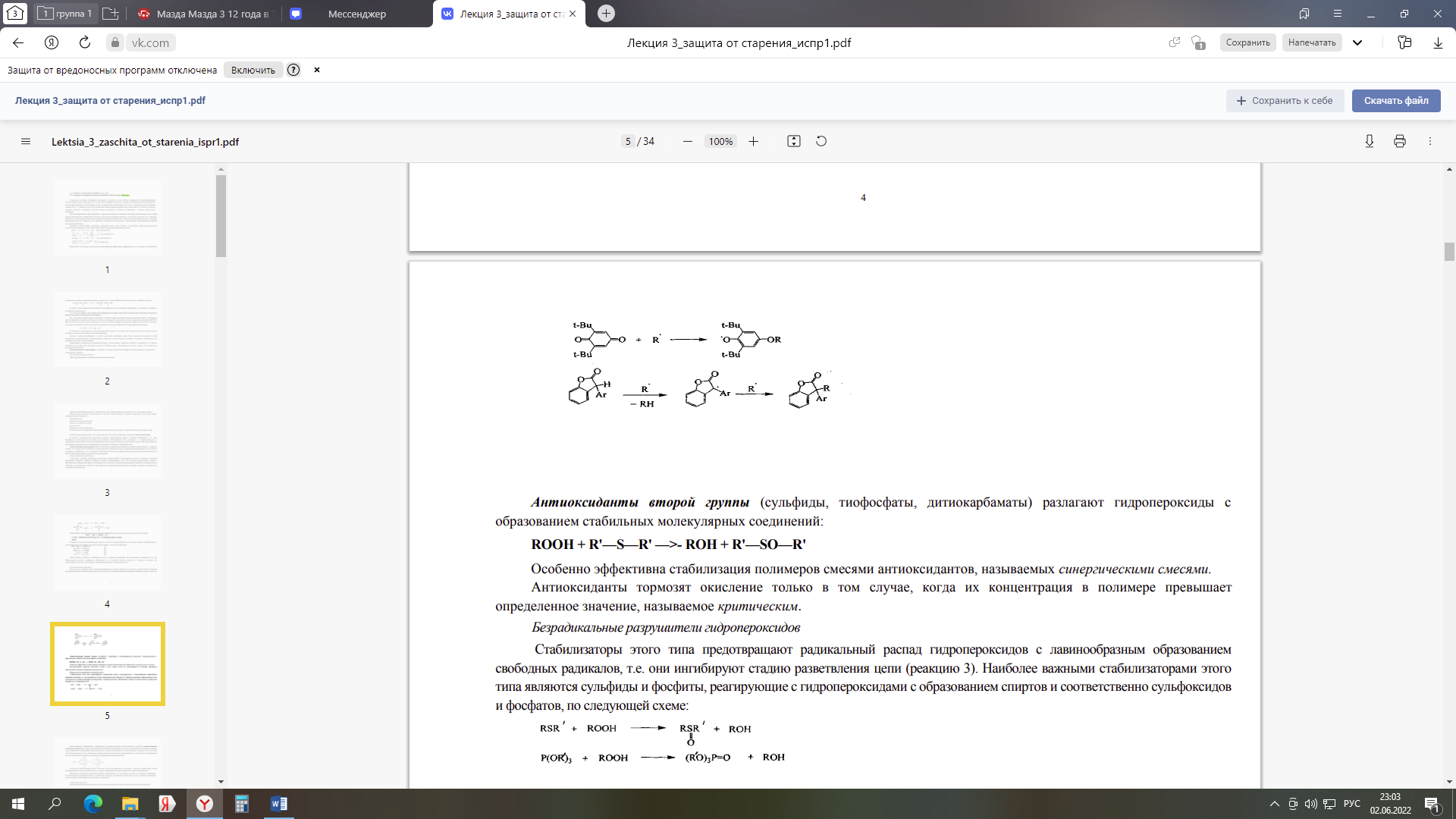 Антиоксиданты второй группы (сульфиды, тиофосфаты, дитиокарбаматы) разлагают гидропероксиды с образованием стабильных молекулярных соединений: ROOH + R'—S—R' —>- ROH + R'—SO—R' Особенно эффективна стабилизация полимеров смесями антиоксидантов, называемых синергическими смесями. Антиоксиданты тормозят окисление только в том случае, когда их концентрация в полимере превышает определенное значение, называемое критическим. Безрадикальные разрушители гидропероксидов предотвращают радикальный распад гидропероксидов с лавинообразным образованием свободных радикалов, т.е. они ингибируют стадию разветвления цепи. Наиболее важными стабилизаторами этого типа являются сульфиды и фосфиты, реагирующие с гидропероксидами с образованием спиртов и соответственно сульфоксидов и фосфатов, по следующей схеме: 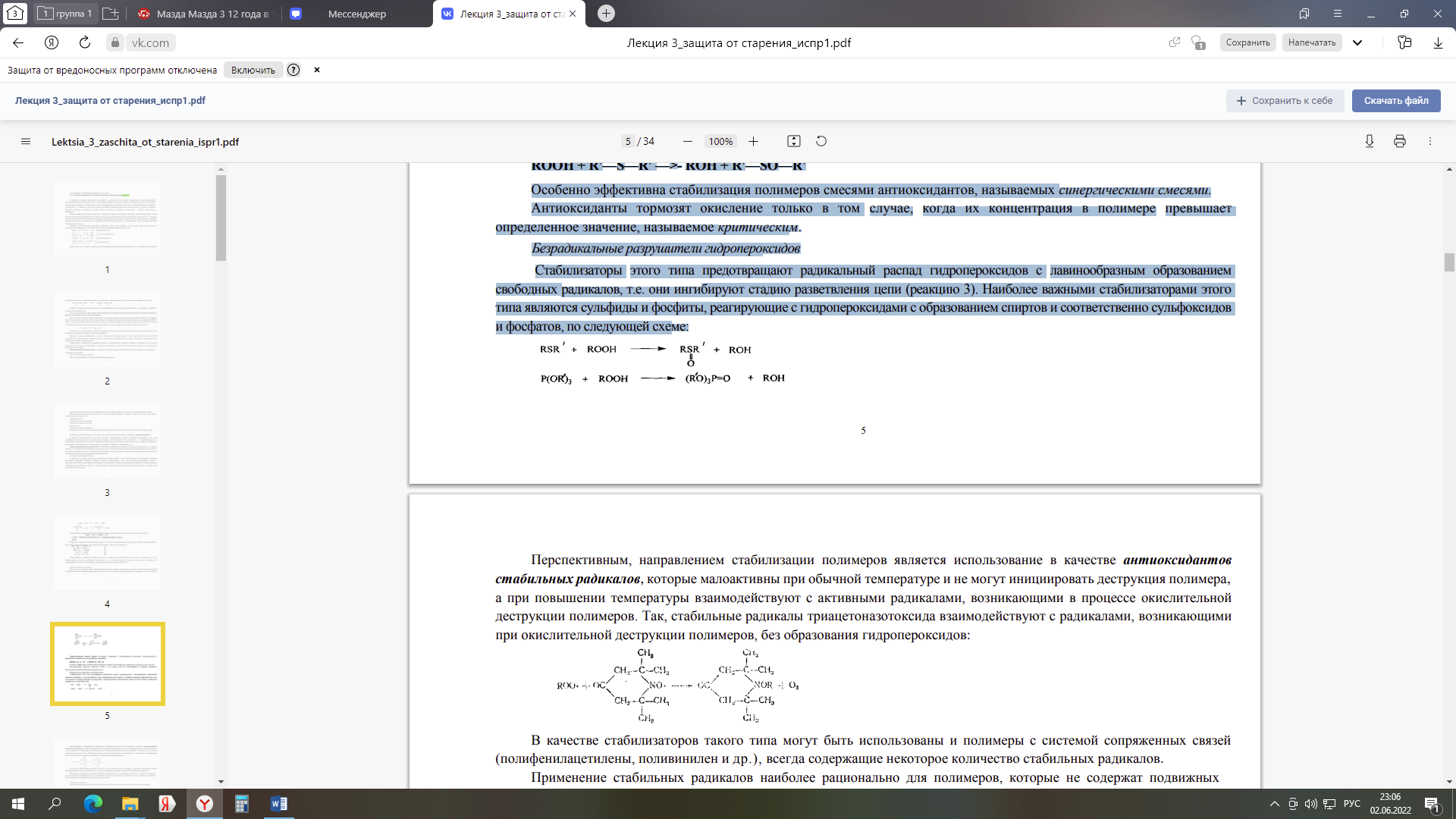 Перспективным, направлением стабилизации полимеров является использование в качестве антиоксидантов стабильных радикалов, которые малоактивны при обычной температуре и не могут инициировать деструкция полимера, а при повышении температуры взаимодействуют с активными радикалами, возникающими в процессе окислительной деструкции полимеров. Так, стабильные радикалы триацетоназотоксида взаимодействуют с радикалами, возникающими при окислительной деструкции полимеров, без образования гидропероксидов: 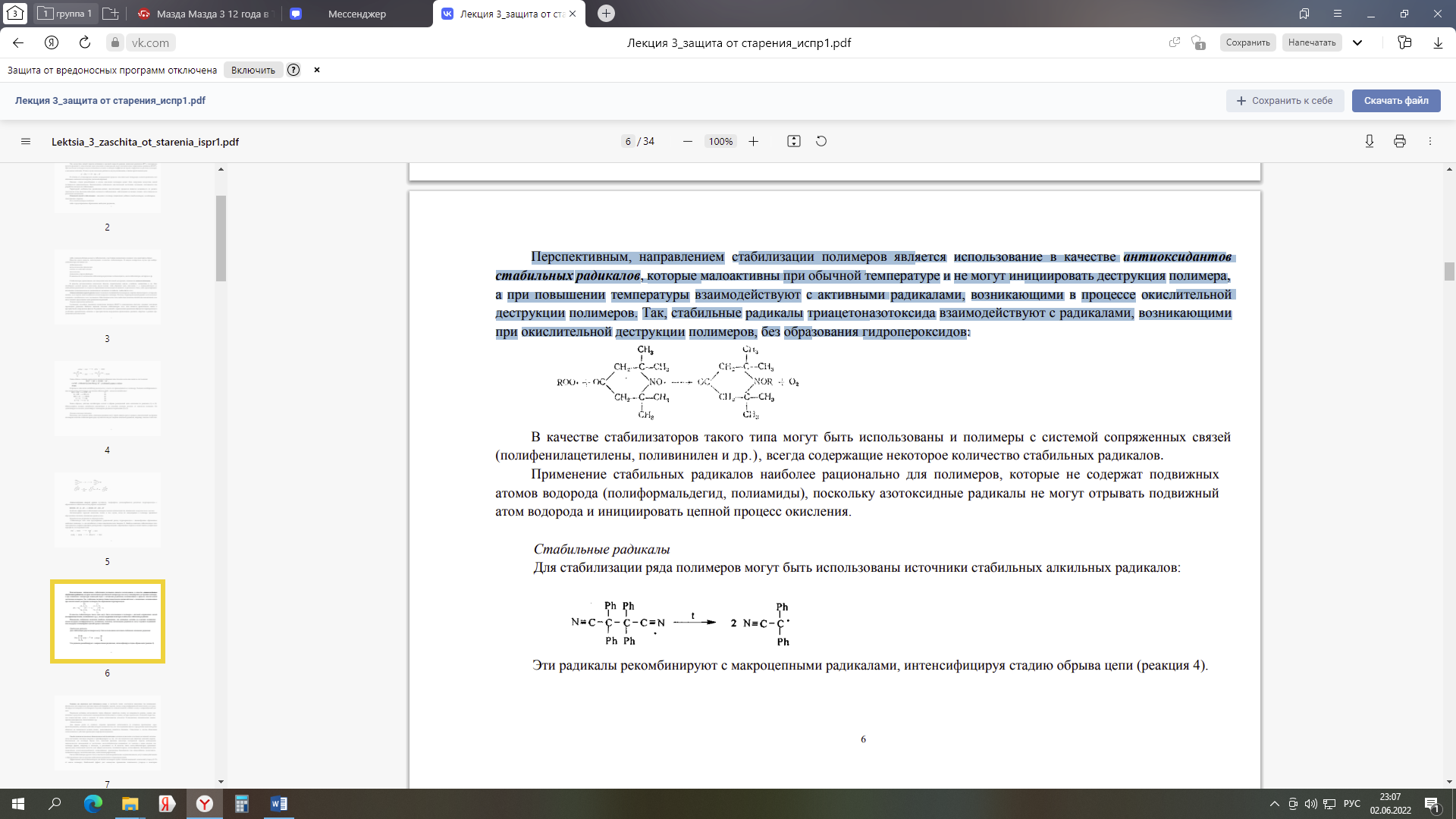 В качестве стабилизаторов такого типа могут быть использованы и полимеры с системой сопряженных связей (полифенилацетилены, поливинилен и др.), всегда содержащие некоторое количество стабильных радикалов. Применение стабильных радикалов наиболее рационально для полимеров, которые не содержат подвижных атомов водорода (полиформальдегид, полиамиды), поскольку азотоксидные радикалы не могут отрывать подвижный атом водорода и инициировать цепной процесс окисления. Для стабилизации ряда полимеров могут быть использованы источники стабильных алкильных радикалов: 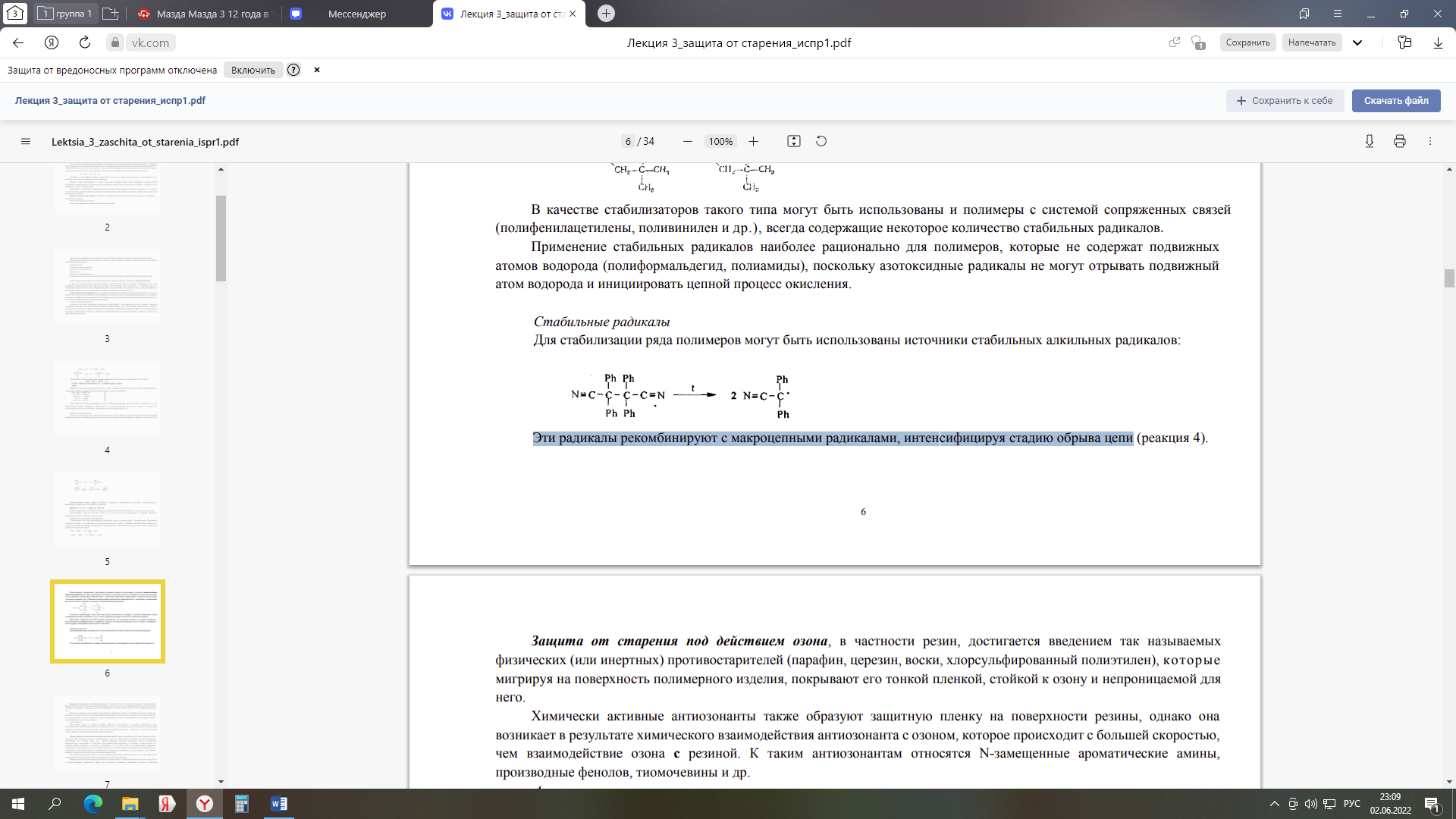 Эти радикалы рекомбинируют с макроцепными радикалами, интенсифицируя стадию обрыва цепи При стабилизации поливинилхлорида надо учитывать, что он отщепляет хлористый водород уже при обычных условиях эксплуатации. Этот процесс ускоряется под действием солнечного света, нагревания и сопровождается появлением хрупкости и изменением цвета у изделий из поливинилхлорида [1]. Термостабилизатор подавляет лабильные атомы хлора, не позволяя им оторваться от молекул, поглощает образовавшийся хлористый водород, реагирует с выделившимися свободными радикалами, предотвращает образование двойных связей, действует как антиоксидант, не давая возможности кислороду воздуха окислять макромолекулу. В качестве термостабилизаторов используются карбонаты и фосфаты натрия, соединения свинца, стеараты и лаураты кальция, бария, амины и др. По своему действия наиболее эффективны соединения свинца (карбонат свинца, свинцовый глет, сурик и др). Стабилизация полинилхлорида протекает по следующему механизму:  где R>С12; Ме – металл группы IIA или IIБ [4]. где R>С12; Ме – металл группы IIA или IIБ [4]. Образующая эфирная группа термически более устойчива, чем исходная хлоридная группа. Поэтому уменьшается активность факторов, инициирующих отщепление HCl из полимера, и вместе с тем ослабевает реакция дегидрохлорирования. 1.2 Термостабилизаторы ПВХСтабилизаторы для ПВХ можно разделить на две большие группы: 1. Основные стабилизаторы; 2. Вспомогательные стабилизаторы. К основным стабилизаторам ПВХ относят обычно: свинцовые соли, соли металлов II-й группы (Ca-Zn или Ba-Cd стабилизаторы), оловоорганические соединения. К вспомогательным стабилизаторам относят следующие соединения: глицидильные и эпоксидные соединения, производные пиридина, производные урацила, полиспирты, цеолиты, гидрокальциты, соли редкоземельных металлов. Свинцовые стабилизаторы можно разделить на три группы: - простые (соли содержат большое количество PbO), - сложные (смеси солей); - свинцовые стабилизаторы со смазывающим эффектом. Основной задачей данных стабилизаторов является связывание выделяющегося HCl. Следующая группа стабилизаторов – это соли металлов II-группы. Данная группу приобрела особое внимание и применение в последнее время – это Ca – Zn – стабилизаторы из-за своей низкой токсичности. К данной группе относятся Ca – Zn и Ba – Cd – стабилизаторы. Также менее токсичными и немаловажными стабилизаторами являются оловоорганические стабилизаторы ПВХ, а также данные стабилизаторы дают возможность получать изделия с высокой степенью прозрачности. В свою очередь данная группа делится на две большие группы: карбоксилаты олова, меркаптиды и меркаптоэфиры олово (серосодержащие). Данную группу можно считать наиболее подходящей для процессов переработки. 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬРеактивы и материалы: - поливинилхлорид суспензионный (ПВХ) – 3 г; - синтезированные стеарата цинка– 0,1 г; - бумага индикаторная универсальная – 3−4 полоски; - асбестовый картон. Поливинилхлорид (ПВС) – синтетический полимер, мономерное звено – молекула хлорида этилена. Формула поливинилхлорида: (-CH2-CCl-)n, где n – это степень полимеризации. Таблица 1 – Физико-химические свойства ПВХ
Набухает в ацетоне, бензоле. Не растворим в воде, спиртах. Не взаимодействует с кислотами, основаниями. Поливинилхлорид (ПВХ) применяется: в автомобильной отрасли в строительстве в потребительских товарах в химической промышленности в электрооборудовании в медицине и фармакологии в упаковке Стеарат цинка – химическое соединение, соль магния и стеариновой кислоты, белое вещество, не растворяется в воде. Стеарат цинка "цинковое мыло", которое отталкивает воду. Порошок стеарата цинка не растворяется в спирте, эфире и других полярных растворителях. Однако, в нагретом виде может растворяться в бензоле, хлорированных углеводах и других ароматических углеродах. Стеарат цинка является наиболее эффективной смазкой для форм. Обладает гидрофобным эффектом и не содержит электролитов. Порошок стеарата цинка применяется в основном в качестве разделительного средства и смазочного материала для резины, пластмассы. Некоторые физико-химические свойства олеата магния представлены в таблице 2. Таблица 2 – Физико-химические свойства стеарата магния
Посуда и инструменты: Стакан фарфоровый или стеклянный термостойкий высокий; ступка фарфоровая с пестиком; палочка стеклянная; проволока тонкая длиной 100‒150 мм – 2 шт. Оборудование и приборы: Весы лабораторные, разновесы; плитка электрическая; термометр лабораторный с диапазоном измерений до 200 °С; баня глицериновая (стакан лабораторный на 0,5‒1,0 л с техническим глицерином); термошкаф; часы или секундомер. Ход работы: В ступку помещают 0,1 г синтезированной стеарат цинка (олеат кальция, стеарат цинка, олеат кобальта, стеарат никеля). Тщательно растирают пестиком до получения однородного тонкодисперсного порошка. Затем в ступку добавляют малыми порциями 1 г ПВХ, тщательно растирая содержимое между добавлением порций. Полученную смесь переносят в пробирку. В другую такую же пробирку помещают 1 г чистого ПВХ. В каждую из пробирок вводят смоченную водой полоску индикаторной бумаги, закреплённой на конце проволоки. Второй конец проволоки фиксируют посредством его загиба на срезе пробирки и неплотного закрытия отверстия пробкой. Расстояние от нижнего конца индикаторной бумажки до верхнего слоя ПВХ в обеих пробирках должно быть одинаковым и составлять 20‒25 мм. Глицериновую баню нагревают до 170-175 °С, после чего устанавливают в неё пробирки с образцами и начинают отсчёт времени. Наблюдают за изменениями, происходящими с обоими образцами. Фиксируют время начала заметного потемнения ПВХ и начала покраснения краёв полосок индикаторных бумажек. Отношение интервалов времени с начала термического воздействия до покраснения бумажек в пробирках принимают как меру эффективности термостабилизатора. 3 Обсуждение результатовПолученные результаты занесены в таблицу 1. Таблица 1 – Результаты опыта
Данные всех полученных стабилизаторов представлены в таблице 2. Таблица 2 – Сводная таблица результатов
Используемые формулы: 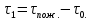 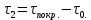 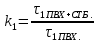 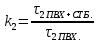 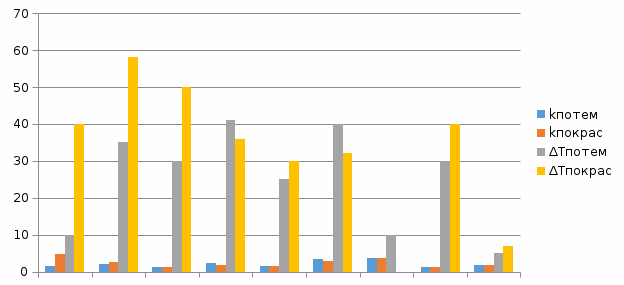 Рисунок 1 - Диаграмма относительной эффективности термостабилизаторов ПВХ Вывод Исследовано влияние различных термостабилизаторов на процесс деструкции ПВХ, установлено, что олеат кальция и стеарат цинка понижают устойчивость ПВХ к терморазложению, тогда как олеат кобальта и стеарат никеля увеличивают ее. Список литературыЛавров Н.А., Ксенофонтов В.Г., Белухичев Е.В. О механизме стабилизации поливинилхлорида. СПбГТУ.: Синтез и технология полимеров, 2016. Варлан, К.Е. Синтез, реакции и основы физикохимии полимеров. Методические указания к лабораторному практикуму по курсу «Химия и физика высокомолекулярных соединений» для студентов направлений 6.051301 – Химическая технология; 6.040101 ‒ Химия. / К.Е. Варлан. – Д.: ДНУ-ХХТ, 2015. – 59 с. Горбунов Б.Н. Химия и технология стабилизаторов полимерных материалов/Б.Н. Горбунов, Я.А. Гурвич, И.П. Маслов. – М.: Химия, 1981. – С. 34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 :
: