6 лаба анализ 5+6. Отчет по лабораторной работе 6 По дисциплине
 Скачать 246.13 Kb. Скачать 246.13 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и физической химии Отчет по лабораторной работе №6 По дисциплине ОБЩАЯ ХИМИЯ (наименование учебной дисциплины согласно учебному плану) Тема: АНАЛИЗ СМЕСИ КАТИОНОВ ПЯТОЙ И ШЕСТОЙ АНАЛИТИЧЕСКИХ ГРУПП Автор: студент группы ИЗБ-22-1 / Сень С. С. / (шифр группы) (подпись) (Ф.И.О.) ОЦЕНКА: Дата: 2023 г. ПРОВЕРИЛ / / (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2023 г. ЦЕЛЬ РАБОТЫ Установить качественный состав раствора, содержащий катионы V и VI аналитических групп. Оборудование и реактивы В штативе: гидроортофосфат натрия, сульфат цинка, роданид (тиоцианат) калия, гидроксид аммония, гидроксид натрия, гидроксид калия – 5% растворы. В лаборатории: держатели для пробирок, воронки, фильтры, индикаторная бумага, пробирки, стеклянные палочки. В вытяжном шкафу: соляная кислота, азотная кислота, серная кислота – 2 н. растворы; гидроксид калия, гидроксид натрия – 6 н. растворы; гидроксид аммония – концентрированный раствор; сульфид натрия – 5 % раствор, гексацианоферрат (II) калия, гексацианоферрат (III) калия, тетрароданомеркурат (II) аммония – 5 % растворы, висмутат натрия крист., хлорид аммония крист., диметилглиоксим – 1 % спиртовой раствор. Ход работы Анализируемый раствор может содержать катионы пятой (Mn2+ , Mg2+ , и Fe3+) и шестой (Hg2+ , Cu2+ , Ni2+ , Co2+ , Cd2+) аналитических групп. Схема анализа приведена на рис. 1 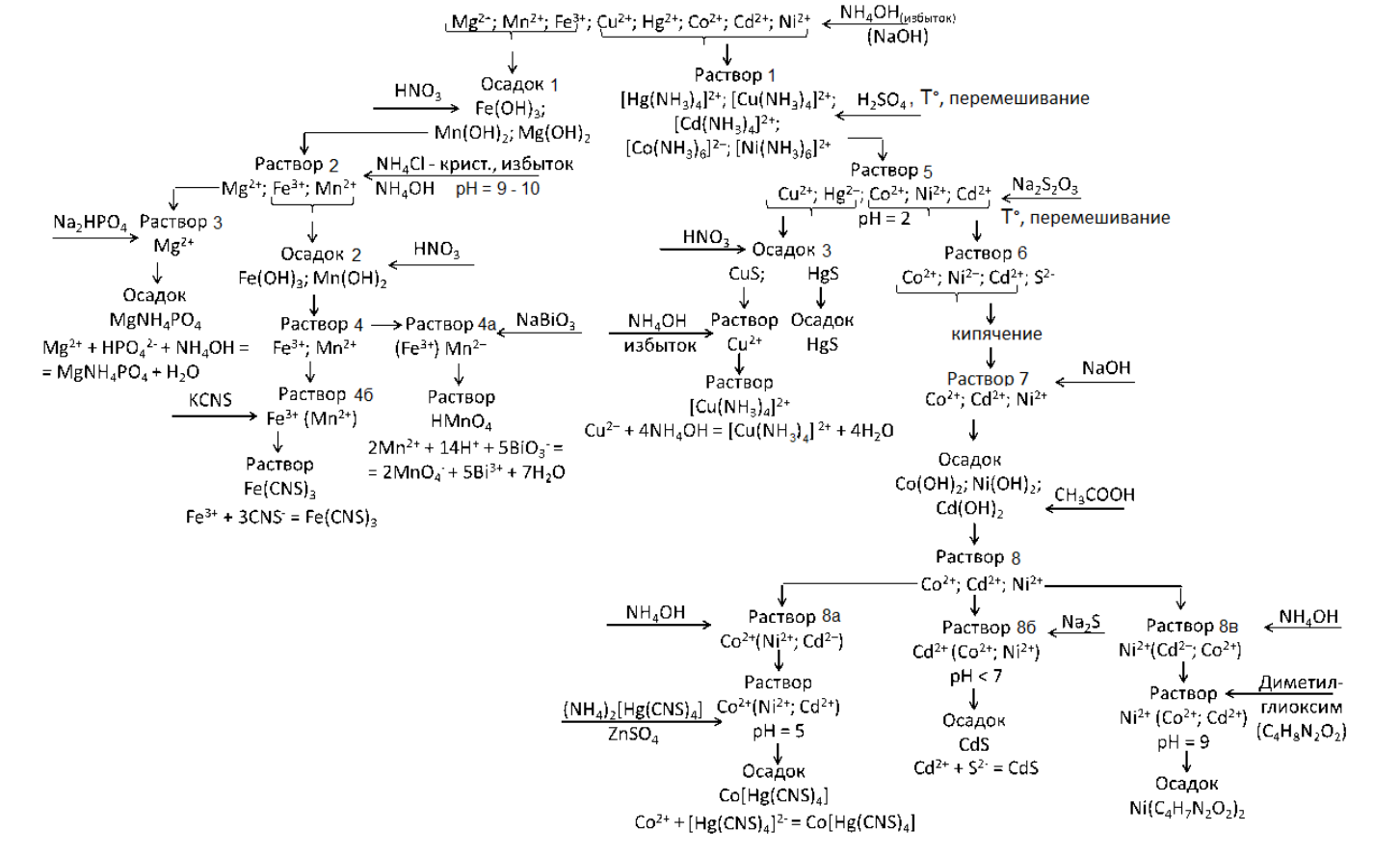 1. Провел предварительные испытания, целью которых является возможное упрощение схемы анализа; установление, как версии (но не как факта обнаружения), наличия или отсутствия в растворе определенного типа ионов. При проведении предварительных испытаний выполнил дробный анализ раствора на обнаружение катионов = Fe3+ по реакции с роданидом аммония или калия; = Cu2+ по реакции с гидроксидом аммония; = Hg2+ по реакции с медной пластинкой; = Mn2+ по реакции с висмутатом натрия. По результатам предварительных испытаний установил нахождение в растворе катиона Mn2+ Ход анализа: К двум каплям раствора соли марганца (II) прибавил 2 мл раствора азотной кислоты 1 : 1 и немного кристаллического висмутата натрия. Смесь перемешал. При этом образовался раствор марганцовой кислоты розового цвета. 2. Разделил катионы V и VI групп, последовательно добавив избыток концентрированного раствора гидроксида аммония; нескольких капель 6 н. раствора гидроксида калия или натрия для полного выделения катионов магния в виде Mg(OH)2. После фильтрации получаю: осадок 1, содержащий гидроксиды V аналитической группы, и раствор 1, содержащий аммиакаты VI (аммиачной) аналитической группы. 3. Растворение осадка катионов V аналитической группы. Осадок 1 на фильтре растворил 2 н. азотной кислотой. Растворимость гидроксидов группы увеличивается в следующей последовательности: Fe(OH)3 – Mn(OH)2 – Mg(OH)2. В азотнокислой среде магний обязательно перейдет в раствор, а часть гидроксидов железа и марганца может остаться на фильтре в виде бурого осадка. 4. Отделение магния. К раствору 2 прибавил полшпателя кристаллического хлорида аммония и нейтрализовал раствор до рН = 10-11. Осадок отфильтровал. В фильтрате 3 – катион магния, в осадке 2 – гидроксиды железа и марганца. 5. Анализ присутствия магния. В растворе 3, полученном в п. 4, провел качественную реакцию на магний. В ходе данной реакции белого кристаллического осадка двойной соли ортофосфата аммония-магния не образовалось Ионы Cu2+ и Hg 2+ в анализируемом растворе отсутствуют, операция их удаления из раствора исключается. 10. Анализ катионов Ni2+ , Co2+ и Cd2+ Образовался желтый осадок сульфида кадмия Вывод: В ходе данной работы я установил, что в растворе под номером 38 содержатся катионы марганца и кадмия. |
