МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение высшего образования
«НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
|
(наименование отделения / школы)
|
|
(направление / специальность)
|
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
ГАЛОГЕНЫ
|
(номер / название лабораторной работы)
|
Вариант:
|
|
(номер вашего варианта)
|
Дисциплина:
|
Химия 2.1
|
|
(наименование дисциплины)
|
|
(номер группы)
|
(фамилия, инициалы)
|
(дата сдачи)
|
|
Руководитель:
|
|
|
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
ГАЛОГЕНЫ
Цель: Изучение способов получения и химических свойств галогенов и их соединений.
Задачи:
ознакомление с лабораторными методами получения галогенов и их соединений с водородом;
изучение окислительно-восстановительных свойств галогенов и их важнейших соединений;
проведение качественных реакций на галогены и галогенид-ионы.
Опыт 1. Получение галогенов
а) Получение хлора
KCl+KMnO4+H2SO4→
|
Уравнение реакции:
|
10KCl + 2KMnO4 + 8H2SO4 = 5Cl2↑ + 2MnSO4 + 6K2SO4 + 8H2O
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2Cl-1 + H2O -2e→ Cl20 +2H+
|
5
|
+1,359
|
MnO4-1 + 8H+ +5e→ Mn+2 + 2H2O
|
2
|
+1,51
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0 = 1,51-1,359 = 0,151, отсюда следует, что E0 > 0, значит окислительно-восстановительная реакция возможна.
|
Ионное уравнение реакции:
|
10Cl-1 + 2MnO4-1 + 16H+ → 2Mn+2 + 5Cl20 + 8H2O
|
Молекулярное уравнение реакции:
|
10KCl + 2KMnO4 + 8H2SO4 = 5Cl2↑ + 2MnSO4 + 6K2SO4 + 8H2O
|
Окислитель:
|
KMnO4 (MnO4-1)
|
Восстановитель:
|
2KCl (2Cl-1)
|
Окраска газообразного хлора:
|
Серо-коричневая
|
KCl+K2Сr2O7+H2SO4→
|
|
Уравнение реакции:
|
6KCl + K2Cr2O7 + 7H2SO4 = 3Cl2↑ + Cr2(SO4)3 + 4K2SO4 +7H2O
|
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2Cl-1 + H2O -2e→ Cl20 +2H+
|
3
|
+1,359
|
Cr2O7-2 + 14H+ +6e→ 2Cr+3 +7H2O
|
1
|
+1,33
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0= 1,33-1,359 = -0,029, отсюда следует, что E0 ˂ 0, значит окислительно-восстановительная реакция термодинамически невозможна.
|
Ионное уравнение реакции:
|
6Cl-1 + Cr2O7-2 +14H+ → 3Cl20 + 2Cr+3 + 7H2O
|
Молекулярное уравнение реакции:
|
6KCl + K2Cr2O7 + 7H2SO4 = 3Cl2↑ + Cr2(SO4)3 + 4K2SO4 +7H2O
|
Окислитель:
|
K2Cr2O7 (Cr2O7-2)
|
Восстановитель:
|
KCl (2Cl-1)
|
Окраска газообразного хлора:
|
Желтая
|
б) Получение брома и йода
KBr+KMnO4+H2SO4→
|
Уравнение реакции:
|
10KBr + 2KMnO4 +8H2SO4 → 5Br2↑ + 2MnSO4 + 6K2SO4 +8H2O
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2Br-1 + H2O -2e→ Br20 + 2H+
|
5
|
+1,087
|
MnO4-1 + 8H+ +5e→ Mn+2 + 4H2O
|
2
|
+1,51
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0 = 1,51-1,087 = 0,423, отсюда следует, что E0 > 0, значит окислительно-восстановительная реакция термодинамически возможна.
|
Ионное уравнение реакции:
|
10Br-1 + 2KMnO4-1 + 16H+ → 5Br20 + 2Mn+2 +8H2O
|
Молекулярное уравнение реакции:
|
10KBr + 2KMnO4 +8H2SO4 → 5Br2↑ + 2MnSO4 + 6K2SO4 +8H2O
|
Окраска паров брома:
|
Желто-коричневая
|
KI+K2Сr2O7+H2SO4→
|
Уравнение реакции:
|
6KI + K2Cr2O7 + 7H2SO4 → 3I2↑ + Cr2(SO4)3 + 4K2SO4 + 7H2O
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2I-1 + H2O -2e→ I20 +2H+
|
3
|
+0,535
|
Cr2O7-2 + 14H+ +6e→ 2Cr+3 +7H2O
|
1
|
+1,33
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0 = 1,33 - 0,535 = 0,795, отсюда следует, что E0 > 0, значит окислительно-восстановительная реакция термодинамически возможна.
|
Ионное уравнение реакции:
|
6I-1 + Cr2O7-2 + 14H+ → 3I20 + 2Cr+3 + 7H2O
|
Молекулярное уравнение реакции:
|
6KI + K2Cr2O7 + 7H2SO4 → 3I2↑ + Cr2(SO4)3 + 4K2SO4 + 7H2O
|
Окраска паров йода:
|
коричневая
|
Вывод
|
Сущность метода получения галогенов заключается в воздействии сильного окислителя (KMnO4, K2Cr2O7) на галогениды в кислой среде.
Фтор подобным способом получить нельзя, так как нет химического окислителя более сильного, чем фтор. Фтор получают только электролизом расплавов.
|
Опыт 2. Сравнение растворимости галогенов в воде
и органическом растворителе
Наблюдение:
|
Раствор йода в воде (йодная вода) имеет коричневый цвет, после того, как в йодному раствору добавили гексан, он не смешался с раствором йода и остался в верхней части смеси. После перемешивания верхний слой гексана окрасился в фиолетовый цвет, принадлежащий йоду.
Исходя из опыта можно сделать вывод, что йод перешел в верхний слой гексана, т.е растворился в нем.
|
Название процесса избирательного перехода растворенного вещества из одной жидкой фазы в контакте с другой несмешивающейся:
|
экстракция
|
Почему галогены растворяются в органических растворителях лучше, чем в воде?
|
Галогены и органические растворители – неполярные соединения. Из правила (подобное растворяется в подобном) следует, что галогены могут растворяться только в органических растворителях (т.е. неполярные в неполярных). Вода – это полярное соединение, поэтому галогены не растворяются в ней.
|
Причина малой растворимости галогенов в воде:
|
Галогены малорастворимы в воде, т.к. молекулы галогенов неполярны, а вода – это полярное соединение, поэтому между ними образуются достаточно сильные межмолекулярные взаимодействия и галогены не растворяются в ней.
|
Опыт 3. Сравнение окислительной активности галогенов
Уравнения реакций
|
Закончите уравнения реакций, расставьте коэффициенты.
|
Пробирка 1:
|
C6H14 + 10KBr + 5Cl2 = C6H5Br + 10KCl + 9HBr
|
Пробирка 2:
|
6KI + 3Cl2 + C6H14 = 6KCl + 6CI + 7H2
|
Окраска слоя органического растворителя
|
Укажите окраску слоя органического растворителя в пробирках.
|
Пробирка 1:
|
Желтый
|
Пробирка 2:
|
Фиолетовый
|
Опыт 4. Получение галогеноводородов
а) Получение хлороводорода
|
Закончите уравнение реакции, расставьте коэффициенты.
|
2NaCl(тв) + H2SO4(конц) = Na2SO4 + 2HCl↑
|
Наблюдения:
|
Бурная реакция с выделением белого газа
|
Цвет индикатора:
|
Темно-коричневый
|
Причина появления окраски индикатора:
|
Хлороводород имеет кислую среду pH ˂ 7
|
Почему в опыте используется твердый хлорид натрия и концентрированная кислота, а не раствор соли и не разбавленная кислота?
|
В опыте используется твердый хлорид натрия и концентрированная кислота, потому что реакция безводная и образовавшаяся соляная кислота, «не найдя» воду (т.к. соляная кислота является сильной, то диссоциирует в растворе полностью), улетучивается в виде хлороводорода (необратимая реакция).
Протекание реакции всегда характеризуется: выпадением осадка, выделением газа, изменением цвета и т.д. Если же смешать KCl(р-р) и H2SO4(разб), то образуется растворимая соль K2SO4 и HCl диссоциирует на ионы, поэтому не будет ни осадка, ни газа, реакция не протекает (обратимая реакция).
|
б) Получение бромоводорода и йодоводорода
|
Закончите уравнение реакции, расставьте коэффициенты.
|
NaBr(тв) + H3PO4(конц) t→ Na3PO4 + 3HBr↑
|
NaI(тв) + H3PO4(конц) t→ Na3PO4 + 3HI↑
|
Наблюдения:
|
При добавлении к NaBr, NaI концентрированной ортофосфорной кислоты, растворы стали прозрачные с взвешенными кристаллами, после нагревания раствора индикаторная бумага стала бардовой, что соответствует кислой среде
|
Цвет индикатора:
|
бардовый
|
Причина появления окраски индикатора:
|
NaBr и NaI – соли сильного основания и сильной кислоты, при смешивании с концентрированной ортофосфорной кислотой, раствор переходит в кислую среду, поэтому цвет индикатора бардовый.
|
Вывод
|
Объясните, почему в опытах используется не серная кислота (как при получении хлороводорода), а ортофосфорная.
|
При получении HBr и HI, обладающих сильными восстановительными свойствами, используют нелетучие кислоты - неокислители (ортофосфорная). А серная кислота – сильный окислитель, поэтому вместо HBr и HI, выделятся Br2 и I2. Концентрированная серная кислота не окисляет соляную кислоту, но окисляет бромоводородную и йодоводородную кислоты:
6HСl + H2SO4 ≠
6HBr + H2SO4 = 3Br2 + S↓ + 4H2O
HI + H2SO4 = 3I2 + H2S↑ + 4H2O
|
Опыт 5. Сравнение восстановительной активности галогенидов
а) Восстановление серной кислоты галогенидами
NaCl (к) + H2SO4 (конц.) →
|
Закончите уравнение реакции, расставьте коэффициенты.
|
2NaCl (к) + H2SO4 (конц.) →2HCl↑ +Na2SO4
|
Наблюдение:
|
При добавлении к соли NaCl концентрированной серной кислоты образовался газ белого цвета.
|
NaBr (к) + H2SO4 (конц.) →
|
|
Закончите уравнение реакции, уравняйте методом полуреакций:
|
|
2NaBr (к) + 2H2SO4 (конц.) → Br2 + SO2 + Na2SO4 + 2H2O
|
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2Br-1 + H2O -2e→ Br20 + 2H+
|
1
|
1,065
|
SO42- + 4H+ + 2e→ SO2 + 2H2O
|
1
|
0,17
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0= 0,17-1,065 = -0,895, отсюда следует, что E0 ˂ 0, значит окислительно-восстановительная реакция термодинамически невозможна.
|
Суммарное ионно-молекулярное уравнение реакции:
|
2Br- + SO42- + 2H+ → Br20 + SO2+ 2H2O
|
Молекулярное уравнение реакции с коэффициентами:
|
2NaBr (к) + 2H2SO4 (конц.) → Br2+SO2+Na2SO4+2H2O
|
Наблюдение:
|
При добавлении к соли NaBr концентрированной серной кислоты образовался газ бурого цвета.
|
NaI (к) + H2SO4 (конц.) →
|
|
Закончите уравнение реакции, уравняйте методом полуреакций:
|
|
8NaI + 5H2SO4(конц) → 4I2 + H2S + 4Na2SO4 + 4H2O
|
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2I-1 + H2O -2e→ I20 + 2H+
|
4
|
+0,535
|
SO4-2 + 8H+ +8e→ S-2 + 4H2O
|
1
|
+0,149
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0= 0,149-0.535 = -0,386, отсюда следует, что E0 ˂ 0, значит окислительно-восстановительная реакция термодинамически невозможна.
|
Суммарное ионно-молекулярное уравнение реакции:
|
8I-1 + SO4-2 → 4I20 + S-2
|
Молекулярное уравнение реакции с коэффициентами:
|
8NaI + 5H2SO4(конц) → 4I2 + H2S + 4Na2SO4 + 4H2O
|
Наблюдение:
|
При добавлении к соли NaI концентрированной серной кислоты образовался газ фиолетового цвета.
Вывод:
Причина различия в характере взаимодействия однотипных соединений – галогенидов металлов с концентрированной серной кислотой заключается в увеличении их восстановительных свойств от Cl→Br→I. В первой реакции хлор не восстанавливается и образуется HCl, а Br и I, с большей восстановительной способностью, чем у хлора, восстанавливаются до Br2 и I2.
|
б) Восстановление хлорида железа (III)
FeCl3 + ... →
|
Закончите уравнение возможной реакции, уравняйте её методом полуреакций:
|
2FeCl3 + 2KI + H2SO4 → 2FeCl2 + I2 + K2SO4 + 2HCl
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
2Fe+3 + 2H+ +2e→ 2Fe+2 + H2O
|
1
|
+0,771
|
2I-1 + H2O -2e→ I20 + 2H+
|
1
|
+0,535
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0 = 0,771 - 0,535 = 0,236, отсюда следует, что E0 > 0, значит окислительно-восстановительная реакция термодинамически возможна.
|
Суммарное уравнение
двух полуреакций:
|
2Fe+3 + 2I-1 → 2Fe+2 + I20
|
Уравнение реакции
с указанием коэффициентов:
|
2FeCl3 + 2KI + H2SO4 → 2FeCl2 + I2 + K2SO4 + 2HCl
|
Наблюдение:
|
Происходит изменение окраски раствора из жёлтого в красно-бурый при взаимодействии FeCl3 + H2SO4 (разб.) + KI
|
Вывод
|
|
Сформулируйте закономерность в изменении восстановительных свойств галогенидов.
|
|
Усиление окислительных свойств галогенов происходит от I2 → Br2 → Cl2 → F2
|
|
Опыт 6. Исследование свойств хлората калия
а) Взаимодействие сахара с бертолетовой солью
|
Закончите уравнение реакции:
|
C12H22O11 + 8KClO3 = 8KCl + 12CO2 + 11H2O
|
Укажите роль серной кислоты в реакции:
|
В присутствии концентрированной серной кислоты диспропорционирование KClO3 протекает с образованием диоксида хлора
6KClO3 + 3H2SO4 = 2HClO4 + 4ClO2 + 3K2SO4 + 2H2O
ClO2 – это сильный и очень энергичный окислитель. Диоксид хлора будет инициировать реакцию между хлоратом и сахаром.
|
Опишите наблюдения:
|
Взаимодействие сахара и бертолетовой соли протекает бурно, смесь воспламеняется и горит с образованием большого количества газов, окрашенных солями калия в фиолетовый цвет. Одновременно происходит обугливание сахара.
|
б) Диспропорционирование KClO3 при нагревании в присутствии катализатора
|
Закончите уравнение реакции, расставьте коэффициенты:
|
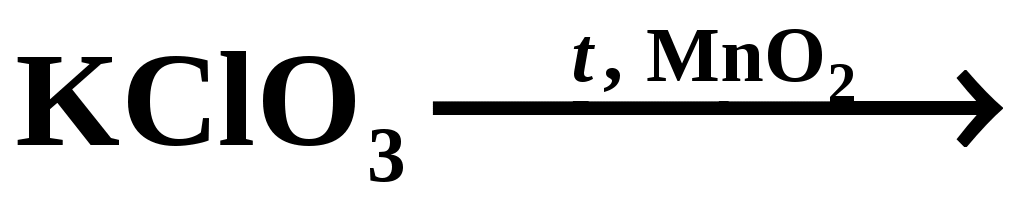
|
2KCl + 3O2
|
Укажите роль оксида марганца (IV) в реакции:
|
Препятствует разложению по реакции 4KClO3 = 3KClO4 +KCl
|
Объясните причину вспыхивания тлеющей лучины:
|
Наличие кислорода
|
Опишите наблюдения:
|
Пробирку с содержимым (хлорат калия и MnO2) нагрели на спиртовке, смесь приобрела серый цвет, наблюдалось бурное разложение хлората. После преподнесли к пробирке в тлеющую лучину, которая моментально загорелась от выделяемого кислорода.
|
в) Взаимодействие KClO3 c йодидом калия
|
Закончите уравнение реакции, уравняйте её методом полуреакций:
|
KClO3 + 6KI + 3H2SO4→ 3K2SO4 + KCl + 3I2 + 3H2O
|
Уравнения полуреакций
|
Коэффициенты
|
Значение E°, В
|
ClO3-1 + 6H+ +6e→ Cl-1 + 3H2O
|
1
|
+1,45
|
2I-1 + H2O -2e→ I20 + 2H+
|
3
|
+0,535
|
|
|
|
Вывод о термодинамической возможности протекания реакции:
|
E0 = 1,45 - 0,535 = 0,915, отсюда следует, что E0 > 0, значит окислительно-восстановительная реакция термодинамически возможна.
|
Суммарное ионно-молекулярное уравнение реакции:
|
ClO3-1 + 6I-1 → Cl-1 + 3I20
|
Молекулярное уравнение реакции с коэффициентами:
|
KClO3 + 6KI + 3H2SO4→ 3K2SO4 + KCl + 3I2 + 3H2O
|
Наблюдение:
|
При смешивании йодида калия, хлората калия и серной кислоты наблюдалось окрашивание раствора в бурый цвет (выделение I2).
|
|
 Скачать 215 Kb.
Скачать 215 Kb.