лаб 3. Отчет по лабораторной работе Определение теплоты реакции нейтрализации
 Скачать 18.81 Kb. Скачать 18.81 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования Иркутский НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ технический университет Институт Заочно-вечернего обучения Отчет по лабораторной работе «Определение теплоты реакции нейтрализации» по дисциплине «Химия» 8 Вариант Выполнил Студент группы: ЭПбз - 21 - 1 ___________ А.Е. Андреев Проверил преподаватель дисциплины: ___________ Ю.Н. Пожидаев Иркутск 2022 г. Лабораторная работаОпределение теплоты реакции нейтрализации Выполнение работыЛюбая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О. Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов – внешнего и внутреннего. Работу следует выполнять в следующем порядке. В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В отдельный сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру раствора и, не вынимая термометр из калориметра, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной. Требования к результатам работы Исходные данные и результаты расчетов занести в таблицу 1. Таблица 1 Данные опыта и результаты расчетов
1. Вычислить изменение энтальпии реакции ∆Н по формуле: ΔH = −V ∙ ρ ∙ c ∙ ΔТ=50*1*4,18*5,35=1,12кДж где V – общий объем раствора, мл; ρ – плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость раствора − равной теплоемкости воды, т.е. 4,18 Дж/(г∙К). 2. Вычислить тепловой эффект реакции нейтрализации ∆Н°нейтр.(практ.) в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л раствора (концентрация равна 1 н.), а для реакции было взято 25 мл, то  = =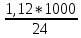 =44,8кДж =44,8кДж3. Используя следствие из закона Гесса, рассчитать теоретическое значение изменения энтальпии реакции нейтрализации ∆Н°нейтр.(теор.) для уравнения реакции: Н+ + ОН‾ → Н2О. соответственно равны 0; -230,2 и -285,8 кДж/моль. Таблица 2 Стандартные энтальпии образования ∆Н°298
4. Рассчитать относительную ошибку опыта Е (%): 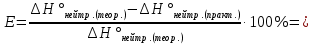 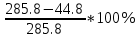 =84.3 =84.3 | ||||||||||||||||||||||
