Лабораторная работа по химии ПГУПС 1 курс. лабораторная работа №1. Отчет по лабораторной работе Скорость химических реакций
 Скачать 20.64 Kb. Скачать 20.64 Kb.
|
|
______________________________________________________________________________________ ФЕДЕРАЛЬНОЕ АГЕНТСТВО ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА Федеральное государственное бюджетное образовательное учреждение высшего образования «петербургский государственный университет путей сообщения ИМПЕРАТОРА АЛЕКСАНДРА I» Кафедра «Инженерная химия и естествознание» ОТЧЕТ по лабораторной работе «Скорость химических реакций» Вариант № 10
Санкт-Петербург – 2021 Цель работы: Определить зависимость скорости химических реакций от концентрации веществ. Основные теоретические положения: Явление опалесценции, является аналитическим сигналом регистрирующим окончание реакции. Опалесценция- рассеивание света коллоидной системой, в которой показатель преломления частиц дисперсной фазы заметно отличается от показателя преломления дисперсионной среды. Рассеянный свет распространяется во всех направлениях, причем его интенсивность в различных направлениях неодинакова и зависит от соотношения между размерами рассеивающих частиц и длиной световой волны, а также от разности показателей преломления частиц и среды. Ход работы: Проведем опыт реакции между раствором тиосульфата натрия и серной кислотой, в результате которой выпадающая сера дает опалесценцию. 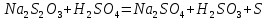 Приготовим 3 раствора тиосульфата натрия 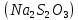 разной концентрации. разной концентрации. В три пробирки внесем соответственно следующее количество капель раствора 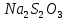 : в первую – 4, во вторую – 8, в третью – 12. : в первую – 4, во вторую – 8, в третью – 12. В первую и во вторую пробирку добавим 8 и 4 капли воды соответственно и перемешаем. В каждый раствор добавим по две капли 2Н раствора 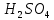 . .После добавления последней капли включаем секундомер, и наблюдаем появление опалесценции (выпадение светло-желтого осадка). При появлении опалесценции включаем секундомер. Результаты измерений запишем в таблице.
Выводы: Скорость реакции зависит от концентрации реагента по закону действующих масс: V=k*C ( 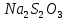 ) )Порядок реакции по реагенту 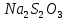 равен 1 (показатель степени в уравнении скорости химической реакции) равен 1 (показатель степени в уравнении скорости химической реакции) | |||||||||||||||||||||||||||||||||||||
