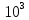Отчет по лабораторной работе
 Скачать 116.68 Kb. Скачать 116.68 Kb.
|
|
Федеральное государственное автономное образовательное учреждение высшего образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» Институт цветных металлов и материаловедения Кафедра аналитической и органической химии ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ Спектрофотометрический анализ однокомпонентных систем методом абсолютной фотометрии. Определение железа.
Красноярск 2018 Федеральное государственное автономное образовательное учреждение высшего образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» Институт цветных металлов и материаловедения Кафедра аналитической и органической химии ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ Спектрофотометрический анализ однокомпонентных систем методом абсолютной фотометрии. Определение железа.
Красноярск 2018 ЛИТЕРАТУРНАЯ ЧАСТЬ Сущность спектрофотометрии Спектрофотометрия – метод исследования и анализа, основанный на измерении спектров поглощения в оптической области электромагнитного излучения. Спектрофотометрия широко применяется для исследования органических и неорганических веществ, для качественного и количественного определения различных веществ, для контроля технологических процессов и окружающей среды. Спектры возникают при переходе системы из одного стационарного состояния в другое. При этом система поглощает или испускает энергию в виде кванта, величина которого равна разности энергии двух состояний: hν = E2 – E1 где h – постоянная Планка; ν – частота кванта света. Вместо частоты ν используют волновое число ω = ν/с = 1/λ, где с – скорость света; λ – длина волны. Волновое число ω также называют частотой. Тогда частота спектральных линий определяется по формуле: ω = (Е2 – Е1)/сh В свою очередь, энергетическое состояние определяется свойствами электронных оболочек атомов и молекул, колебаниями атомных ядер в молекулах и вращением молекул. Различают спектроскопию в инфракрасной (ИК), видимой и ультрафиолетовой (УФ) областях спектра. Закон Бугера-Ламберта-Бера: каждая молекула (ион) растворённого вещества поглощает одинаковую часть монохроматического излучения; интенсивность излучения после прохождения слоя раствора уменьшается экспоненциально с увеличением концентрации растворённого вещества, а оптическая плотность линейно увеличивается с ростом концентрации. Этот закон объединяет два более простых закона: закон Бугера-Ламберта и закон Бера. Закон Бугера-Ламберта: говорит о том, что каждый слой однородного вещества поглощает равную долю падающего на него монохроматического излучения. Закон Бера: устанавливает связь между поглощением и концентрацией: поглощение монохроматического излучения прямо пропорционально концентрации поглощающего вещества. Математическое описание спектрофотометрического метода Введем понятие коэффициента пропускания Т. I – интенсивность световой энергии, прошедшей через взвесь, I0 – через раствор. Для определения концентрации искомых веществ, спектрофотометры используют оптическую плотность, которая находится как D=-lоg10(T). Количественно отыскивается концентрация посредством закона БЛБ: I=I010-εlc С помощью элементарных преобразований легко можно получить, что lоg10(T)=εlc или D= εlc. Обозначения переменных представлены ниже в ограничениях данного закона. Если в раствор вводят несколько исследуемых элементов, то метод применим и в этом случае. Каждый элемент будет давать свой вклад в общую оптическую плотность по закону сложения: D=D1+D2+…+Dk. Закон Бугера Ламберта Бера определяет, что оптическая плотность, линейно связана с концентрацией, а ее график выходит из начала координат. В реальности линейность не всегда наблюдается. Техническая часть спектрофотометрического метода Спектрофотометрическое исследование требовательно относится к подготовке растворов, как окрашенных, так и чистых. Для того чтобы производить измерения спектров, используют спектрофотометр и фотоколориметр, в которые помещают исследуемые растворы. Основные части спектрофотометра: источник излучения, монохроматор (если источник света не может дать монохроматический луч), кювета, в которую размещаются растворы и взвеси, измерительный прибор. 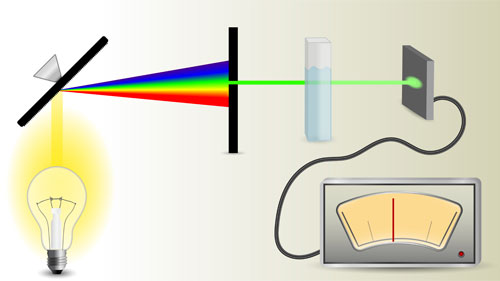 Рис. 1 Основные законы светопоглащения Ослабление мощности монохроматического потока излучения при прохождении через слой раствора поглощающего вещества. Описывается : 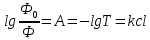 где Ф0 и Ф – мощность потоков монохроматического излучения, падающего на слой раствора и вышедшего из него; А – оптическая плотность; Т – пропускание; 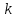 – коэффициент поглощения вещества; – коэффициент поглощения вещества; 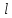 – толщина слоя; – толщина слоя; 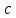 – концентрация поглощающего вещества в растворе. – концентрация поглощающего вещества в растворе.Важным дополнением к основному закону светопоглощения является закон аддитивности оптических плотностей. В соответветствии с этим законом оптическая плотность смеси веществ, подчиняющихся основному закону светопоглощения и не вступающих в химические реакции друг с другом, равна сумме парциальных оптических плотностей, отвечающих поглощению каждого вещества в отдельности. Способы определения веществ методом абсорбционной молекулярной спектроскопии В прямых способах вещество определяют либо непосредственно по величине его светопоглощения, либо с помощью подходящей фотометрической реакции это вещество переводят в светопоглощающее соединение, затем фотометрируют. При косвенных определениях измеряют светопоглащение вспомогательных веществ, которые при взаимодействии с определяемым веществом (в этом случае содержание определяемого вещества находят по уменьшению светопоглощения вспомогательного соединения):  либо образуют новое светопоглощающие вещества: 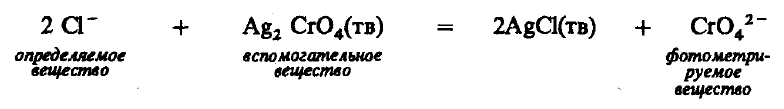 Фотометрические реакции проводят в условиях, обеспечивающих полноту превращения определяемого вещества. Важнейшими из них являются: рН раствора, концентрация реагентов, время реакции, температура. Фотометрируемые растворы должны быть истинными во всём диапозоне определяемых концентраций. В тех случаях, когда это условие не выполняется, либо переходят в область более низких концентраций, либо используют защитные коллоиды, препятствующие образованию твёрдых фаз. Малорастворимые фотометрируемые соединения можно экстрагировать не смешивающимися с водой органическими растворителями. ПРАКТИЧЕСКАЯ ЧАСТЬ Определение железа (III) сульфосалициловой кислотой Железа (III) образует с сульфосалициловой кислотой в зависимости от кислотности раствора ряд окрашенных комлексов. При рН 1,8 – 2,5 образуются красно – фиолетовые катионовые комплексы (I), имеющий полосу поглощения с λmax=510 нм и εmax=1,8·103 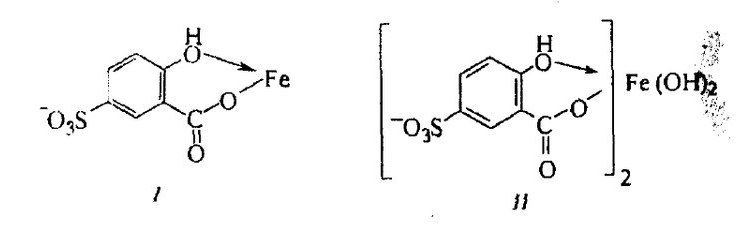 При увеличении рН до 4 – 8 раствор приобретает красно – бурую окраску, которую приписывают анионному бис – комплексу (II). В щелочных средах (9 < рН < 11,5) образуется комплекс желтого цвета с полосой поглощения λmax=416 нм и εmax=5,8·103. При рН > 12 происходит его разложение с выпадением в осадок гидроксида железа. Предполагается, что его образование комплекса связанно не с присоединением третьей молекулы реагента, а с депротонированием бис- комплекса: 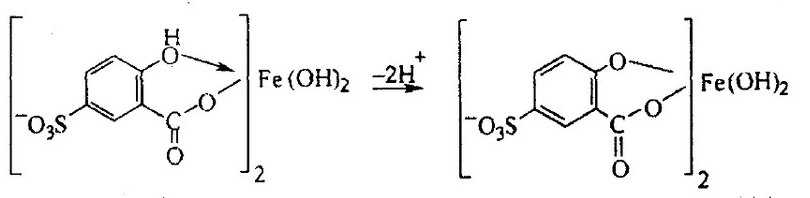 В результате упрочнения связи атома железа с фенольным кислородом происходит сдвиг полосы поглощения бис- комплекса в коротковолновую область спектра. В практике молекулярного абсорбционного анализа применяются лишь комплексы, образующиеся в кисло и щелочной средах. Моносульфосалицилатный комплекс используют для определения Fe (III) в присутствии Fe (II), магния, марганца, меди, аюминия, редкоземельных элементов. Фториды мешают определению Fe (III). В щелочной среде вследствие лёгкой окисляемости Fe (II) в Fe (III) с помощью сульфосалициловой кислоты можно определить сумму Fe (II) и Fe (III). Фторид – ионы не мешают определению железа сульфосалициловой кислотой в щелочной среде. Реагенты Стандартный раствор Fe (III), 0,1 мг/мл. Сульфосалициловая кислота, 10%-ный раствор. Серная кислота, 1М раствор. Аммиак, 10%-ный раствор. Выполнение определения. Кислая среда В пять мерных колб вместимостью 50,0 мл вводят стандартный раствор железа с содержанием (мг): 0,05; 0,10; 0,15;0,20 и 0,30 соответственно, 10 мл воды, 1 мл раствора серной кислоты, 5 мл раствора сульфосалициловой кислоты. Содержимое колб разбавляют водой до метки. Растворы фотометрируют относительно воды и строят градуировочный график. Для определения железа в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл. С растором проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для градуировки, а затем фотометрируют относительно воды. Содержание железа определяют по градуировочному графику, построенному по результатам фотометрирования растворов сравнения. Щелочная среда В пять мерных колб вместимостью 50,0 мл вводят стандартный раствор железа с содержанием (мг): 0,05; 0,10; 0,15;0,20 и 0,30 соответственно, 10 мл воды, 1 мл раствора серной кислоты, 5 мл раствора сульфосалициловой кислоты, 5 мл раствора аммиака. Содержимое колб разбавляют водой до метки. Растворы фотометрируют относительно воды и строят градуировочный график. Для определения железа в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл. С растором проводят те же операции и в той же последовательности, что и при приготовлении растворов, используемых для градуировки, а затем фотометрируют относительно воды. Содержание железа определяют по градуировочному графику. РАСЧЕТЫ Таблица 1. Измерение оптической плотности при разных концентрациях Fe(III) в кислой среде
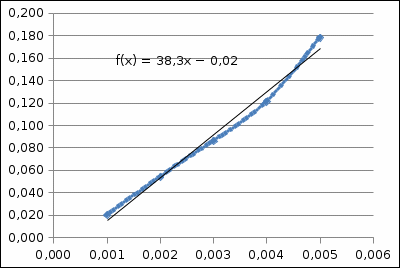 График 1. Градуировочный график для определения ионов Fe(III) в кислой среде. A=0,168 C=0,005моль/л 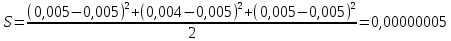 A=0,130 C=0,004моль/л 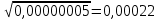 A=0,168 C=0,005моль/л 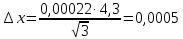 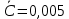 моль/л моль/л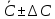 =0,005моль/л0,0005 =0,005моль/л0,0005Итого: концентрация Fe(III) в кислой среде 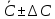 =0,005моль/л0,0005 =0,005моль/л0,0005Таблица 2. Измерение оптической плотности при разных концентрациях Fe(III) в щелочной среде
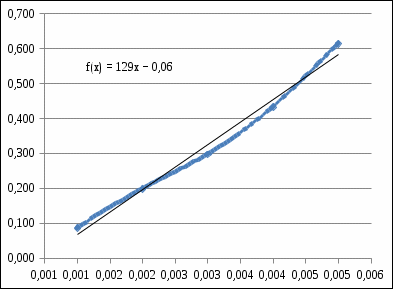 График 2. Градуировочный график для определения ионов Fe(III) в щелочной среде. А=0,087 С=0,0012моль/л 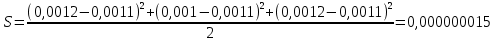 А=0,067 С=0,0010моль/л 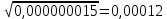 А=0,093 С=0,0012моль/л 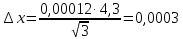 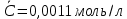 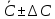 =0,0011моль/л0,0003 =0,0011моль/л0,0003Итого: концентрация Fe(III) в щелочной среде 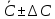 =0,0011моль/л0,0003 =0,0011моль/л0,0003Вывод: в данной лабораторной работе, был изучен метод определения железа (III) сульфосалициловой кислотой. Концентрация железа (III) в кислой среде составила 0,005моль/л0,0005, а в щелочной 0,0011моль/л0,0003. |