контрольная. Биохимия, 8 вар.. Ответ Доказательства белковой природы ферментов
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
|
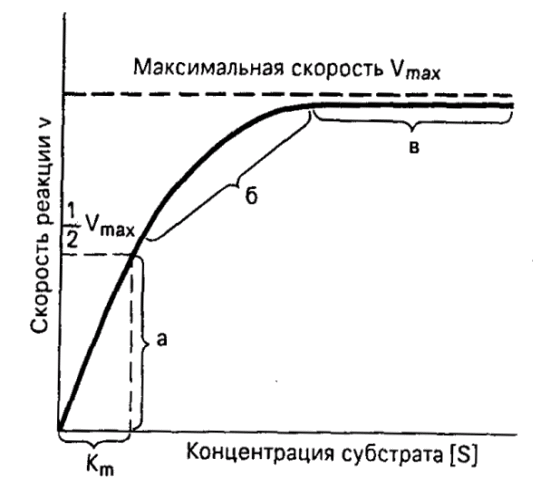
Химическая природа ферментов. Активные центры. Ответ: Доказательства белковой природы ферментов: 1. Ферменты при гидролизе распадаются на аминокислоты. 2. Под действием кипячения и др. факторов ферменты подвергаются денатурации и теряют каталитическую активность. 3. Осуществлено выделение ферментов в форме кристаллов белка. 4. Ферменты оказывают высокоспецифическое действие. Прямым доказательством белковой природы ферментов является лабораторный синтез первого фермента – рибонуклеазы. Выделяют простые ферменты, состоящие только из полипептидной цепи: пепсин, трипсин, уреаза, рибонуклеаза, фосфатаза и др. Большинство природных ферментов - сложные белки. Их небелковые компоненты называются кофакторами и необходимы для выполнения ферментом его каталитической роли. Кофакторами ферментов являются витамины или соединения, построенные с их участием (коэнзим А, НАД+, ФАД); фосфорные эфиры некоторых моносахаридов, ионы металов. Кофермент - небелковый фактор, который легко отделяется от белковой части - апофермента при диссоциации. Простетическая группа – ковалентно связанный с белковой цепью небелковый компонент, который не отделяется при выделении и очистке фермента. Весь фермент вместе с простетической группой назыывают холоферментом. Только объединение апофермента и кофермента обеспечивает активность холофермента. Субстрат – вещество, подвергающееся превращениям под действием фермента. Активный центр - специфический участок на поверхности фермента, связывающийся с молекулой субстрата и непосредственно участвующий в катализе. Активные центры ферментов образуются на уровне третичной структуры. У сложных ферментов в состав активного центра входят также простетические группы. Кофакторы ферментов выполняют роль промежуточных переносчиков атомов или групп. В активном центре различают два участка. Субстратный (связывающий) центр - участок, отвечающий за присоединение субстрата. Его называют контактной, или «якорной» площадкой фермента. Каталитический центр отвечает за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие аминокислоты, как серин, цистеин, гистидин, тирозин, лизин. Субстратный центр может совпадать (или перекрываться) с каталитическим центром. Аллостерический центр - участок молекулы фермента вне его активного центра, который способен связываться с тем или иным веществом (лигандом). В результате изменяется третичная, а часто и четвертичная структура белковой молекулы. Как следствие изменяется конфигурация активного центра и каталитическая активность фермента. Это т. н. аллостерическая регуляция активности ферментов. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, называют аллостерическими. Некоторые из ферментов являются полифункциональными, т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Их белковая цепь образует несколько доменов, каждый из которых характеризуется своей каталитической активностью. Например, алкогольдегидрогеназа не только катализирует реакцию окисления спиртов, но также реакции обезвреживания ряда ксенобиотиков. Изоферменты - это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам - сродству к субстрату, активности, электрофоретической подвижности. Например, фермент лактатдегидрогеназа катализирует обратимое превращение пировиноградной кислоты в молочную. Она состоит из 4 субъединиц и содержит два типа полипептидных цепей: Н- сердечный тип (от англ. heart- сердце) и М - мышечный тип (от англ. muscle- мышца). Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах: 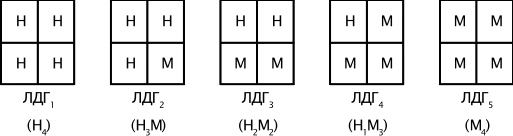 Для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ. Например, в сердечной мышце преобладает Н4, т.е. ЛДГ1, а в скелетных мышцах и печени – М4 (ЛДГ5). Изучение появления изоферментов ЛДГ в сыворотке крови позволяет судить о месте патологического процесса и о степени поражения органа или ткани. Особую группу ферментов составляют мультимолекулярные ферментные комплексы. Существование таких комплексов ускоряет химические превращения. Если мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном. Таковы метаболоны гликолиза, цикла Кребса, дыхательная цепь митохондрий и др. Механизм ферментативного катализа Ответ: Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температура, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции (V) измеряют по убыли количества субстрата или приросту продукта за единицу времени. При ферментном катализе фермент (Е) обратимо соединяется с субстратом (S), образуя нестойкий фермент-субстратный комплекс (ES), который в конце реакции распадается с освобождением фермента (Е) и продуктов реакции (Р): 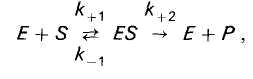 Важная особенность ферментативных реакций – насыщение фермента субстратом. При низкой концентрации субстрата скорость реакции прямо пропорциональна его концентрации. При высокой - скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [S] и целиком определяется концентрацией фермента (рис. 1).
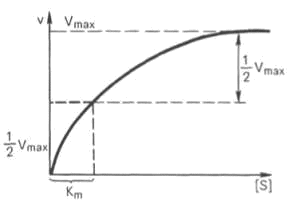
KS – константа диссоциации фермент-субстратного комплекса ES, обратна константе равновесия: 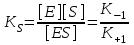 Чем меньше значение KS, тем выше сродство фермента к субстрату. Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражает уравнение Михаэлиса-Ментен: 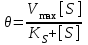 , , - скорость реакции, Vmax - максимальная скорость ферментативной реакции. Бриггс и Холдейн усовершенствовали уравнение, введя в него константу Михаэлиса KM, определяемую экспериментально. Уравнение Бриггса – Холдейна: 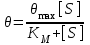 Константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость ферментативной реакции составляет половину от максимальной (рис. 2). Кm показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство. Экспериментальные значения Кm для большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М. Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции.
Строение нуклеиновых кислот, их биологическая роль в живой клетке Ответ: Существует два типа нуклеиновых кислот — дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Мономерами в нуклеиновых кислотах служат нуклеотиды. Каждый из них содержит азотистое основание, пятиуглеродный сахар (дезоксирибоза — в ДНК, рибоза — в РНК) и остаток фосфорной кислоты. В ДНК входят четыре вида нуклеотидов, отличающихся по азотистому основанию в их составе, — аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т). В молекуле РНК также имеется 4 вида нуклеотидов с одним из азотистых оснований — аденином, гуанином, цитозином и урацилом (У). Таким образом, ДНК и РНК различаются как по содержанию сахара в нуклеотидах, так и по одному из азотистых оснований
Молекулы ДНК и РНК существенно различаются по своему строению и выполняемым функциям. Молекула ДНК может включать огромное количество нуклеотидов — от нескольких тысяч до сотен миллионов (поистине гигантские молекулы ДНК удается «увидеть» с помощью электронного микроскопа). В структурном отношении она представляет собой двойную спираль из полинуклеотидных цепей, соединенных с помощью водородных связей между азотистыми основаниями нуклеотидов. Благодаря этому полинуклеотидные цепи прочно удерживаются одна возле другой. При исследовании различных ДНК (у разных видов организмов) было установлено, что аденин одной цепи может связываться лишь с тимином, а гуанин — только с цитозином другой. Следовательно, порядок расположения нуклеотидов в одной цепи строго соответствует порядку их расположения в другой. Этот феномен получил название комплементарности (т. е. дополнения), а противоположные полинуклеотидные цепи называются комплементарными. Именно этим обусловлено уникальное среди всех неорганических и органических веществ свойство ДНК — способность к самовоспроизведению или удвоению. При этом сначала комплементарные цепи молекул ДНК расходятся (под воздействием специального фермента происходит разрушение связей между комплементарными нуклеотидами двух цепей). Затем на каждой цепи начинается синтез новой («недостающей») комплементарной ей цепи за счет свободных нуклеотидов, всегда имеющихся в большом количестве в клетке. В результате вместо одной («материнской») молекулы ДНК образуются две («дочерние») новые, идентичные по структуре и составу друг другу, а также исходной молекуле ДНК. Этот процесс всегда предшествует клеточному делению и обеспечивает передачу наследственной информации от материнской клетки дочерним и всем последующим. РНК - класс нуклеиновых кислот, линейных полимеров нуклеотидов, в состав которых входят остаток фосфорной кислоты, рибоза (в отличие от ДНК, содержащей дезоксирибозу) и азотистые основания - аденин, цитозин, гуанин и урацил (в отличие от ДНК, содержащий вместо урацила тимин). Эти молекулы содержатся в клетках всех живых организмов, а также в некоторых вирусов. РНК содержатся главным образом в цитоплазме клеток. Эти молекулы синтезируются в клетках всех клеточных живых организмов, а также содержатся в вироидах и некоторых вирусах. Основные функции РНК в клеточных организмах - это шаблон для трансляции генетической информации в белки и поставка соответствующих аминокислот к рибосомам. В вирусах является носителем генетической информации (кодирует белки оболочки и ферменты вирусов). Структура РНК. Молекула имеет однонитевое строение. Полимер. В результате взаимодействия нуклеотидов друг с другом молекула РНК приобретает вторичную структуру, различной формы (спираль, глобула и т.д.). Мономером РНК является нуклеотид (молекула, в состав которой входит азотистое основание, остаток фосфорной кислоты и сахар (пептоза)). РНК напоминает по своему строению одну цепь ДНК. Нуклеотиды, входящие в состав РНК: гуанин, аденин, цитозин, урацил. Аденин и гуанин относятся к пуриновым основаниям, цитозин и урацил к пиримидиновым. В отличие от молекулы ДНК, в качестве углеводного компонента рибонуклеиновой кислоты выступает не дезоксирибоза, а рибоза. Вторым существенным отличием в химическом строении РНК от ДНК является отсутствие в молекуле рибонуклеиновой кислоты такого нуклеотида как тимин. В РНК он заменён на урацил. Виды и типы РНК клеток. Существуют три типа РНК, каждый из которых выполняет свою особую роль в синтезе белка. 1. Матричная РНК переносит генетический код из ядра в цитоплазму, определяя таким образом синтез разнообразных белков. 2. Транспортная РНК переносит активированные аминокислоты к рибосомам для синтеза полипептидных молекул. 3. Рибосомная РНК в комплексе примерно с 75 разными белками формирует рибосомы — клеточные органеллы, на которых происходит сборка полипептидных молекул. Матричная РНК представляет собой длинную одноцепочечную молекулу, присутствующую в цитоплазме. Эта молекула РНК содержит от нескольких сотен до нескольких тысяч нуклеотидов РНК, образующих кодоны, строго комплементарные триплетам ДНК. Еще один тип РНК, играющий важнейшую роль в синтезе белка, называют транспортной РНК, поскольку он транспортирует аминокислоты к строящейся молекуле белка. Каждая транспортная РНК специфически связывается только с одной из 20 аминокислот, составляющих белковые молекулы. Транспортные РНК действуют как переносчики специфических аминокислот, доставляя их к рибосомам, на которых происходит сборка полипептидных молекул. Каждая специфическая транспортная РНК распознает «свой» кодон матричной РНК, прикрепившейся к рибосоме, и доставляет соответствующую аминокислоту на соответствующую позицию в синтезируемой полипептидной цепи. Цепь транспортной РНК гораздо короче матричной РНК, содержит всего около 80 нуклеотидов и упакована в форме клеверного листа. На одном конце транспортной РНК всегда находится аденозинмонофосфат (АМФ), к которому через гидроксильную группу рибозы прикрепляется транспортируемая аминокислота. Транспортные РНК служат для прикрепления специфических аминокислот к строящейся полипептидной молекуле, поэтому необходимо, чтобы каждая транспортная РНК обладала специфичностью и в отношении соответствующих кодонов матричной РНК. Код, посредством которого транспортная РНК распознает соответствующий кодон на матричной РНК, также является триплетом и его называют антикодоном. Антикодон располагается примерно посередине молекулы транспортной РНК. Во время синтеза белка азотистые основания антикодона транспортной РНК прикрепляются с помощью водородных связей к азотистым основаниям кодона матричной РНК. Таким образом, на матричной РНК выстраиваются в определенном порядке одна за другой различные аминокислоты, формируя соответствующую аминокислотную последовательность синтезируемого белка. Цикл ди- и трикарбоновых кислот, его роль в метаболизме микробной клетки Ответ: Цикл Кребса – 10 последовательно протекающих реакций, начинающихся с вовлечения в процесс шавелевоуксусной кислоты и заканчивающихся высвобождением ее. Цикл трикарбоновых кислот(ЦТК) или цикл лимонной кислоты или цикл Кребса–путь окислительных превращений ди- и трикарбоновых кислот, образующихся в качестве промежуточных продуктов при распаде и синтезе белков, жиров и углеводов. Цикл трикарбоновых кислот представлен в клетках всех организмов: растений, животных и микроорганизмов. Этот цикл является основойметаболизма и выполняет две важных функции: -снабжения организма энергией; -интеграции всех главных метаболических потоков, как катаболических (биорасщепление), так и анаболических (биосинтез). 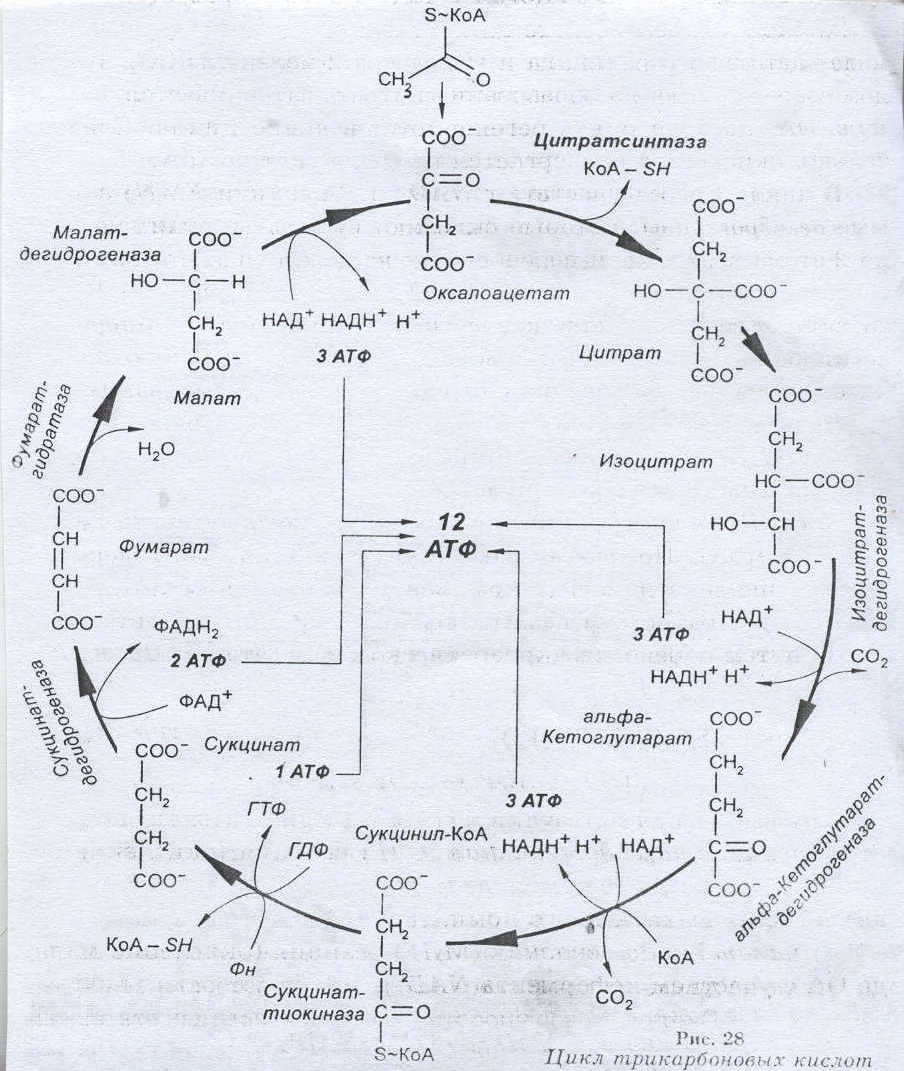 Биологическая роль цикла Кребса: 1. При расщеплении одной молекулы ацетил-КоА в цикле Кребса высвобождается 2 молекулы углекислого газа – в результате изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций. Первая из них сопряжена с прямым декарбоксилированием, вторая – окислительным. Углекислый газ в основном выделяется легкими, но он может участвовать в функционировании буферных систем крови. 2. В цикле Кребса восстанавливается 3 молекулы НАД и 1 молекула ФАД. Они переносят ионы водорода в дыхательную цепь митохондрий, где из них может генерироваться 11 молекул АТФ. НАД-Н2 генерируется в изоцитатдегидрогеназной, изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций атдегидрогеназной и малатдегидрогеназной реациях, ФАД-Н2 – в сукцинатдегидрогеназной реакции. Непосредственно цикле Кребса в результате реакции субстратного фосфорилирования, сукциниотиокиназной реакции, также может генерироваться одна молекула гуанозинтрифосфата (ГТФ), способная передавать энергию для синтеза АТФ. 3. Генерируемые в цикле Кребса ά-кетоглутаровая и щавелевоуксусная кислоты участвуют в реакциях переаминирования аминокислот. 4. В цикле Кребса окисляется сукцинил-КоА, образующийся в преджелудках жвачных животных в процессе расщепления микрофлорой клетчатки. Строение бактериальной клетки и функции клеточных структур Ответ: Бактерии (прокариоты) — это большая группа микроорганизмов (около 1600 видов), большинство из которых одноклеточные (рис. 1). Основные формы бактерий — шаровидная, палочковидная и извитая. Размеры бактерий очень малы: от десятых долей микрометра до нескольких микрометров. В среднем размер большинства бактерий 0,5-1 мкм, а средняя длина палочковидных бактерий — 2-5 мкм. Встречаются бактерии, размеры которых значительно превышают среднюю величину, а некоторые находятся на грани видимости в обычных оптических микроскопах. Масса бактериальной клетки составляет приблизительно 4-1013 г. Особенностью размножения бактерий является быстрота протекания процесса: некоторые виды делятся через каждые 15-20 мин, другие — через 5-10 ч. При таком делении число клеток бактерий за сутки достигает огромного количества. Это часто наблюдается на пищевых продуктах, например, быстрое скисание молока вследствие развития молочнокислых бактерий, быстрая порча мяса и рыбы за счет развития гнилостных бактерий. Другой отличительной характеристикой микроорганизмов является разнообразие их физиологических и биохимических свойств. Некоторые микроорганизмы могут расти в экстремальных условиях. Значительное число микроорганизмов могут жить при температуре — 196°С (температура жидкого азота). Другие виды микроорганизмов — термофильные, их рост наблюдается при температуре 80°С и выше. Многие микроорганизмы устойчивы к высокому гидростатическому давлению (в глубинах морей и океанов; месторождениях нефти). Также многие микроорганизмы сохраняют жизнедеятельность в условиях глубокого вакуума. Некоторые микроорганизмы выдерживают высокие дозы ультрафиолетовой или ионизирующей радиации. Основной (низшей) таксономической единицей является вид. Виды объединяются в роды, роды — в семейства, семейства— в порядки, порядки — в классы, классы — в отделы, отделы — в царства. Вид — это совокупность популяций, имеющих общее происхождение и генотип, морфологические, физиологические и другие признаки, способные в определенных условиях вызывать одинаковые процессы. Культура — микроорганизмы, полученные от животного, человека, растения или субстрата внешней среды и выращенные на питательной среде. Чистые культуры состоят из особей одного вида, смешанные представляют собой скопления клеток разных видов. 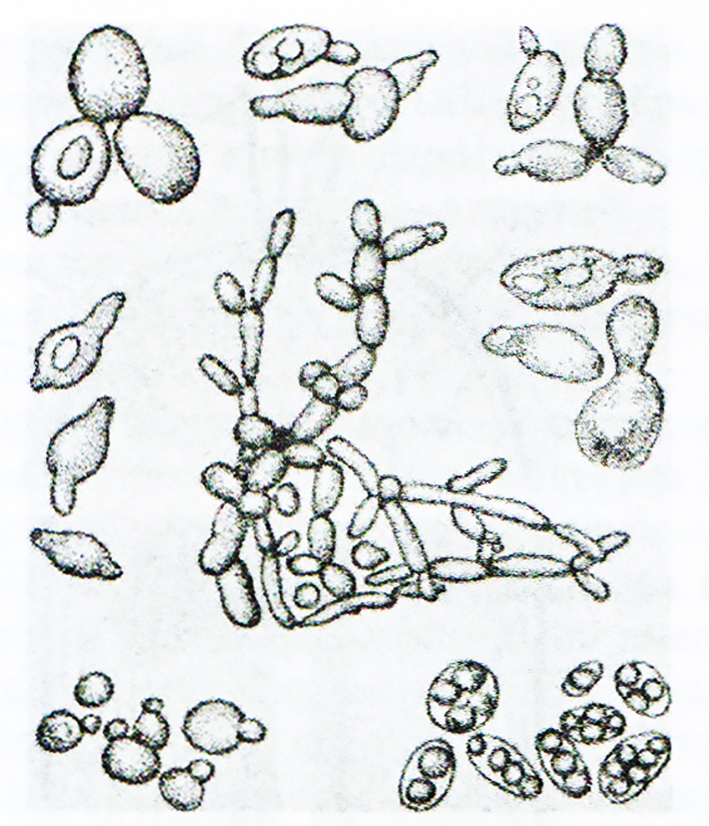 Рис. 1 - Разнообразие бактерий Штамм — это культура одного и того же вида, выделенная из разных сред и отличающаяся незначительными изменениями свойств: чувствительность к лекарственным препаратам, неодинаковая биохимическая активность и др. Например, кишечная палочка, выделенная от человека, и такая же палочка, выделенная от свиней, могут быть разными штаммами. Клон — культура микроорганизмов, выделенная из одной клетки. Клетка бактерии обладает принципиальными особенностями строения (см. рис. 2). 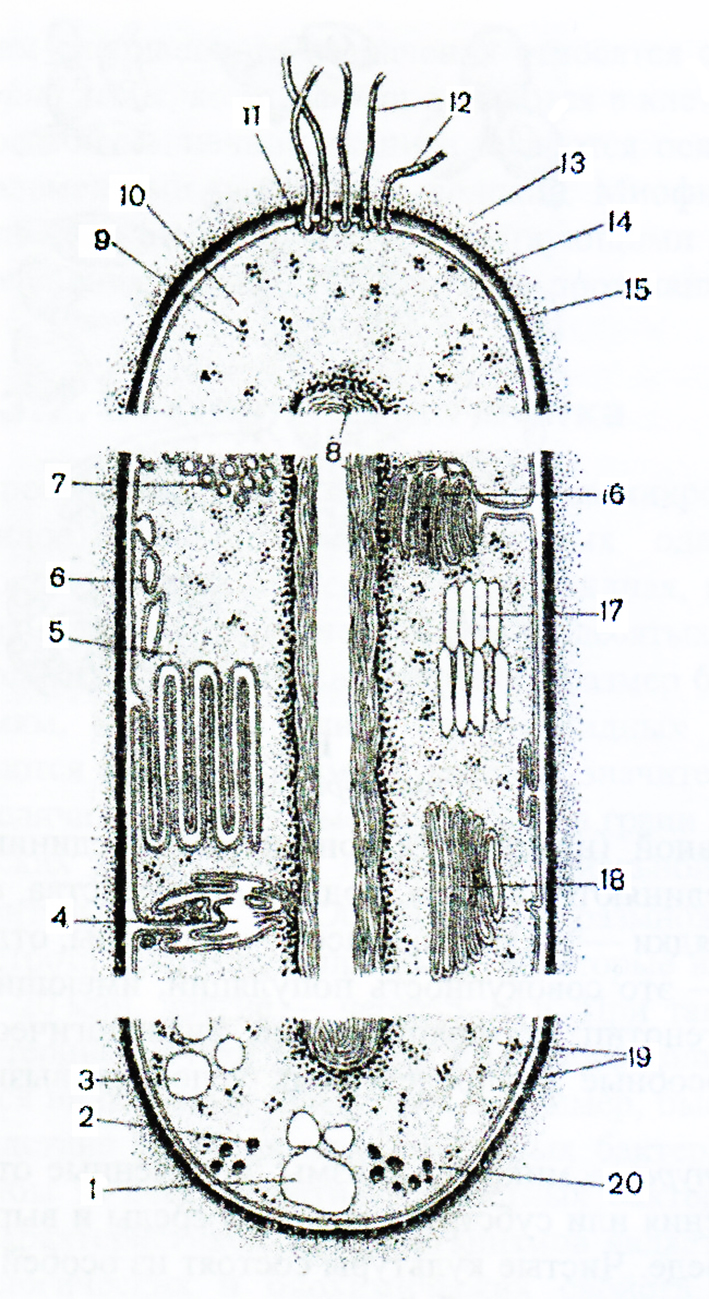 Рис. 2 - Схема строения бактериальной клетки: 1 ‒ гранулы поли-β-оксимасляной кислоты; 2 ‒ жировые капельки; 3 ‒ включения серы; 4 ‒ трубчатые тилакоиды; 5 ‒ пластинчатые тилакоиды; 6 ‒ пузырьки; 7 ‒ хроматофоры; 8 ‒ ядро (нуклеоид); 9 ‒ рибосомы; 10 ‒ цитоплазма; 11 ‒ базальное тельце; 12 — жгутики; 13 ‒ капсула; 14 ‒ клеточная стенка; 15 ‒ цитоплазматическая мембрана; 16 ‒ мезосома; 17 ‒ газовые вакуоли; 18 ‒ ламеллярные структуры; 19 ‒ гранулы полисахарида; 20 ‒ гранулы полифосфата. Основные структуры бактериальной клетки представлены в верхней части рисунка; дополнительные, мембранные структуры, имеющиеся у фототрофных и нефототрофных бактерий, ‒ в средней части; включения запасных веществ ‒ в нижней. Бактериальная клетка состоит из протопласта, окруженного наружной клеточной оболочкой, вакуолей, различных включений, имеющихся в составе протоплазмы. Функцию ядра у бактерий выполняет циркулярно замкнутая и сильно скрученная компактно уложенная молекула ДНК. Такое неограниченное мембраной ядро называют нуклеоидом, а в генетике ‒ геномом или хромосомой. Обычно в покоящихся бактериях содержится один нуклеоид. Разные формы бактерий имеет различный тип ядерного аппарата. У одних ядерное вещество находится в дисперсном состоянии обособленно от цитоплазмы. У других в протоплазме содержатся отдельные зерна хроматина, участвующие в образовании некоторых структур клетки. Химическая природа ядерных веществ довольно сложная. Основное место занимает нуклеопротеидный комплекс, который состоит из двух основных компонентов ‒ особого белка и тимонуклеиновой кислоты. Клеточная стенка (оболочка) ‒ важный структурный элемент большинства бактерий; плотная, бесцветная. На ее долю приходится от 5 до 20% сухих веществ клетки. Клеточная стенка обладает эластичностью, служит механическим барьером между протопластом и окружающей средой, придает клетке определенную форму. Оболочка проницаема для воды и низкомолекулярных веществ, имеет слоистое строение. Толщина клеточной стенки 10-35 нм. Химический состав оболочки неоднороден, резко отличен от оболочек высших растений. В ее состав входят специфические полимерные комплексы. Главным компонентом клеточной стенки бактерии является особый, только им присущий гетерополимер ‒ пептидогликан (муреин). Этот полимер состоит из параллельно чередующихся полисахаридных цепей, которые скреплены пептидными связями. Количественное содержание пептидогликана определяет характер окраски бактерий и других прокариот по Грамму. Те из них, которые содержат в клеточной стенке большое количество (около 90%) пептидогликана окрашиваются по Грамму в сине-фиолетовый цвет, и их называют грамположительными, все другие, содержащие в оболочке 5-20% пептидогликана, ‒ в розовый цвет, и их называют грамотрицательными. Толщина слоя пептидогликана в клеточной стенке грамположительных бактерий в несколько раз больше, чем у грамотрицательных. Из азотистых веществ в состав бактериальных оболочек входят белковые вещества, аминокислоты. Соотношение веществ варьирует. Оболочка у некоторых бактерий может подвергаться разбуханию и ослизнению. Слизистый слой бывает очень тонким, но может достигать и значительной толщины, образуя капсулу. Размер капсулы может превышать величину бактериальной клетки. Капсулы легко обнаруживаются при окраске фуксином. Капсула защищает клетку от механических повреждений и высыхания, создает дополнительный осмотический барьер, служит препятствием для проникновения фагов, антител, иногда она является источником запасных питательных веществ. Химический состав слизей различен у отдельных видов. В составе бактериальных слизей обнаружены полисахариды, азотсодержащие вещества. При попадании в неблагоприятные условия у многих бактерий усиливается слизеобразование. Ослизнению подвергаются мясо, колбасы, творог; наблюдается тягучесть молока, сахарного сиропа, рассолов, квашеных овощей, пива, вина. Цитоплазматическая мембрана толщиной 7-10 нм отделяет от клеточной стенки содержимое клетки. На ее долю приходится 8-15% сухого вещества клетки и 70-90% липидов клетки. Мембрана полупроницаема, играет важную роль в обмене веществ между клеткой и окружающей средой. Цитоплазматическая мембрана состоит из трех слоев: одного липидного и двух, примыкающих к нему с обеих сторон, белковых. Содержит 60-65% белка и 35-40% липидов, в ней локализованы ферменты. Цитоплазма бактериальной клетки представляет собой полужидкую, вязкую, коллоидную систему. Имеет сложный изменяющийся химический состав. Основными химическими соединениями являются белки, нуклеиновые кислоты, липиды, Н20. Местами цитоплазма пронизана мембранными структурами ‒ мезосомами, которые произошли от цитоплазматической мембраны и сохранили с ней связь. В мезосомах содержатся ферменты, участвующие в снабжении бактериальной клетки энергией. Рибосомы рассеяны в цитоплазме в виде гранул размером 20-30 нм. Они состоят примерно на 60% из РНК и на 40% из белка. Основная функция рибосом — синтез белка клетки. В бактериальной клетке в зависимости от ее возраста и условий жизни может быть 5- 50 тыс. рибосом. Цитоплазматические включения бактериальной клетки разнообразны, в основном это запасные питательные вещества, которые откладываются в клетках, развивающихся в условиях избытка питательных веществ, и потребляются, когда клетки попадают в условия голодания. В клетках откладываются полисахариды (гликоген, крахмалоподобное вещество гранулеза), липиды, полифосфаты, молекулярная сера. При хранении сырья и продуктов в охлажденном состоянии рост микроорганизмов на них не исключается, а лишь замедляется. Поэтому сроки хранения охлажденных продуктов непродолжительны и зависят от температуры хранения, относительной влажности воздуха в помещении, исходной степени обсеменения продукта психрофильными микроорганизмами: чем их больше, тем меньше срок хранения. Жгутики ‒ это органы движения бактерий. Представляют собой вращающиеся полужесткие спирально изогнутые нити из белка флагеллина, который обладает способностью сокращаться. Длина жгутиков больше самих бактерий и колеблется от 5 до 10 мкм. По типу расположения и числу жгутиков бактерии делят на четыре группы: монотрихи ‒ имеют один жгутик на полюсе клетки; лофотрихи ‒ с пучком жгутиков на одном из концов палочки; амфитрихи ‒ с двумя пучками жгутиков на полюсах; перитрихи ‒ с множеством жгутиков вокруг бактерии. Жгутикование характерно, например, для кишечных бактерий, столбняка и ботулизма, холерного вибриона. Характер и скорость движения неодинаковы у отдельных видов бактерий. Подвижность бактерий может быть утрачена под влиянием неблагоприятных условий жизни, при старении клеток и механических воздействиях. Многие микроорганизмы при попадании в неблагоприятные условия не погибают и сохраняют жизнеспособность длительное время, переходя в анабиотическое состояние. При этом бактериальная клетка из вегетативного состояния переходит в споровое, позволяющее сохранять жизнеспособность в течение длительного времени. Споры ‒ это покоящиеся клетки, обладающие устойчивостью к неблагоприятным факторам внешней среды, служащие для сохранения вида. Спорообразование происходит почти исключительно у палочковидных бактерий. В клетке бактерий образуется только одна спора. Спорообразование обычно наступает при обеднении среды питательными веществами или при накоплении в ней продуктов обмена. Перед спорообразованием в клетке накапливаются запасные питательные вещества (белки, липиды), образуются специфическое для спор вещество ‒ дипиколиновая кислота. Спора развивается из части протопласта (цитоплазмы с ядерным материалом) материнской вегетативной клетки. По мере развития и созревания закладываются ее оболочки, число и толщина которых варьирует у разных бактерий. Поверхность наружной оболочки может быть гладкой либо иметь выросты. Процесс спорообразования происходит в течение нескольких часов. Обычно споры имеют круглую или овальную форму, располагаются в центре клетки, ближе к концу и на самом конце клетки. Диаметр спор может превышать ширину клетки. После созревания споры материнская вегетативная клетка отмирает, оболочка ее разрушается и спора высвобождается. Плотная оболочка, малое содержание свободной воды, наличие дипиколиновой кислоты создают большую устойчивость спор к физико-химическим воздействиям. Так, споры некоторых бактерий выдерживают кипячение в течение нескольких часов, могут длительное время сохраняться (десятки и сотни лет) в сухом состоянии, более устойчивы по отношению к действию химических ядов, радиации и других факторов внешней среды. В благоприятных условиях споры прорастают в вегетативные клетки. При этом они набухают вследствие поглощения воды, активизируются их ферменты, усиливаются биохимические процессы, приводящие к росту. Затем происходит растворение внешней оболочки и через образовавшееся отверстие молодая бактериальная клетка выходит наружу. Литература. Биохимия: учеб. для студ. мед. вузов / под ред. Е. С. Северина.- 5-е изд.,испр. и доп. - М : ГЭОТАР-Медиа, 2011. - 768с. Биохимия [Электронный ресурс]: учебник / под ред. Е. С. Северина. - 5-е изд., испр. и доп. - М. : ГЭОТАР-Медиа, 2014. - 768 с. – Режим доступа: http://www.studentlibrary.ru/book/ISBN9785970427866.html?SSr=4801337895101803afce57828011959 Березов Т.Т. Биологическая химия [Электронный ресурс]: учеб. / Т.Т. Березов, Б.Ф. Коровкин. - 3-е изд., стереотип. - М.: ОАО "Издательство "Медицина", 2008. - 704 с: ил.- Режим доступа: http://www.studentlibrary.ru/book/ISBN5225046851.html?SSr=3501337898106c6dc59c57828011959 | |||||||||||||||||||||