Или ю. Итог тест вар 5. Ответ электродная формула Cr. 1s22s22p63s23p63d54 Укажите заряд ядра атома с сокращённой электронной конфигурацией основного состояния (обведите правильный ответ) 1) 20 2) 25 3) 30 4) 35 ответ 2
 Скачать 46.54 Kb. Скачать 46.54 Kb.
|
|
Итоговое тестирование по курсу «Химия» Группа 141 Факультет Юридический Вариант 5 Напишите электронную формулу элемента № 24. ОТВЕТ: электродная формула Cr. 1s22s22p63s23p63d54s1. 2. Укажите заряд ядра атома с сокращённой электронной конфигурацией основного состояния 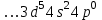 (обведите правильный ответ): (обведите правильный ответ):1) 20 2) 25 3) 30 4) 35 ОТВЕТ: 2 3. Название химического элемента, имеющего электронную конфигурацию атома 1s22s22p63s23p63d104s24p64d105s25p1 (Напишите название элемента) ОТВЕТ: Индий. 4. Какой элемент имеет в атоме два электрона, для каждого из которых n=4 и l=0? (обведите правильный ответ) 1. Na 2. K 3. Ca 4. Sr ОТВЕТ:Sr 5. Оксиды какого ряда реагируют с водой при комнатной температуре (приведите уравнения реакций): 1) 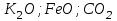 2) 2) 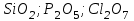 3) 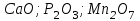 4) 4) 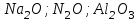 ОТЫЕТ: 2 CaO+H2O= Ca(OH)2 P2O3+3H2O= 2H3PO4 Mn2O7+7H2O= 2Mn(OH)7 6. Какое основание в большей степени проявляет основные свойства? (приведите пример реакции) 1) 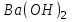 2) 2) 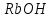 3) 3) 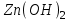 4) 4) 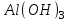 ОТВЕТ:2 7. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения: Al 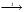 Al I3 Al I3 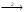 Al(OH)2I Al(OH)2I 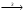 Al(OH)3 Al(OH)3 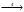 K[Al(OH)4] K[Al(OH)4] 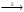 Al2(SO4)3 Al2(SO4)31) 2) 3) 4) 5) 8. . Какие пары соединений реагируют между собой (приведите уравнения реакций): ОТВЕТ: HNO3+SiO2= Al2O3+3H2O=2Al(OH)3 2NaCl+Ca(OH)2=2NaOH+CaCl2 HNO3+Al(OH)2NO3= 9. Определите тип ОВР и уравняйте реакцию методом электронного баланса: 6FeSO4 + KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O Cl(5) +6e=Cl(-1) окислитель 6Fe(2) -6e=6Fe(3)восстановитель ОТВЕТ:межмолекулярный тип. 10. Укажите схемы процессов окисления: 1) (PO4)3-+ 2H+ = (H2PO4)- 2) NH3 = (NO3)- 3) 2О-1 = О20 4) (SO4)2- = H2S 11. Какие пары ионов, формулы которых приведены ниже, можно использовать при составлении молекулярных уравнений, которым отвечает сокращённое ионное 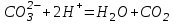 (написать уравнение реакции в молекулярном виде)? (написать уравнение реакции в молекулярном виде)? 1) 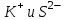 2) 2) 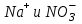 3) 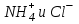 4) 4) 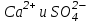 12. Электронная конфигурация внешнего энергетического уровня атома Сlв степени окисления +5 (обведите правильный ответ) 1) …3s23p5 2) …3s23p1 3) …3s23p0 4) …4s24p4 ОТВЕТ: 1 13. Какие соединения марганца способны проявлять окислительно-восстановительную двойственность? (приведите примеры) 1) MnCl2 2) MnO2 3) K2MnO4 4) KMnO4 14. Используя метод электронного баланса, напишите уравнение реакции и определите коэффициент перед окислителем в уравнении реакции: ОТВЕТ: 4Mg + 10HNO3 = NH4NO3 + 4Mg(NO3)2 + 3H2O 4Mg(0) -8e=4Mg(2) восстановитель N(5) +8e=N(-3) окислитель Коэффициент перед окислителем: 10. 15. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения Mg 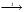 MgO MgO  MgCl2 MgCl2  MgOHCl MgOHCl  MgSO4 MgSO4  Mg(HSO4)2 Mg(HSO4)21) 2Mg + O2 = 2MgO ( при нагревании) 2) MgO + 2HCl = MgCl2 + H2O 3) 4) 5) |
