Озон. Озон. Аллотропия
 Скачать 89.81 Kb. Скачать 89.81 Kb.
|
|
Озон. Аллотропия Урок посвящен изучению аллотропных модификаций кислорода – кислорода и озона. Рассматриваются состав и физические свойства простых веществ, образованных химическим элементом кислородом. I. Аллотропия кислорода Некоторые химические элементы могут образовывать несколько простых веществ. Такое свойство элементов называется аллотропией, а простые вещества – аллотропическими (аллотропными) модификациями. Кислород имеет две аллотропические модификации кислород и озон (Рис. 1). Рассмотрим состав молекул этих веществ, а также особенности их физических свойств. 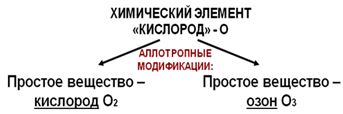 Рис. 1. Аллотропические модификации кислорода Простое вещество кислород Рассмотрим простое вещество кислород. Молекула кислорода состоит из двух атомов кислорода. Ее относительная молекулярная масса равна 32 (значит, кислород тяжелее воздуха, у которого средняя Мr = 29). Кислород – бесцветный газ, без вкуса и запаха, малорастворимый в воде. Температура кипения сжиженного кислорода -183 С, температура плавления твердого кислорода -219 С. Интересно, что кислород притягивается магнитом. Кислород поддерживает дыхание и горение. Причем, если внести в сосуд с кислородом тлеющую лучинку, то она вспыхнет ярким пламенем.  Рис. 2. Характеристика простого вещества кислорода Озон Другая аллотропическая модификация химического элемента кислорода – озон. Молекула озона состоит из трех атомов кислорода. Его формула О3. Значит, озон тяжелее кислорода (Мr=48). Озоновый слой находится в верхних слоях атмосферы. Озон поглощает губительные для всего живого ультрафиолетовые лучи, превращаясь в кислород: 2О3 = 3О2 Поэтому так важно, чтобы в озоновом слое не возникало «дыр». Основными разрушителями озона являются реактивные самолеты и космические ракеты. При работе их двигателей в атмосферу выбрасывается много веществ, которые вступают в реакцию с озоном. Озон – газ синего цвета с резким запахом. Температура плавления твердого озона – 193 С, температура кипения жидкого озона – 112 С. Растворимость озона в воде почти в 7 раз выше, чем кислорода. Озон – ядовитое вещество, поэтому им нельзя дышать. Горение озон поддерживает лучше кислорода.  Рис. 3. Характеристика простого вещества озона Озон образуется из кислорода во время грозы: 3О2 = 2О3. Итак, несмотря на то, что простые вещества кислород и озон образованы атомами одного химического элемента – кислорода, они обладают различными свойствами. II. Озон в природе Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.Озон является постоянным компонентом атмосферы Земли и играет важную роль для поддержания на ней жизни. В приземных слоях земной атмосферы концентрация озона чрезвычайно мала и составляет величину порядка 10-7 — 10-6%. Однако с увеличением высоты концентрация озона резко возрастает, проходя через максимум на высоте 20—30 км. Общее содержание озона в атмосфере может быть охарактеризовано слоем озона, приведённого к нормальным условиям (0°С, 1 атм), и составляет толщину около 0,4—0,6 см. Общее содержание озона в атмосфере переменное, и колеблется в зависимости от времени года и географической широты. Как правило, концентрация озона больше в высоких широтах и максимальна весной, а минимальна осенью. Известно, что атмосферный озон играет ключевую роль для поддержания жизни на земле, выступая в качестве защитной составляющей для живых организмов от жёсткого ультрафиолетового излучения Солнца. С другой стороны, озон является весьма эффективным парниковым газом, и, поглощая инфракрасное излучение поверхности Земли, препятствует её охлаждению. Установлено, что нахождение и перемещение масс озона в атмосфере Земли существенно влияет на метеорологическую обстановку на планете. |
