|
Документ Microsoft Word. P, где е это фермент ат
Методы иммунодиагностики - основные закономерности и разнообразие В основе любого иммунодиагностического исследования лежит высоко специфичное и эффективное взаимодействие антиген - антитело (рис. 3.5). Таким образом, связывание антитела с антигеном-мишенью (появление в образце комплексов АТАГ) свидетельствует о наличии анализируемого антигена (инфекционного агента или целевого биологически активного соединения). Рис.3.5. Взаимодействие антиген - антитело Задача состоит в том, чтобы о своем наличии такие комплексы «сообщали» каким-либо визуальным сигналом, т.е. необходимо каким-то образом «пометить» антитело. Долгое время в качестве меток в иммуноанализе использовали радиоактивные изотопы. Они обеспечивали высокую чувствительность анализа, однако обладали рядом недостатков: нестабильностью (использовали высокоактивные короткоживущие изотопы), невозможностью автоматизации анализа, опасностью для персонала лабораторий и производства. Альтернативой радиоиммуноанализу стал так называемый иммуноферментный анализ, общую схему которого можно представить следующим уравнением: АГ (или АТ) + АТ
Е (или АГ
Е) —> АГ
АТ
Е + S —> P, где Е - это фермент; АТ
Е - антитело, меченное ферментном (химически синтезированный комплекс); S - субстрат данного фермента; Р - продукт ферментативной реакции, обладающий каким-либо визуальным признаком (окраской, флуоресценцией или люминесценцией). По интенсивности полученного от продукта сигнала судят о наличии и количестве молекулы-мишени. Широко распространенной разновидностью иммуноферментного анализа является так называемый ферментный иммуносорбентный анализ (ELISA, по английской транскрипции названия метода). Схема такого анализа приведена на рис. 3.6. Рис. 3.6. Схема проведения ELISA: Е - репортерный фермент; S, Р - субстрат и визуально определяемый продукт фермента соответственно Поскольку иммуноферментный метод получил весьма широкое распространение, поиск ферментов, как можно более полно удовлетворяющих всем требованиям, продолжается и в настоящее время. Весьма перспективными оказались биолюминесцентные ферменты - люциферазы - белки, одним из продуктов реакций которых является квант света в видимой области спектра. Все люциферазы считаются оксигеназами, т.е. катализируют реакции окисления субстрата молекулярным кислородом. Перспективность аналитического использования люцифераз обусловлена высоким квантовым выходом биолюминесцентной реакции. Например, для люциферазы, выделенной из светляков, он составляет около 90 %. В настоящее время известно огромное количество различных биолюминесцентных животных, в основном морских, изучены их биолюминесцентные системы, клонированы гены люцифераз, установлены структуры и синтезированы молекулы субстратов. Особое место среди биолюминесцентных белков занимают Са -активируемые фотопротеины морских кишечнополостных. Молекула фотопротеина представляет собой стабильный фермент-субстратный комплекс, состоящий из односубъединичного полипептида (молекулярная масса около 20 кДа) и «преактивированного» кислородом субстрата, 2-гидропероксицелентеразина, прочно, но нековалентно связанного с белком. Биолюминесценция инициируется ионами кальция и возникает вследствие окислительного декарбоксилирования связанного с белком субстрата. В Институте биофизики СО РАН была клонирована кДНК одного из фотопротеинов - обелина гидроидного полипа Obelia longissima, сконструирован штамм E.coli - суперпродуцент апобелка и разработана высокоэффективная технология его выделения, позволяющая получать 50-70 мг высоко-очищенного рекомбинантного обелина. Было показано, что белок стабилен при хранении в растворе и лиофилизованном виде, а также при проведении химических и генноинженерных модификаций. Синтезированные конъюгаты с другими белками (авидином, иммуноглобулинами и др.) и гаптенами (биотином, тироксином) были использованы в качестве меток для иммуноанализа целого ряда диагностически важных веществ (альфафетопротеинов, гормонов различной природы, антител на инфекционные агенты) и продемонстрирована их перспективность и преимущества по сравнению с другими метками. Это высокая чувствительность анализа, сравнимая с изотопной меткой (благодаря высокому квантовому выходу реакции (25-30 %) определяют атомолярные количества фотопротеина); практически полное отсутствие фонового сигнала вследствие высокой специфичности фотопротеина к ионам Са2+; практически неограниченный линейный диапазон зависимости биолюминесцентного сигнала от концентрации фотопротеина (при насыщающей концентрации Са2+ величина светового потока прямо пропорциональна количеству белка, поскольку он непосредственно участвует в реакции); простота запуска (надо только добавить раствор Са2+ ) и высокая скорость реакции (отсутствие дополнительных субстратов или кофакторов, биолюминесцентная реакция происходит в течение нескольких секунд); отсутствие токсичности. Наличие коммерчески доступных современных высокочувствительных фотометров, в том числе и планшетного формата, позволяет надеяться, что в самое ближайшее время биолюминесцентный иммуноанализ найдет широкое практическое применение в медицинской диагностике. На рис. 3.7 показан пример использования обелина как репортера в ИФА тиреотропного (ТТГ) гормона в сыворотке. Можно видеть, что результаты биолюминесцентного определения этого гормона в сыворотках пациентов хорошо коррелируют с результатами РИА. Если чувствительность иммуноферментного анализа обеспечивается ферментативной реакцией репортера и чувствительностью инструментов для измерения соответствующего сигнала, то его специфичность зависит от аффинности иммуноглобулинов к молекуле-мишени. Для получения иммуноглобулинов к данной мишени его очищенный (в случае белков) или дезактивированный (в случае патогенного организма) препарат используют для иммунизации экспериментальных животных. Антитела, которые при этом образуются в сыворотке (антисыворотке) животного (мыши, кролика и др.), представляют собой смесь иммуноглобулинов к различным антигенным детерминантам (эпитопам) мишени. Такую смесь антител называют поликлональными антителами. Их использование для некоторых методов диагностики имеет два недостатка: 1) содержание отдельных антител в поликлональном препарате может варьировать от одной партии к другой; 2) поликлональные антитела нельзя применять, если необходимо различить две сходные мишени, отличающиеся единственной детерминантой. В настоящее время используются моноклональные антитела, получаемые с помощью технологии гибридом. Эта технология состоит в создании клеточной линии, продуцирующей антитела одного типа, высокоспецифичные к одному эпитопу антигена-мишени. Известно, что В-лимфоциты, продуцирующие антитела, не могут воспроизводиться в культуре. В то же время клетки миеломы прекрасно пролиферируют и при их слиянии с лимфоцитами могут образовываться гибридные клетки, обладающие требуемыми свойствами. Кратко процедура получения гибридных клеток состоит из следующих этапов: 1) клетки селезенки иммунизированных антигеном животных смешивают с взвесью миеломных клеток, дефектных по гипоксантин-гуанин-фосфорибозилтрансферазе (HGPRT-) в 35 %-м растворе полиэтиленгликоля, и высевают в среду, содержащую гипоксантин, аминоптерин и тимидин (среда ГАТ); 2) на 10-14-е сут в среде остаются только слившиеся клетки селезенки-миеломы (остальные гибриды и исходные клетки погибают); 3) полученные гибриды выращивают на полной среде без ГАТ и идентифицируют с помощью иммунного анализа, затем субкультивируют, чтобы получить отдельные клоны. Применение моноклональных антител позволяет существенно повысить специфичность иммуноанализа. Часто для определения одной мишени применяют два моноклональных антитела на разные эпитопы (сэндвич-анализ): первое антитело используют для первичной сорбции антигена на поверхности, а второе, меченное ферментом, - для обнаружения антигена (см. пример на рис. 3.7). Рис. 3.7. Схема (вверху) и результаты (слева) биолюминесцентного им-муноанализа ТТГ сэндвич-типа. Справа - корреляция результатов биолюминесцентного (BLIA) и радиозотопного (RIA) методов определения содержания ТТГ в сыворотках пациентов (R = 0,96, n = 39) Существующий рынок иммунодиагностикумов, поставляемых различными зарубежными и отечественными фирмами, чрезвычайно разнообразен (табл. 3.1).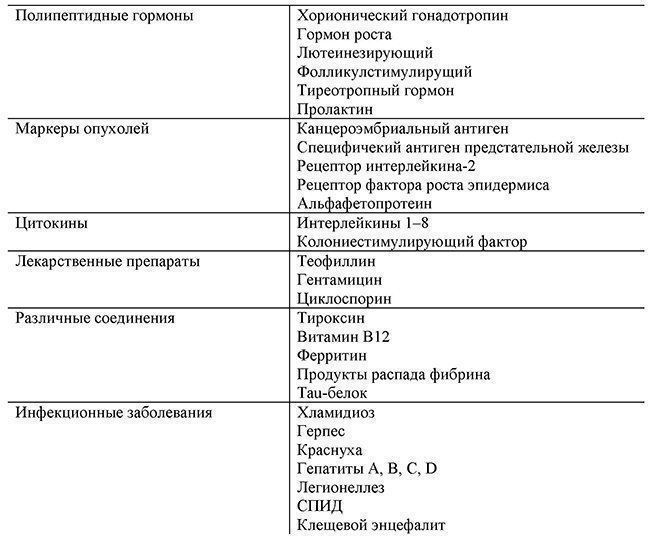
Таблица 3.1. Важнейшие антигены определяемые коммерческими иммуноферментными диагностикумами
Рассмотренные нами варианты иммуноанализа представляют собой так называемые гетерогенные методы, когда иммунокомплекс формируется на поверхности, а непрореагировавшие и неспецифичные компоненты удаляются с помощью промывок. Существует другая группа методов, не требующих разделения компонентов (гомогенные методы). В основе гомогенного ИФА лежит потеря активности маркерного фермента в результате реакции АГ-АТ либо, наоборот, восстанавление активности фермента в результате реакции АГ-АТ. Как правило, эти методы не являются количественными и применяются для получения ответа «да» - «нет» (например, диагностирование беременности).
Источник: https://medbe.ru/materials/problemy-i-metody-biotekhnologii/metody-immunodiagnostiki-osnovnye-zakonomernosti-i-raznoobrazie/
© medbe.ru
Иммуносенсоры
Впервые принцип иммуносенсоров был использован М. Аizawа и соавт. (1977), когда они сконструировали мембрану, способную на иммунологический ответ. В настоящее время опубликовано несколько сообщений об использовании аналогичного подхода для определения различных микробных антигенов или антител к ним [Horbach Е. еt аl, 1989, Parry R. еt аl., 1990].
Принцип методов, основанных на иммуносенсорной технологии, заключается в изменении физико-химических свойств мембраны или другого носителя, связанного с антителами или антигенами. Уменьшение мембранного потенциала, изменение оптических или химических свойств среды, прилегающей к носителю, выявляются с помощью специального электрода или оптического устройства и выражаются в виде электрического сигнала.
Существует два основных типа иммуносенсоров, различающихся по особенностям определения реакции антиген - антитело. 1 тип - так называемый немеченый иммуносенсор. Такое устройство состоит из металлического электрода для потенциометрии, покрытого полупроницаемой полимерной мембраной с иммобилизованными на ней молекулами антител (или антигена). В результате реакции с искомым комплементарным веществом образуются иммунные комплексы на поверхности мембраны. Это приводит к изменению заряда мембраны и ее поверхностного потенциала. Изменение разности потенциалов и определяется электродом.2 тип - меченый иммуносенсор. В этом случае на мембране также иммобилизуются антитела или антиген, но реакция определяется по изменению проводимости (амперметрия). Для этого используют кислородный электрод, реагирующий на изменение концентрации О2 после реакции антител с антигеном, меченым ферментом (например, каталазой). Конкуренция искомого антигена с известным количеством меченого конъюгата дает изменение проводимости раствора в области мембраны, что реализуется в виде электрического сигнала на выходе электрода. В другой модификации результат цветной ферментативной реакции может быть определен и с помощью оптического устройства.
Для оценки результатов реакции в двух описанных типах иммуносенсоров значительно реже используют пьезоэлектрический эффект, измерение температурных колебаний и некоторые другие способы, менее разработанные в сравнении с электрохимическими и оптическими.
Особенностью иммуносенсоров, отличающей их от других систем иммунохимической диагностики, является то, что информация о возникновении иммунного комплекса непосредственно реализуется в виде физического сигнала - изменения разницы потенциалов, оптической плотности, силы тока и т. п.
МЕТОДЫ ГЕННОГО ЗОНДИРОВАНИЯ
Интенсивное развитие молекулярной биологии и создание совершенной методической базы генетических исследований явились основой генетической инженерии. В области диагностики возникло и бурно развивается направление по определению специфических нуклеотидных последовательностей ДНК и РНК, так называемое генное зондирование. В основе подобных методик лежит способность нуклеиновых кислот к гибридизации - образованию двухцепочных структур за счет взаимодействия комплементарных нуклеотидов (А-Т, Г-Ц). Для определения искомой последовательности ДНК (или РНК) специально создается, так называемый, зонд полинуклеотид с определенной последовательностью оснований. В его состав вводят специальную метку, позволяющую идентифицировать образование комплекса. Схема реакции представлена на рисунке.
Иммунодиагностика – это использование реакций иммунитета для диагностики инфекционных и неинфекционных заболеваний.
Реакции иммунитета – это взаимодействие антигена с продуктами иммунного ответа. В любой реакции иммунитета выделяют две фазы:
1) специфическую – обусловлена взаимодействием антигена с антителом и образованием комплекса АГ – АТ;
2) неспецифическую.
Все реакции иммунитета делятся на:
1) простые; участвуют два компонента (антиген и антитело);
2) сложные; участвуют три компонента и более (антиген, антитело, комплемент и т. д.).
Выделяют также:
1) прямые (результат учитывается визуально);
2) непрямые (требуются специальные системы индикации).
Используются следующие реакции иммунитета.
1. Реакция агглютинации – это склеивание и осаждение корпускулярного антигена под действием антитела в присутствии электролита.
Различают следующие модификации реакции агглютинации:
1) реакцию пассивной гемагглютинации (РПГА);
2) латекс-агглютинацию;
3) ко-агглютинацию;
4) антиглобулиновый тест (реакция Кумбса).
2. Реакция преципитации – это осаждение антигена из раствора под действием антитела преципитирующей сыворотки в присутствии электролита.
3. Реакция связывания комплемента (РСК) – сложная, многокомпонентная непрямая реакция иммунитета. Включает в себя две системы:
1) исследуемую, состоящую из антигена и антитела (один из них неизвестен), в которую вносится также комплемент;
2) индикаторную, состоящую из эритроцитов барана и гемолитической сыворотки, содержащей антитела к ним.
Если в исследуемой системе антиген и антитело соответствуют друг другу, то они образуют комплекс, связывающий комплемент. В этом случае в индикаторной системе не произойдет изменений. Если же в исследуемой системе антиген и антитело не соответствуют друг другу, то комплекс АГ – АТ не образуется, комплемент остается свободным. Он связывается комплексом АГ – АТ индикаторной системы и тем самым обуславливает гемолиз эритроцитов.
4. Реакции с участием меченых антигенов или антител:
1) радиоиммунный анализ (РИА) (основан на использовании меченных радиоактивным йодом или водородом антител);
2) реакция иммунофлюоресценции (основана на том, что антитела иммунной сыворотки метят флюорохромами);
3) иммуноферментный анализ (ИФА) (компонент реакции метят ферментом).
5. Реакция токсиннейтрализации (для определения типа токсина возбудителя). Смесь токсина и антитоксической сыворотки вводят белым мышам, и, если они соответствуют друг другу, т. е. нейтрализуются, мыши не погибают. |
|
|
 Скачать 74.37 Kb.
Скачать 74.37 Kb.
