Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
115 вопросХимический состав мышечной ткани. Белковые вещества мышечной ткани: миофибриллярные (миозин, актин G и F, актомиозин, тропонин), саркоплазматические (миоглобин - его строение и функции), белки сарколеммы (стромы), экстрактивные вещества. Минеральные вещества.Органическиефосфаты. Изменение химического состава мышечной ткани в онтогнезе. Мышечная ткань характеризуется сложным химическим составом. В нее входит значительное количество лабильных веществ, содержание и свойства которых могут изменяться в зависимости от многих факторов как при жизни животного (предубойное содержание), так и сразу после убоя. Поэтому химический состав ткани изучают при строго определенных условиях, к которым относится быстрое извлечение ткани после убоя животного, охлаждение, быстрое измельчение при охлаждении, обработка при низких температурах и т. д. При исследовании химического состава мышечную ткань освобождают по возможности от других тканей (соединительной, жировой и др.) и измельчают (гомогенизируют). После этого выделяют и разделяют химические компоненты, входящие в состав ткани. Такое разделение чаще всего основывается на избирательной растворимости отдельных химических веществ мышечной ткани в различных растворителях: воде, водно-солевых растворах при различном значении рН, органических растворителях и т. д. Для извлечения липидов измельченную ткань перед экстракцией предварительно высушивают. Содержание основных групп химических веществ в мышечной ткани млекопитающих характеризуется следующими данными (в %)• Вода………………………………………………… 70—75 Органические вещества…………………… . 23—28 Белки………………………………………………. . 18—22 Азотистые экстрактивные вещества . . . 1—1,7 Безазотистые экстрактивные вещества . . 0,7—1,35 Липиды…………………………………………. . 2—3,0 Неорганические соли………………………. .. 1—1,5 Содержание воды в мышцах колеблется в зависимости от возраста животного: чем оно моложе, тем больше влаги в мышцах. Неодинаково содержание воды в различных группах мышц и уменьшается оно по мере увеличения содержания жира. Вода, входящая в состав мышечной ткани, неоднородна по физико-химическим свойствам и роль ее неодинакова. Из минеральных веществ в мышцах имеются главным образом катионы К+, Na+, Mg2+, Ca2+, анионы Сl-, HPO4 Н2РО4. Перечисленные ионы играют важную роль в регуляции биохимических процессов в сокращающихся мышцах. Сократительные элементы - миофибриллы - занимают большую часть объема мышечных клеток, их диаметр около 1 мкм. В нетренированных мышцах миофибриллы расположены рассеянно, а в тренированных они сгруппированы в пучки, называемые полями Конгейма. Микроскопическое изучение строения миофибрилл показало, что они состоят из чередующихся светлых и темных участков, или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертанность всего мышечного волокна. Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными, в свою очередь, из большого числа мышечных нитей двух типов - толстых и тонких. Толстые нити имеют Диаметр 15 нм, тонкие - 7 нм. Толстые нити состоят из белка миозина. Миозин - белок с молекулярной массой около 500 кДа, содержащий две очень длинные полипептидные цепи. Эти цепи образуют двойную спираль, но на одном конце эти нити расходятся и формируют шаровидное образование -глобулярную головку. Поэтому в молекуле миозина различают две части - глобулярную головку и хвост. 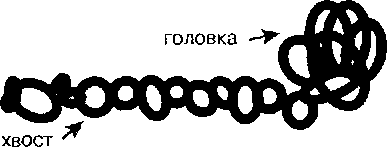 Схема строения молекулы миозина В состав толстой нити входит около 300 миозиновых молекул, а на поперечном срезе толстой нити обнаруживается 18 молекул миозина. Миозиновые молекулы в толстых нитях переплетаются своими хвостами, а их головки выступают из толстой нити по правильной спирали. В головках миозина имеются два важных участка. Один из них катализирует гидролитическое расщепление АТФ, т. е. соответствует активному центру фермента. АТФазная активность миозина впервые обнаружена отечественными биохимиками Энгельгардтом и Любимовой. Второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей - актином. Тонкие нити состоят из трех белков: актина, тропонина и тропо-миозина. Основной белок тонких нитей - актин. Актин - глобулярный белок с молекулярной массой 42 кДа. Этот белок обладает двумя важнейшими свойствами. Во-первых, проявляет высокую способность к полимеризации с образованием длинных цепей, называемых фибриллярным актином. Во-вторых, как уже отмечалось, актин может соединяться с миозиновыми головками, что приводит к образованию между тонкими и толстыми нитями поперечных мостиков, или спаек. Основой тонкой нити является двойная спираль из двух цепей фибриллярного актина, содержащая около 300 молекул глобулярного актина. Еще один белок тонких нитей - тропомиозин - также имеет форму Двойной спирали, но эта спираль образована полипептидными цепями и по размеру гораздо меньше двойной спирали актина. Тропомиозин располагается в желобке двойной спирали фибриллярного актина. Третий белок тонких нитей — тропонин - присоединяется к тропомиозицу и фиксирует его положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей. ИЗМЕНЕНИЕ ХИМИЧЕСКОГО СОСТАВА МЫШЕЧНОЙ ТКАНИ В ОНТОГЕНЕЗЕ Эмбриональная мышечная ткань по своему химическому составу значительно отличается от скелетной мускулатуры взрослых особей. В мышцах эмбрионов больше воды, чем в функционально зрелой мускулатуре. Соответственно общее содержание белка в мышечной ткани эмбрионов в пересчете на сырую ткань оказывается более низким, чем в мышцах животных того же вида в постнатальном периоде развития. По сравнению с мышцами взрослого организма в функционально незрелой мышце ниже содержание миофибриллярных белков (миозина и актомиозина) и выше – белков стромы, миоальбумина, а также глобулинов. По мере развития плода количество миофибриллярных белков увеличивается и возрастает АТФазная активность в мышечных экстрактах.Для эмбриональной мышечной ткани характерно высокое содержание нуклеопротеинов, а также РНК и ДНК. По мере развития эмбриона количество нуклеопротеинов и нуклеиновых кислот в мышечной ткани быстро уменьшается. Высокоэнергетических соединений (АТФ и креатин-фосфат) в функционально незрелой мышце значительно меньше, чем в мышцах зрелых особей. Имидазолсодержащие дипептиды (ансерин и кар-нозин) появляются в мышечной ткани в строго определенный период онтогенеза. Время появления этих дипептидов тесно связано с мышечной функцией и совпадает с формированием рефлекторной дуги, обеспечивающей возможность двигательного рефлекса, появлением Са2+-чувстви-тельности актомиозина и началом работы ионных насосов. Имеются также характерные особенности в ферментных и изоферментных спектрах эмбриональной мышечной ткани. Так, установлено, что в ходе онтогенеза изменяется изоферментный спектр ЛДГ. В экстрактах из скелетных мышц 3–5-месячного эмбриона на долю изоферментов ЛДГ3 и ЛДГ2 приходится соответственно 40 и 31% от общей активности ЛДГ. В процессе эмбрионального развития в скелетной мускулатуре происходят постепенное возрастание активности катодных и снижение активности анодных изофер-ментов ЛДГ, так что у взрослых особей в скелетной мускулатуре наибольшей активностью обладают уже изоферменты ЛДГ5 и ЛДГ4. В процессе развития плода изменяется также изоферментный спектр гексокиназы в мышечной ткани: повышается активность изофермента I и снижается активность изофермента II. Приведенные данные об изменении химического состава мышечной ткани в онтогенезе относятся почти исключительно к скелетной мускулатуре. |
