Биосинтез. Биосинтез-1. Перенос генетической информации и биосинтез белка в клетках
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
|
Глава 10. Перенос генетической информации и биосинтез белка в клетках Живые организмы обладают уникальной способностью передавать генетическую информацию от поколения к поколению, сохраняя свои наследственные свойства. Материальным носителем воспроизводства наследственной информации является нуклеиновая кислота, имеющая для этого определенное химическое строение и биологические свойства. В большинстве организмов эту функцию выполняет ДНК. Исключение составляют отдельные вирусы, у которых носителем информации является РНК. С участием нуклеиновых кислот происходит образование всех белков, являющихся материальной основой всех жизненных процессов. Каждый живой организм содержит свои специфические белки, которыми он отличается от других организмов. Информация, определяющая особенности структуры белков, закодирована в ДНК и передается в ряду поколений молекулами ДНК. Процесс переноса генетической информации (одной из форм биологической памяти) является определяющим и очень важным для развития и нормальной жизнедеятельности клеток организма. Его можно упрощенно представить схемой:  Виды переноса генетической информации Прежде чем раскрыть виды переноса генетической информации следует подчеркнуть, что они основаны на матричном механизме синтеза (воспроизводства) новых молекул. Это означает, что для синтеза новой ДНК или РНК необходимы соответствующие матрицы. Точность копирования обеспечивается правилом комплементарности азотистых оснований, согласно которому происходит спаривание А с Т в ДНК (или с У в РНК) и Г с Ц. Благодаря этому порядок чередования нуклеотидов в каждой новой полинуклеотидной цепи комплементарен матрице. Матричный синтез позволяет очень быстро, экономно и с большой точностью (а это очень важно, поскольку речь идет о наследственных свойствах) воспроизводить имеющуюся в клетке генетическую информацию. Следует отметить три вида переноса генетической информации, имеющих место на различных уровнях организации живой материи: 1. Репликация (самоудвоение, копирование). Это перенос генетической информации в пределах одного класса нуклеиновых кислот: в основном от ДНК к ДНК или у некоторых вирусов от РНК к РНК. Этот процесс происходит только во время деления клетки (на стадии S-фазы митотического цикла) и размножения вирусов и сопровождается репликацией всей молекулы ДНК или РНК. Молекула ДНК расплетается и на ее одиночных цепях в результате репликации образуются точные копии исходной ДНК, т.е. полученные ДНК похожи друг на друга и на исходную материнскую; следовательно наследственная информация сохраняется. Таким образом, в результате репликации из одной молекулы образуются две новые абсолютно одинаковые молекулы ДНК: одна из них остается в материнской клетке, а другая переходит в дочернюю. Возможна также репликация отдельных фрагментов ДНК, которая называется амплификацией. 2. Транскрипция, или переписывание. Это перенос генетической информации между разными классами нуклеиновых кислот: ДНК РНК. В отличие от репликации происходит копирование не всей молекулы ДНК, а только ее отдельных участков (цистронов). В ходе транскрипции образуются разные виды РНК (мРНК, тРНК, рРНК), участвующие в биосинтезе белка. Цистроны ДНК содержат информацию о структуре всех типов РНК и о структуре всех белков данного вида организма. Различают транскрипцию прямую (от ДНК к РНК) и обратную (от РНК к ДНК). Подробно прямая транскрипция будет рассмотрена ниже. Обратная транскрипция впервые была выявлена у РНК-содержащих онкогенных вирусов, и осуществляется она специальным ферментом – обратной транскриптазой, или ревертазой. Сначала к матрице РНК вируса с помощью этого фермента комплементарно присоединяются дезоксирибонуклеозидтрифосфаты и синтезируется одна цепь ДНК. При этом образуется гибридная объединенная молекула РНК–ДНК. Затем фермент РНКаза Н удаляет рибонуклеотидную цепь из гибридной молекулы, а на одиночной цепи ДНК комплементарно в присутствии фермента ДНК-полимеразы происходит синтез второй цепи ДНК:  Образовавшаяся ДНК (копия вирусной РНК) встраивается в ДНК клетки-хозяина и вызывает опухолевую трансформацию клетки. 3. Трансляция (перевод) осуществляется между разными классами макромолекул – генетическая информация передается от мРНК к белку, т.е. происходит перевод информации с «языка» нуклеотидной последовательности нуклеиновых кислот на «язык» аминокислотной последовательности белка. Трансляция может быть только прямой. Перенос генетической информации можно представить в виде схемы:  Направление переноса генетической информации от ДНК через РНК к белку называется центральным постулатом молекулярной генетики, согласно которому не может быть переноса информации от белка к РНК, но допускается от РНК к ДНК. БИОСИНТЕЗ БЕЛКА Биосинтез белка является центральным вопросом биохимии. Раскрытие его имеет важное теоретическое и практическое значение. Учение о биосинтезе белка тесно связано с такими важнейшими проблемами, как наследственность, изменчивость, приспособляемость, естественный отбор, выведение новых форм растительных и животных организмов, с разработкой методов управления процессами жизнедеятельности организма. Расшифровка процессов биосинтеза белка и его регуляции имеет первостепенное значение и для здравоохранения, в т.ч. фармации, позволяет разобраться в природе наследственных заболеваний, ставит вопросы их профилактики и лечения; способствует направленному синтезу фармпрепаратов, в том числе антиметаболитов, которые используются для подавления процессов биосинтеза белка у онкологических больных; антимутагенов, предотвращающих мутационные изменения в ДНК, радиопротекторов, защищающих нуклеиновые кислоты от радиационных и других повреждений; позволяет раскрывать механизмы действия некоторых лекарственных средств, в частности антибиотиков, подавляющих тот или иной этап биосинтеза белка у микроорганизмов и вирусов, раскрывает необходимость осторожного и разумного использования антибиотиков. Достижения последних лет в области молекулярной биологии легли в основу развития генной инженерии, позволяющей получать ряд ценных продуктов (белки, аминокислоты и др.), в том числе и лекарственных средств (инсулин, интерферон, гормон роста, брадикинин и др.). Исследователи, используя современные достижения в области передачи наследственной информации, биосинтеза белка и его регуляции, научились пересаживать гены с их регуляторными участками из клеток одного вида организма (например гены человеческого инсулина, интерферона) в ДНК клеток других видов организмов, в основном простейших, быстроделящихся (например, кишечной палочки), где в норме этих генов нет, и «заставили их работать» по производству человеческого инсулина и интерферона. Методами генной инженерии можно получать биологически активные вещества, необходимые для медицины, сельского хозяйства, животноводства и других отраслей народного хозяйства. Развитие генной инженерии поднимает науку на качественно новый уровень. Роль нуклеиновых кислот В живых организмах синтезируются тысячи различных специфических белков. Они отличаются друг от друга в первую очередь первичной структурой, информация о которой заложена в ДНК. Однако сама ДНК не используется в качестве непосредственной матрицы для синтеза белка. Информация о структуре, записанная в геноме ДНК, передается к рибосомам с помощью информационной РНК (иРНК), которая служит связующим звеном между генами и системой белкового синтеза. Этот процесс называется транскрипциейили переписыванием. Транскрипция – процесс, посредством которого заключенная в ДНК генетическая информация «переписывается» в форму иРНК. Она образуется на участке одной цепи ДНК по принципу комплементарности и подобна участку второй полинуклеотидной цепи ДНК. Отличие заключается лишь в том, что вместо тимидилового нуклеотида в ДНК в иРНК размещается уридиловый, и вместо дезоксирибозы нуклеотиды содержат рибозу. Таким образом, иРНК является точной копией генетической информации, закодированной в определенном участке ДНК, а именно информации о последовательности аминокислот в белках. У прокариот иРНК образуется сразу же в процессе транскрипции на ДНК, и по мере ее постепенного отделения от матрицы ДНК к ней присоединяются рибосомы и начинается синтез белка. В эукариотических клетках в процессе транскрипции вначале синтезируется предшественник – пре-иРНК, которая затем уже превращается в иРНК. Затем иРНК поступает в цитоплазму к рибосомам и выполняет роль матрицы, поэтому ее называют еще матричной РНК (мРНК). Другие разновидности РНК (рРНК, тРНК) также синтезируются на молекуле ДНК и являются частью аппарата белкового синтеза. В норме поток генетической информации в клетке идет в следующем направлении:  Рис.1 Общая принципиальная схема биосинтеза белка. Генетический код Генетический код связывает последовательность нуклеотидов в ДНК и последовательность аминокислот в белках. Следовательно, для каждой аминокислоты существует свой кодон (кодовое слово) для перевода последовательности нуклеотидов в соответствующую последовательность аминокислот. Используя 4-буквенный алфавит нуклеотидных оснований ДНК (А, Г, Т, Ц), можно теоретически составить такие варианты: 1. Если аминокислота кодируется одним основанием, то можно получить полипептидную цепь только из 4 разновидностей аминокислот (41 = 4). 2. Если предположить, что кодон для каждой аминокислоты содержит два подряд расположенных нуклеотида (дуплет), то возможно 42 = 16 сочетаний (такого числа кодонов тоже недостаточно для кодирования 20 аминокислот). В этом случае полипептидная цепь состояла бы только из 16 разновидностей аминокислот. 3. Если взять комбинации по три нуклеотида (триплет), то получается 43 = 64 кодона, т.е. с избытком. Триплетная природа генетического кода была подтверждена многочисленными экспериментами. Генетическая информация (порядок расположения нуклеотидов в гене ДНК) передается в процессе биосинтеза белков на мРНК. Код или кодон – это триплет из трех подряд расположенных пуриновых или пиримидиновых оснований на мРНК, ответственных за присоединение определенной аминокислоты в полипептидной цепи. Таблица 1РНК – аминокислотный код
В результате проведенных экспериментов были раскрыты все 64 триплета, из них 61 триплет соответствовал определенным аминокислотам, являясь смысловым, а три (УАА, УАГ, УГА) – не кодирующие аминокислоты, были названы «бессмысленными». Однако они играют важную роль в биосинтезе белка – обеспечивают конец синтеза полипептидной цепи (терминацию). Генетический код обладает следующими свойствами: триплетностью, вырожденностью, неперекрываемостью, специфичностью, колинеарностью и универсальностью. Как следует из таблицы, генетический код оказался вырожденным (избыточным), так как каждой аминокислоте (кроме метионина и триптофана) соответствует больше одного кодона. Важным свойством генетического кода является его неперекрываемость – каждый из триплетов независим друг от друга. Код является специфичным – каждой аминокислоте соответствуют только определенные кодоны, которые не могут кодировать другие аминокислоты. Код – колинеарен, т.е соблюдается соответствие линейной последовательности триплетов мРНК и аминокислот в полипептиде. Одно из существенных свойств кода – его универсальность. Тринуклеотиды, кодирующие одну и ту же аминокислоту, имеют одинаковый состав и последовательность для всех организмов (бактерий, растений, животных и человека). Все перечисленные выше свойства генетического кода характерны для всех живых организмов. Благодаря универсальности кода возможна генетическая инженерия. Таким образом, путь информации от ДНК к белку представляется следующим образом: 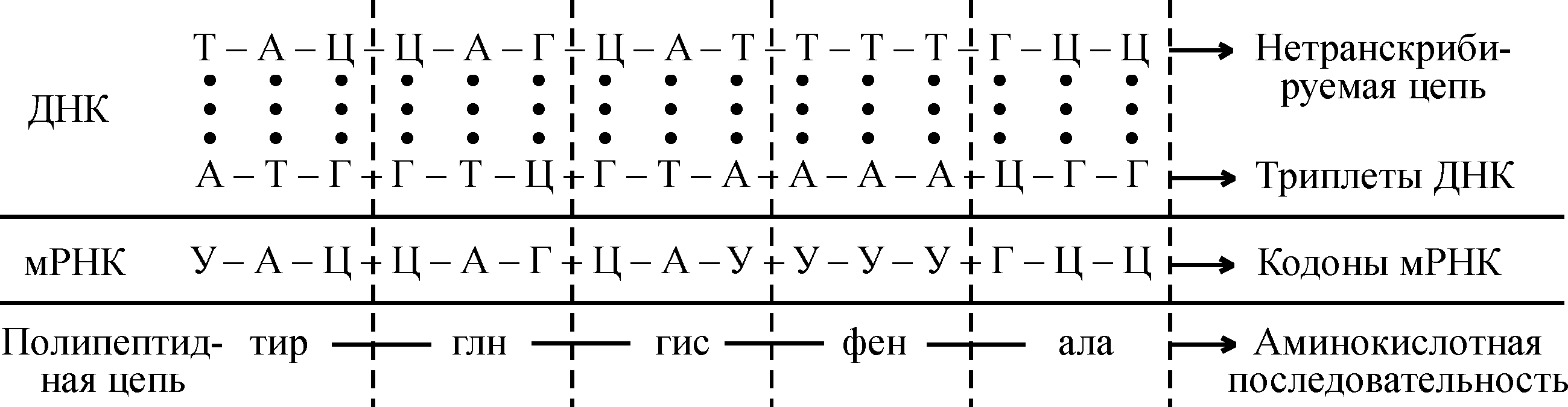 Рибосомы, их структура и химический состав В 50-е годы нашего столетия в исследованиях П.Замечника и других авторов было показано, что биосинтез белков происходит в небольших субклеточных образованиях, которые получили название рибосом. Последние были найдены во всех клетках прокариот и эукариот. Если выделить рибосомы путем дифференциального центрифугирования и посмотреть под электронным микроскопом, то они представляются как плотные округлые гранулы сферической формы, состоящие из двух субъединиц: малой и большой. Рибосомы характеризуются коэффициентом или константой седиментации, которая определяется ультрацентрифугированием и обозначается буквой S (единица Сведберга, 110–13 с). По размерам и молекулярной массе все рибосомы делят на три группы. Первую группу образуют относительно мелкие бактериальные рибосомы. Рибосомы прокариот имеют константу седиментации 70 ед. Сведберга и обозначаются 70S; они диссоциируют на две субъединицы с молекулярной массой (М.м.):  Вторую группу образуют крупные рибосомы эукариотических клеток. Они имеют константу седиментации 80S и состоят из двух субъединиц:  Третью группу составляют рибосомы митохондрий и хлоропластов эукариотических клеток. Рибосомы митохондрий относятся к классу 70S, однако они различаются по коэффициенту седиментации у разных групп эукариот. Так, у грибов он составляет 70–74S, у высших животных – 55–60S, у высших растений – около 80S. Рибосомы хлоропластов более однородны по этому признаку, коэффициент их седиментации равен 67–70S. Обычно рибосомы изображают в виде симметричной фигуры, в которой 30S субчастица лежит на 50S-субъeдинице, имеющей форму, близкую к сфере. На основе рентгеноструктурного анализа и электронно-микроскопических методов было показано, что трехмерная структура частиц рибосом весьма сложна. Малая субчастица изогнута в виде телефонной трубки, а большая напоминает ковш(рис.2) . Две субчастицы соответствуют друг другу, хотя между ними остается щель. Через щель проходит молекула мРНК, вдоль которой в процессе биосинтеза белка перемещается рибосома. Из этой щели появляется и новосинтезированная полипептидная цепь. 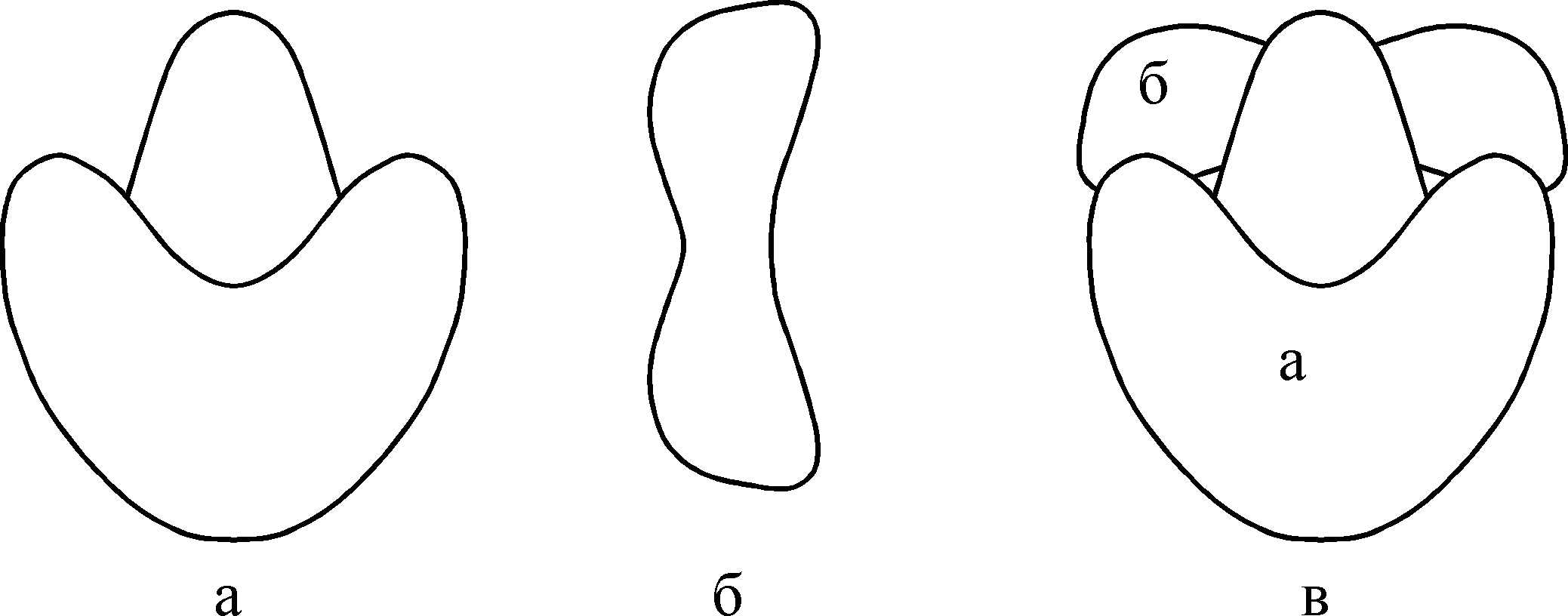 Рис.2 Большая (а) и малая (б) субчастицы рибосом (в) В состав рибосомы входят рРНК, белки, низкомолекулярные соединения: ди- и полиамины, различные соли, ионы двухвалентных металлов Мg2+, Са2+, Мn2+ и др. Рибосомы 80S построены более сложно, они содержат больше белков, и это имеет определенное значение в их функции. Этапы биосинтеза белка1. Активация аминокислот, соединение их с тРНК и перенос к рибосомам. Этот процесс идет в одну стадию, но для удобства и лучшего понимания его разбивают на два этапа. а) Активирование аминокислот – образование аминоациладенилатов. Аминокислоты в цитоплазме находятся в неактивном состоянии. Они активируются по карбоксильной группе за счет энергии АТФ, в присутствии солей Mg2+ с помощью специальных ферментов аминоацил-тРНК-синтетаз, обозначаемых сокращенно АРСазы. Эти ферменты обеспечивают оба этапа процесса – активирование аминокислот и соединение их с тРНК. Каждый фермент обладает двойной специфичностью: к определенной аминокислоте и к соответствующей ей тРНК. б) Перенос аминоациладенилатов к месту синтеза белка, к рибосомам. Активированные аминокислоты должны быть доставлены к рибосомам и этот перенос осуществляется тРНК. тРНК связывает в единое целое мРНК, рибосому, специфическую аминокислоту. Присоединение активированной аминокислоты к специфической тРНК происходит путём образования сложноэфирной связи между СООН-группой соответствующей аминокислоты и 3-ОН группой концевого остатка адениловой кислоты тРНК. Реакцию катализирует тот же фермент, что и реакцию активирования аминокислот – аминоацил-тРНК-синтетаза. В молекуле данного фермента имеются два специфических участка (активных центра), благодаря которым он «узнает» «свою» аминокислоту и «свою» тРНК. Это можно представить схематично:  Процесс «узнавания» и связывания АРСазами аминокислоты и тРНК называют рекогницией. Для каждой из 20 аминокислот, входящих в состав белка, имеется своя, причем единственная аминоацил-тРНК-синтетаза, которая «узнает» все тРНК, специфичные для данной аминокислоты. 2. Процесс трансляции на рибосомах. Процесс перевода нуклеотидной последовательности мРНК в аминокислотную получил название трансляции. Трансляция включает три этапа: инициацию (начало синтеза полипептидной цепи), элонгацию (ее рост) и терминацию (окончание синтеза). . Каждый из белков закодирован в отдельном участке мРНК – цистроне, имеющем свои инициирующие и терминирующие триплеты. 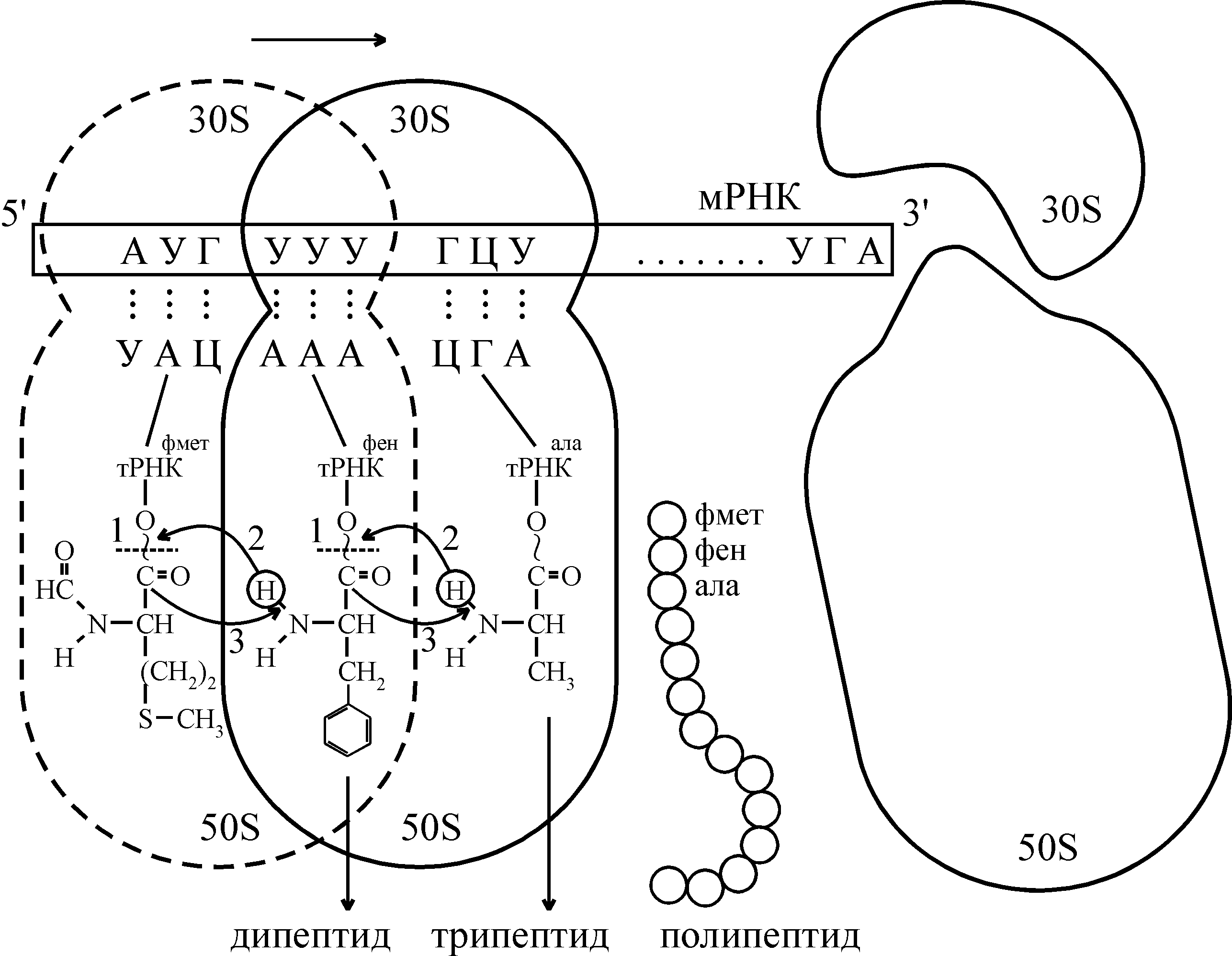 Рис3. Схема трансляции у прокариот Образование пептидной связи (рис.3) осуществляется в такой последовательности: 1. В присутствии фермента разрывается макроэргическая связь на N-формилметионил-тРНКфмет. 2. К освободившейся связи присоединяется Н от -NH2- группы фенилаланил-тРНКфен. 3. Карбонильный остаток N-формилметионина переходит к -NH2-фенилаланил-тРНКфен – возникает первая пептидная связь с образованием в А-участке дипептида: N-формилметионил- фенилаланил-тРНКфен. 4. В процессе транслокации мРНК продвигается на один кодон. 5. тРНКфмет без инициирующей аминокислоты уходит с рибосомы. В освободившийся А-участок входит тРНКала, возникает вторая пептидная связь и образуется трипептид состава N-формилметионил-фенилаланил-аланил-тРНКала, который перемещается затем в П-участок; А-участок освобождается и процесс повторяется. 6. Рибосома достигает терминирующего триплета УГА и диссоциирует на 30S- и 50S-субчастицы, при этом отделяется полипептидная цепь с заданным расположением остатков аминокислот. Вторичная и третичная структуры белков формируются в процессе трансляции по мере удлинения полипептидной цепи. Трехмерную конформацию белок окончательно принимает уже после своего отделения. Ингибиторы биосинтеза белков. Механизм действия антибиотиков Прекращение матричного биосинтеза белков приводит к гибели клетки. Ингибиторами биосинтеза белков могут быть различные вещества, в том числе антибиотики, токсины, алкалоиды, антиметаболиты (аналоги) структурных единиц нуклеиновых кислот и др. Они широко используются в биохимических исследованиях как инструменты для раскрытия механизма отдельных этапов процесса биосинтеза белков, так как оказалось, что среди них можно подобрать такие, которые избирательно ингибируют специфические фазы белкового синтеза. Антибиотики – это вещества, продуцируемые микроорганизмами, плесенью, грибами, высшими растениями, животными тканями в процессе их жизнедеятельности, а также полученные синтетическим путем. Они обладают способностью оказывать бактериостатическое или бактерицидное действие. Антибиотики, взаимодействующие с ДНК, нарушают ее матричные функции и подавляют репликацию или транскрипцию, или оба эти процесса. Противоопухолевые антибиотики практически одинаково взаимодействуют с ДНК как опухолевых, так и нормальных клеток, т.е. они не отличаются избирательностью действия. Антибиотики, ингибирующие процесс трансляции, взаимодействуя с белковыми факторами и рибосомами, применяются главным образом как противобактериальные средства. Они отличаются достаточно высокой избирательностью действия и часто сравнительно малотоксичны для человеческого организма. Это объясняется тем, что у микроорганизмов рибосомы (70S), отдельные ферменты и белковые факторы, входящие в рибосому, несколько отличаются от рибосом (80S) и соответствующих белков эукариот. Однако некоторые из них могут действовать на рибосомы митохондрий человека, так как рибосомы в митохондриях имеют меньший размер, чем 80S рибосомы в цитоплазме, поэтому митохондриальный биосинтез белка по своему механизму близок к синтезу белка у прокариот. Отмечается также в некоторой степени действие отдельных антибиотиков и на 80S рибосомы. Именно поэтому из описанных многих сотен антибиотиков лишь несколько десятков нашли применение в медицинской практике. Следовательно, успех антибиотикотерапии зависит от умелого, рационального их применения. Необходимо учитывать возможность осложнений и аллергических реакций. Ввиду этого совершенно недопустимо самолечение антибиотиками без назначения врача и отпуск их без рецепта. Все ингибиторы матричного биосинтеза белка разделяют по механизму действия на: ингибиторы репликации, транскрипции, созревания (процессинга) и транспорта РНК, трансляции и др. Препараты, усиливающие биосинтез белка В медицинской практике используются лекарственные вещества, способные стимулировать белковый синтез в организме, так называемые анаболические средства. К ним относятся многие гормональные препараты, механизм действия которых рассмотрен в главах «Гормоны», «Перенос генетической информации и биосинтез белка в клетках», а также соединения негормонального происхождения. Так, анаболические стероиды – синтетические производные мужских половых гормонов, близкие по своей структуре к андрогенам обладают избирательной анаболической активностью при маловыраженном андрогенном действии. Выраженной анаболической активностью обладает гормон инсулин. Таблица 1 Ингибиторы матричного синтеза белков
Р  ис.4 Общие сведения механизма действия антибиотиков Зачетные вопросы по темеРоль нуклеиновых кислот в процессах хранения, воспроизведения и передачи наследственной информации в клетках. Виды переноса генетической информации. Репликация, биологическое значение. 4. Транскрипция, ее виды, биологическое значение. 5. Генетический код и его свойства. 6 .Активаторы и ингибиторы биосинтеза белка как лекарственные препараты. Тестовые задания для самопроверки усвоения темыКакие из перечисленных групп лекарственных препаратов стимулируют биосинтез белка: 1 – антибиотики 2 – сульфаниламиды 3 – анаболические 4 – антихолинэстеразные 5 - анальгетические Образование и-РНК является результатом: 1 – репликации 2 – транскрипции 3 – трансляции 4 – пептидации 5 – амплификации Процесс «узнавания» и связывания АРСазами аминокислоты и тРНК называют: 1 – репликацией 2 – рекогницией 3 – активацией аминокислот 4 – трансляцией 5 – элонгацией какие из перечисленных антибиотиков тормозят синтез гексапептидов, входящих в состав клеточных мембран и влияют тем самым на синтез клеточной стенки бактерий и их целосность? 1 – тетрациклины 2 – стрептомицины 3 – пеницилины 4 – рифампицины 5 - макролиды | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
