3 и 4 вопросы. Первичная структура белка (псб)
 Скачать 55.03 Kb. Скачать 55.03 Kb.
|
|
+Структурная организация белков. Одной из особенностей белков является их сложная структурная организация. Все белки обладают первичной, вторичной и третичной структурой, а те, которые в своем составе имеют две и больше ППЦ обладают и четвертичной структурой (ЧС). Первичная структура белка (ПСБ) – это порядок чередования (последовательность) аминокислотных остатков в ППЦ. Даже одинаковые по своей длине и аминокислотному составу белки могут быть разными веществами. Например, из двух аминокислот можно составить 2 разных дипептида: 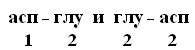 При числе аминокислот, равном 20, число возможных комбинаций равно 21018. А если учесть, что в ППЦ каждая аминокислота может встретиться больше 1 раза, то число возможных вариантов трудно поддается подсчету. Определение первичной структуры белка (псб). ПСБ белков можно определить с помощьюфенилтиогидантоинового метода. Этот метод основан на реакции взаимодействияфенилизотиоцианата (ФИТЦ) с α-АК. В результате образуется комплекс этих двух соединений – ФИТЦ -АК. Например, рассмотрим пептид 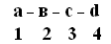 с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков. с целью определения его ПСБ, то есть последовательности соединения аминокислотных остатков.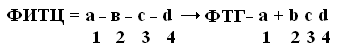 ФИТЦ взаимодействует с концевой аминокислотой (а). Образуется комплекс ФТГ-а, его отделяют от смеси и определяют подлинность аминокислоты а. Например, это – асн 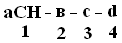 и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев. и т.д. Последовательно отделяют и идентифицируют все остальные аминокислоты. Это трудоемкий процесс. Определение ПСБ белка среднего размера занимает несколько месяцев.А-цепь состоит из 21 аминокислоты, цепь В – из 30. Между собой ППЦ соединяются дисульфидными мостиками. Число белков, ПСБ которых определена, к настоящему времени достигает 1500. Даже небольшие изменения первичной структуры могут существенно изменить свойства белка. В эритроцитах здоровых людей содержится HbA – при замене в -цепи HbA, в 6-м положении глу на валвозникает тяжелейшее заболевание серповидно-клеточная анемия, при которой дети, родившиеся с этой аномалией, погибают в раннем возрасте. С другой стороны, возможны варианты изменения ПСБ, которые не сказываются на его физико-химических и биологических свойствах. Например, HbC содержит в 6-м положении b-цепи вместо глу – лиз, HbС почти не отличается по своим свойствам от HbA, а люди, имеющие в эритроцитах такой Hb, практически здоровы. Стабильность ПСБ обеспечивается в основном прочными ковалентными пептидными связями и, во вторую очередь, дисульфидными связями. Вторичная структура белка (всб). ППЦ белков обладают большой гибкостью и приобретают определенную пространственную структуру или конформацию. В белках различают 2 уровня такой конформации – это ВСБ и третичная структура (ТСБ). ВСБ – это конфигурация ППЦ, то есть способ ее укладки или скручивания в какую-нибудь конформацию, в соответствии с программой, заложенной в ПСБ. Известны три основных типа ВСБ: 1) -спираль; 2) b-структура (складчатый слой или складчатый листок); 3) беспорядочный клубок. -спираль. Ее модель предложена В. Полингом. Она наиболее вероятна для глобулярных белков. Для любой системы наиболее устойчивым является состояние, соответствующее минимуму свободной энергии. Для пептидов такое состояние имеет место, когда CO– и NH– группы соединяются между собой слабой водородной связью. В a-спирали NH– группы 1-го аминокислотного остатка взаимодействует с CO–группой 4-ой по счету аминокислотой. В результате пептидный остов образует спираль, на каждый виток которой приходится 3,6 АК-остатка. 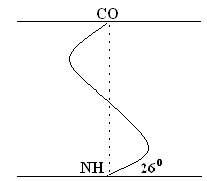 1 шаг спирали (1 виток) = 3,6 АК = 0,54 нм, угол подъема – 26° Закручивание ППЦ происходит по часовой стрелке, то есть у спирали – правый ход. Через каждые 5 витков (18 АК; 2,7 нм) конфигурация ППЦ повторяется. Стабилизируется ВСБ в первую очередь водородными связями, и во вторую – пептидными и дисульфидными. Водородные связи в 10-100 раз слабее обычных химических связей; однако за счет их большого количества они обеспечивают определенную жесткость и компактность ВСБ. Боковые R-цепи a-спирали обращены к наружи и расположены по разные стороны от ее оси. b-структура. Это складчатые участки ППЦ, по форме напоминающие листок, сложенный в гармошку. Слои ППЦ могут быть параллельными, если обе цепи начинаются с N– или С–конца. Если смежные цепи в слое ориентированы противоположными концами N–С и С–N, то они называются антипараллельными. 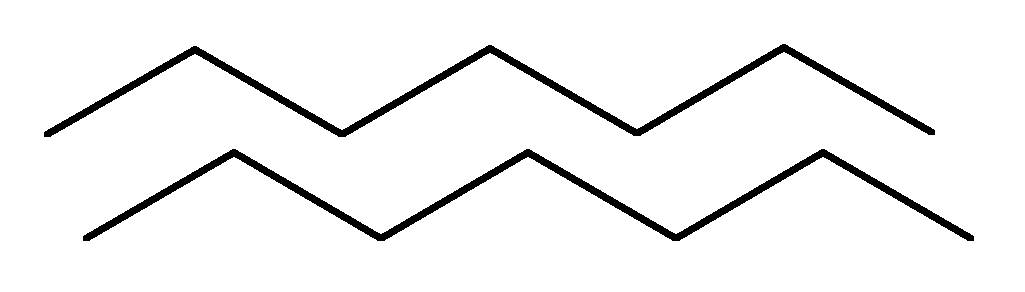  паралельные паралельные антипараллельные антипараллельныеОбразование водородных связей происходит, как и в a-спирали, между CO– и NH– группами. 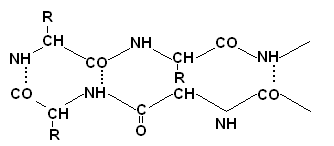 Содержание a-спирали и b-структуры в разных белках неодинаково. Не вся ППЦ уложена в спирали или складчатые слои. Беспорядочный клубок Некоторые участки вообще не имеют какой-либо правильной периодической пространственной конфигурации. Их обозначают какбеспорядочный клубок, однако такие участки имеют свою фиксированную конформацию, которая определяется аминокислотным составом этого участка, а также ВСБ и ТСБ смежных областей, окружающих беспорядочный клубок. В областях беспорядочного клубка ППЦ могут легко изгибаться и изменять свою конфигурацию, в то время как a-спираль и b-структуры представляют собой довольно жесткие структуры. Встречаемость a-спирали и b-структуры в различных белках.
Третьичная структура белка (ТСБ). По форме своих молекул и особенностям пространственной структуры белки делятся на две группы – глобулярные и фибриллярныебелки. Форма глобулярных белков близка к сферической или эллипсоидной, короткая и длинная ось которых может относиться как 1:50. Фибриллы белков более удлиненной формы. Такой белок может образовывать многомолекулярные нитевидные агрегаты – фибриллы. Фибриллярные белки выполняяют в основном опорную функцию. Функции глобулярных белков более разнообразны. ТС глобулярных белков образуется путем дополнительного скручивания ППЦ, содержащей a-спираль, b-структуру и беспорядочные клубки. ТСБ образуется, главным образом за счет взаимодействия R, основную роль при этом играют дисульфидные связи, слабые водородные, ионные связи и особенно гидрофобные. Дисульфидные связи приводят к тому, что удаленные друг от друга области ППЦ сближаются и образуют фиксированные петли. Гидрофобные взаимодействия осуществляются за счет сближения R аминокислот с молекулой воды. Неполярные гидрофобные R, отталкиваясь от водного окружения, как бы втягиваются внутрь белковой молекулы, образуя там так называемые «сухие зоны». А гидрофильные R обращены к наружи образующейся глобулы и ориентированы в сторону воды. Все образующиеся химические связи определены аминокислотным составом и их чередованием в ППЦ. Таким образом, ТСБ – это компактное расположение или упаковка в пространстве одной или нескольких ППЦ в определенном объеме. Все биологические свойства белковой молекулы связаны с сохранностью их ТС, которая называется нативной конфигурацией белка. Глобулярная молекула (глобула) не является абсолютно жесткой структурой. Небольшие изменения конфигурации белковых молекул происходят как внутри самой молекулы (как бы пульсация), так и при взаимодействии с другими молекулами и напоминает изменение формы резинового мяча при надавливании. Денатурация и ренативация белка При разрыве большого числа связей, стабилизирующих белковую молекулу, уникальная для каждого белка конформация нарушается. Такое изменение называетсяденатурацией. Ее можно вызвать при нагревании белка до 60-80С и действии других агентов – детергентов, то есть щелочей, кислот, мочевины, спиртов и т.д. При денатурации растворимость белков ухудшается. Часто белок сворачивается. При денатурации утрачивается биологическая активность белков. В определенных условиях (медленное охлаждение денатурированного нагреванием белка, промывание раствора белка и вымывание из него детергентов) возможна ренативация (ренатурация), то есть восстановление исходной нативной конформации белка. Четвертичная структура белка(ЧСБ). Многие белки построены из 2 и более ППЦ, например гексокиназа содержит 2 ППЦ, HbA – 4 ППЦ, ферритин – 24. Цепи соединяются между собой нековалентными связями. Например, основной белок эритроцитов Hb состоит из 4-х цепей: 2a и 2b. При сравнительно небольших изменениях окружающей среды Hb может диссоциировать на димеры, затем намономеры (или протомеры). 2a2b Димеры и протомеры называются субъединицами. Протомеры – это наименьшие субъединицы. Белки, молекулы которых построены из нескольких ППЦ, называются олигомерами или олигобелками. Количество протомеров, способ их соединения и пространственной укладки относительно друг друга называются ЧСБ. Белки с Mr больше 50 тыс. Да почти всегда являются олигомерными. ЧСБ является такой специфической уникальной характеристикой данного белка, как и другие уровни структурной организации. При соединении друг с другом протомеры взаимодействуют не любой поверхностью, а определенным участком – контактной поверхностью. Если на одной ППЦ (субъединице) имеется выступ, то на другой в соответственном месте имеется углубление. При этом совпадают разноименно заряженные ионные группы, группы, образованные водородной связью, гидрофобные и гидрофильные участки. Такие участки называются комплементарными. Они подходят друг к другу как ключ к замку. Процесс самосборки олигомерных белков отличается высокой специфичностью. Например, если в растворе наряду с протомерами Hb есть и другие белки, они не образуют соединений с Hb. Чаще всего отдельные субъединицы не обладают биологической активностью, белки приобретают эту способность при соединении протомеров в олигомер. Однако только Э. Фишер (1902) сформулировал полипептидную теорию строения. Согласно этой теории, белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии α-карбоксильных СООН- и α-NН2-групп аминокислот. На примере взаимодействия аланина иглицина образование пептидной связи и дипептида (с выделением молекулы воды) можно представить следующим уравнением: 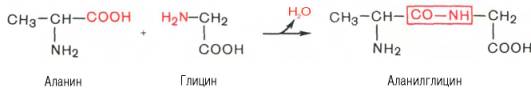 Аналогичным способом к дипептиду могут присоединяться и другие аминокислоты с образованием три-, тетра-, пентапептида и т.д. вплоть до крупной молекулы полипептида (белка). Наименование пептидовскладывается из названия первой N-концевойаминокислоты со свободной NH2-группой (с окончанием -ил, типичным для ацилов), названий последующих аминокислот (также с окончаниями -ил) и полного названия С-концевой аминокислоты со свободной СООН-группой. Например, пентапептид из 5 аминокислот может быть обозначен полным наименованием: глицил-аланил-серил-цистеинил-аланин, или сокращенно Гли–Ала–Сер–Цис–Ала. Химический синтез полипептидов и современные физико-химические методы исследования белковполностью подтвердили существование пептидных связей в структуре белка. Получены следующие экспериментальные доказательства полипептидной теории строения белка. 1. В природных белках сравнительно мало титруемых свободных СООН- и NH2-групп, поскольку абсолютное их большинство находится в связанном состоянии, участвуя в образовании пептидных связей; титрованиюдоступны в основном свободные СООН- и NН2-группы у N- и С-концевых аминокислот пептида. 2. В процессе кислотного или щелочного гидролизабелка образуются стехиометрические количества титруемых СООН- и NH2-групп, что свидетельствует о распаде определенного числа пептидных связей. 3. Под действием протеолитических ферментов(протеиназ) белки расщепляются на строго определенные фрагменты, называемые пептидами, с концевыми аминокислотами, соответствующими избирательности действия протеиназ. Структура некоторых таких фрагментов неполного гидролизадоказана последующим химическим их синтезом. 4. Биуретовую реакцию (сине-фиолетовое окрашивание в присутствии раствора сульфата меди в щелочной среде) дают как биурет, содержащий пептидную связь, так и белки, что также является доказательством наличия в белках аналогичных связей. 5. Анализ рентгенограмм кристаллов белковподтверждает полипептидную структуру белков. Таким образом, рентгеноструктурный анализ при разрешении 0,15–0,2 нм позволяет не только вычислить межатомные расстояния и размеры валентных углов между атомамиС, Н, О и N, но и «увидеть» картину общего расположения аминокислотных остатков в полипептидной цепи и пространственную ее ориентацию (конформацию). 6. Существенным подтверждением полипептидной теории строения белка является возможность синтеза чисто химическими методами полипептидов и белков с уже известным строением: инсулина – 51 аминокислотный остаток, лизоцима – 129 аминокислотных остатков, рибонуклеазы – 124 аминокислотных остатка . Синтезированные белкиобладали аналогичными природным белкам физико-химическими свойствами и биологической активностью. Полипептидная теория строения не отрицает существования в молекуле белка и других связей, включая ковалентные (например, дисульфидные —S—S-связи) и нековалентные (например, водородные связии др.). Они будут рассмотрены далее. |
