ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
|

|
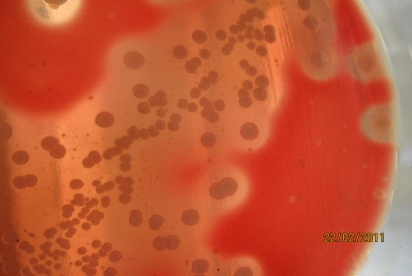
КРОВЯНОЙ АГАРпитательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
|
|
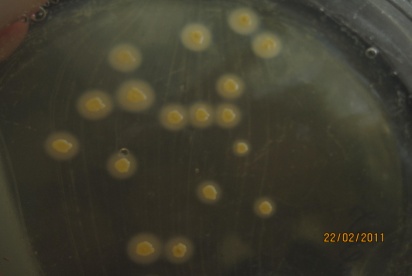
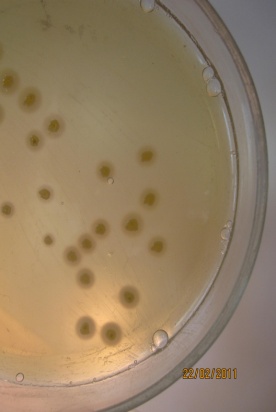
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА- селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
|
|
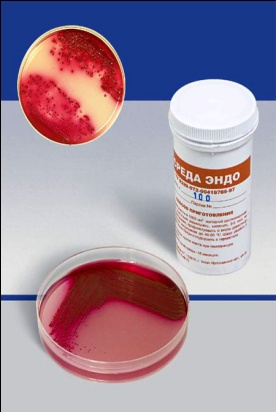
СРЕДА ЭНДОпредназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
|

|
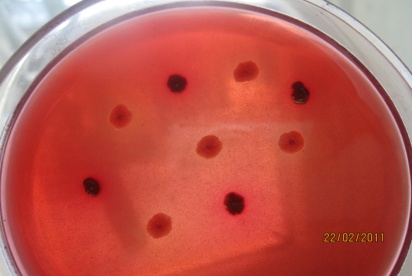
СРЕДА ПЛОСКИРЕВА– дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
|

Пестрый ряд Гисса для E.Coli
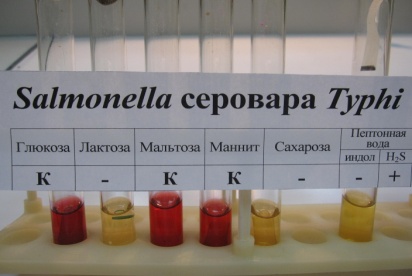
Пестрый ряд Гисса для S.typhi
|
СРЕДЫ ГИССАдифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет. В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
|
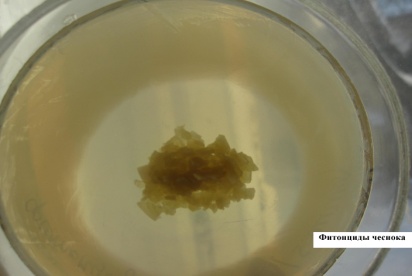
Фитонциды чеснока
|
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
|

|
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
|

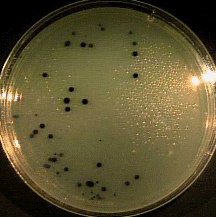
Железо-сульфитный агар
|
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР)используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии(Clostridium perfringens)образуют на среде колонии черного цвета за счет образования соединений железа с серой.
|
Совместное культивирование аэробов и анаэробов
|
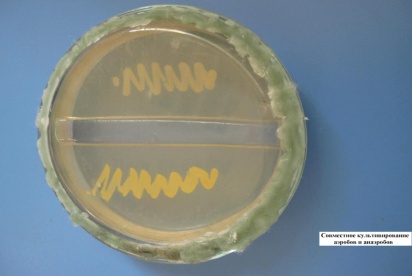
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
|
метод Отто
|
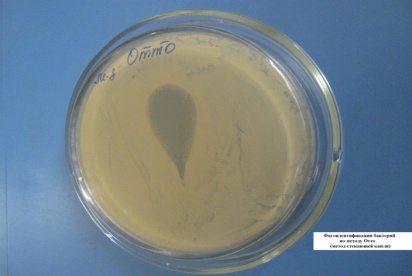
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
|
метод Фишера
|
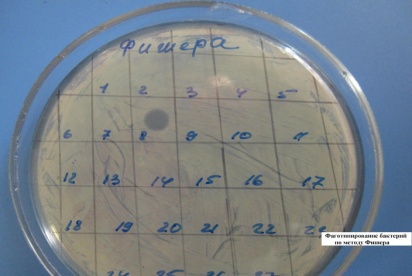
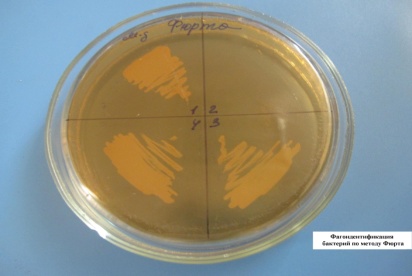
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
|
метод Фюрта
|
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
|
метод Грация
|
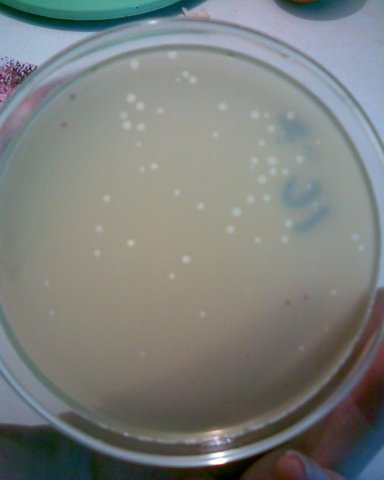
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
|
метод бумажных дисков
|
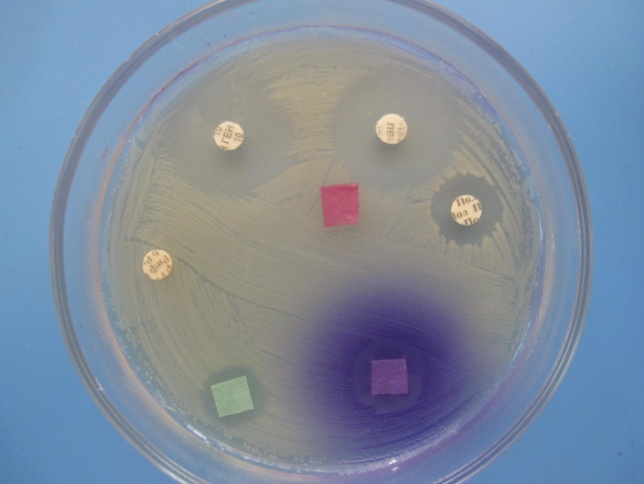
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.
|
|
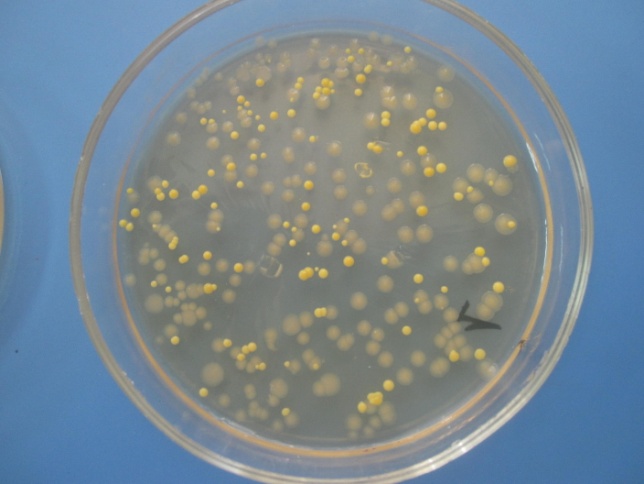
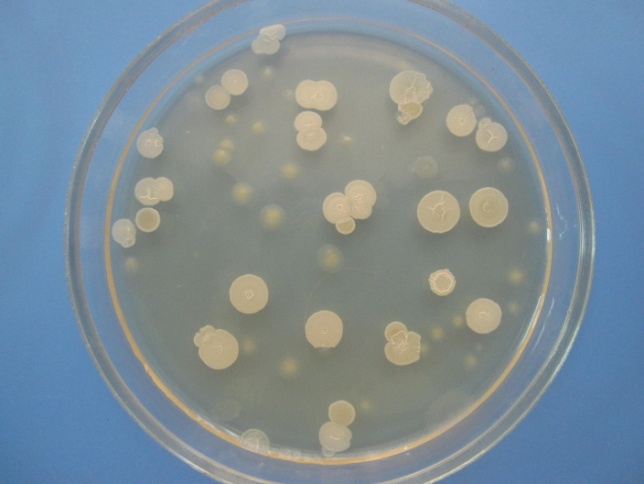
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
|
 Скачать 0.75 Mb.
Скачать 0.75 Mb.