материал.КР вариант 6. Плеханов И. А
 Скачать 1.18 Mb. Скачать 1.18 Mb.
|
Контрольная работаВариант 6 Выполнил: Плеханов И.А. гр. СРТ б (до)3-15-1 ОГЛАВЛЕНИЕВопрос 1. Дайте определение следующим понятиям: 6. Кристаллизация, кристаллит, модифицирование, предел прочности 3 Вопрос 2. Начертите диаграмму железо-цементит, укажите структуры во всех областях и постройте кривые охлаждения для сплавов с заданным количеством углерода (в %). Все получающиеся структуры охарактеризуйте: 21) 0.6%, 3.3% 9 2.1 Сплав с 3,3% углерода 9 2.2 Сплав с 0,6% углерода 14 Вопрос 3. Для заданных материалов приведите состав, свойства и примеры применения: 36) 30ХН2МФА, Р18, 08Х18Н10Т, ЮНДК15, ЛМцА-57-3-1, АК4, капрон. 19 Вопрос 1. Дайте определение следующим понятиям: 6. Кристаллизация, кристаллит, модифицирование, предел прочностиКристаллизация – это переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое. Кристаллизация относится к фазовым переходам первого рода. Кристаллизация расплавленного металла происходит не при температуре равновесия жидкой и твердой фаз, а при более низких температурах. То же самое относится и к превращениям в твердом состоянии. Температура превращения при охлаждении лежит ниже, чем температура обратного фазового превращения при нагревании. Это явление называется тепловым гистерезисом превращения. Например, белое олово превращается в серое только при сильных морозах, хотя температура равновесия белой и серой модификаций равна +13°С. Разность между температурой устойчивого равновесия двух фаз (T0) и фактической температурой превращения при охлаждении называется степенью переохлаждения (ΔТ). Степень переохлаждения растет с увеличением скорости охлаждения. Следовательно, переохлаждение связано с какими-то затруднениями в фазовом превращении. Основоположник научного металловедения Д. К. Чернов во второй половине прошлого столетия отметил, что процесс затвердевания стали состоит из двух стадий: образования центров кристаллизации («зачатков» — по терминологии Чернова) и роста кристаллов из этих центров. Позднее немецкий металловед Г. Тамман установил количественные характеристики для двух стадий кристаллизации - число центров, возникающих в единицу времени в единице объема, т. е. скорость зарождения центров (с. з. ц.), и линейную скорость роста кристаллов из этих центров (л. с. р.). Тамман переохлаждал прозрачные органические жидкости до различных температур и определял при разных переохлаждениях скорость зарождения центров и линейную скорость роста кристаллов. Было установлено, что эти характеристики зависят от степени переохлаждения. При температуре равновесия жидкой и твердой фаз с. з. ц. и л. с. р. равны нулю. С увеличением переохлаждения обе характеристики растут, достигают максимума и при больших переохлаждениях падают до нуля. Графики зависимости скорости зарождения центров кристаллизации и линейной скорости роста кристаллов от переохлаждения называют кривыми Таммана. Позднее было установлено, что кристаллизационные процессы образования фаз в твердом состоянии подчиняются тем же общим закономерностям, что и процессы кристаллизации жидкости. На рисунках 1.1 и 1.2 показаны кривые Таммана для полиморфного превращения олова и эвтектоидного распада в стали. Скорость элементарных процессов кристаллизации зависит от степени переохлаждения и от скорости охлаждения металла (рис. 1.3). Как следует из зависимостей на рис. 1.3, при малых степенях переохлаждения в условиях медленного охлаждения(V1) в жидкости образуется небольшое число зародышей, и из них вырастает небольшое количество кристаллов (зерен). В этом случае структура металла получается крупнозернистая (см. рис. 1.4а). Если же процесс кристаллизации идет в условиях быстрого охлаждения (V2 на рис. 1.3), то скорость образования центров кристаллизации большая, в первые моменты времени образуется большое число зародышей, из которых вырастает много кристаллов. Тогда металл получается мелкозернистый (рис.1.4 б- показана структура в начале и в конце затвердевания). 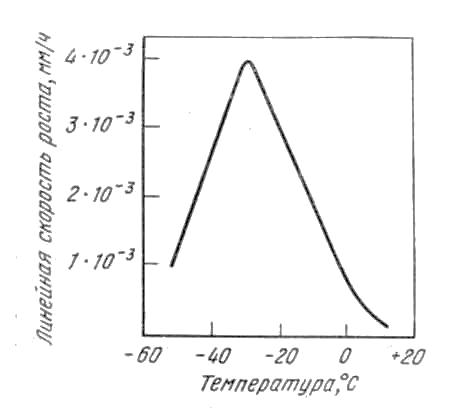 Рис. 1.1 - Линейная скорость роста серого олова на поверхности белого при разных температурах (Г. Тамман). 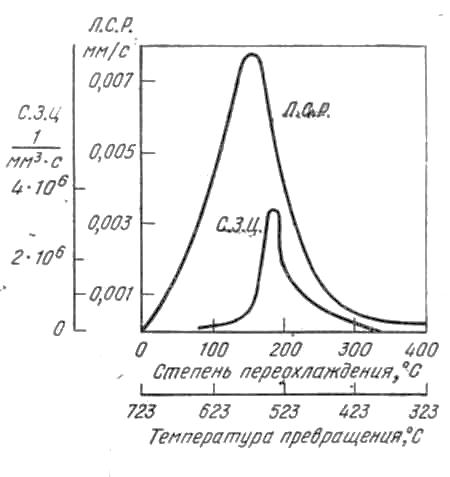 Рис. 1.2 - Зависимость скорости зарождения центров и линейной скорости роста перлитных колоний от степени переохлаждения в стали с 0,8% С (по Я. Л. Миркину) 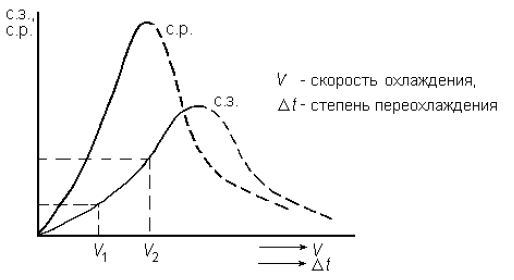 Рис. 1.3 - Зависимость скорости образования зародышей (с. з.) и скорости роста кристаллов (с. р.) от степени переохлаждения  Рис. 1.4. Формирование структуры металла при кристаллизации: а – медленное охлаждение; б – быстрое охлаждение Кристаллит – твердое тело микронных или субмикронных размеров, представляющее собой трехмерную периодическую решетку из атомов, ионов или молекул, ограниченное замкнутой поверхностью, за пределами которой изменена или нарушена ориентация кристаллической решетки, либо находится газообразная, жидкая фаза или вакуум. Кристаллиты нанометровых размеров хотя бы в одном измерении называют нанокристаллитами. Кристаллит, имеющий по границам прочные связи с другими кристаллитами, является частью твердого поликристаллического тела. Кристаллит, входящий в состав керамики и имеющий отчетливые границы, наблюдаемые при помощи оптической или электронной микроскопии, обычно называется зерном. При кристаллографических исследованиях часто используется близкий по значению термин «область когерентного рассеяния» (ОКР). Модифицирование – получение отливок и слитков с мелкозернистым строением. Конечной задачей модифицирования является повышение механических, технологических и эксплуатационных свойств отливок, слитков, а также получаемых из них изделий и полуфабрикатов посредством измельчения литой структуры. Дисперсность литой структуры характеризуется расстоянием между осями первого порядка или размером, так называемого, литого зерна. Последнее представляет собой визуально выделяемую на шлифе область, отличающуюся от соседних участков цветовым оттенком и имеющую выраженные границы. Литые зерна формируются в отличающихся теплофизических условиях, различие в которых обуславливает иное направление и возможно значение градиента температур и, соответственно, направление роста твердой фазы; на стыке подобных участков скапливается повышенное количество ликватов и дефектов кристаллической решетки, что и обуславливает повышенную травимость этих мест и, соответственно, возможность их визуальной идентификации. Модифицирование – один из наиболее эффективных методов воздействия на процессы первичной кристаллизации и изменения степени дисперсности кристаллизующихся фаз путем введения в расплав малых добавок отдельных элементов или их соединений с целью получения благоприятной структуры графита и матрицы. Другими словами, в процессе модифицирования происходит искусственное изменение структуры расплава или образование центров кристаллизации под воздействием специально вводимых добавок. Следует отметить, что общим для всех методов модифицирования является то, что эффект воздействия имеет свойство исчезать через определенный промежуток времени в ходе выдержки расплава за счет перехода из термодинамически неравновесного состояния в равновесное. Исходя из этого, для достижения максимального эффекта необходимо стремиться к реализации процесса обработки на поздних стадиях получения отливок. Предел прочности или временное сопротивление разрыву - механическое напряжение, выше которого происходит разрушение материала. Определяется по зависимости: где 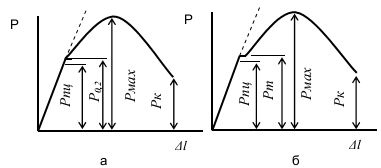 Рис. 1.5 – Диаграмма растяжения без площадки текучести (а) и с площадкой текучести (б) Временное сопротивление разрушению, то есть напряжение, соответствующее наибольшему усилию, предшествующему разрыву образца при (статических) механических испытаниях. Термин происходит от того представления, что материал может бесконечно долго выдержать любую статическую нагрузку, если она создаёт напряжения, меньшие по величине, чем временное сопротивление. Вопрос 2. Начертите диаграмму железо-цементит, укажите структуры во всех областях и постройте кривые охлаждения для сплавов с заданным количеством углерода (в %). Все получающиеся структуры охарактеризуйте: 21) 0.6%, 3.3% 2.1 Сплав с 3,3% углеродаЧугунами называются сплавы железа с углеродом с содержанием углерода от точки Е до точки F. Различают белые, серые, ковкие, высокопрочные чугуны. В белых чугунах весь углерод находится в связанном виде, т.е. в виде Fe3C, в связи с этим излом таких чугунов светлый, кристаллический, от сюда и название – белый чугуны. Таким образом, если в задании фигурирует сплав с 3,3%С, кристаллизация которого идет в соответствии метастабильной диаграммой железо-цементит, то речь идет о белом чугуне. Если же кристаллизация идет в соответствии со стабильной диаграммой, то углерод находится в чугуне в свободном состоянии – в виде графита, а сплав с 3,3% С называется серый чугун. Рассмотрим кристаллизацию белого чугуна. На рис. 2.1 на горизонтальных линиях диаграммы железо-углерод происходят нонвариантные превращения: на линии HJB – перитектической превращение LB+δH↔Aj на линии ECF – эвтектическое превращение LC↔αE+Fe3C на лини ECF – эвтектоидное превращение AS+ αP ↔ Fe3C Относительно эвтектической точки С белые чугуны разделяют на: эвтектические 4,3%С доэвтектические – от точки E до точки C 2,14…4,3%С заэвтектические – от точки C до точки F 2,14…4,3%С 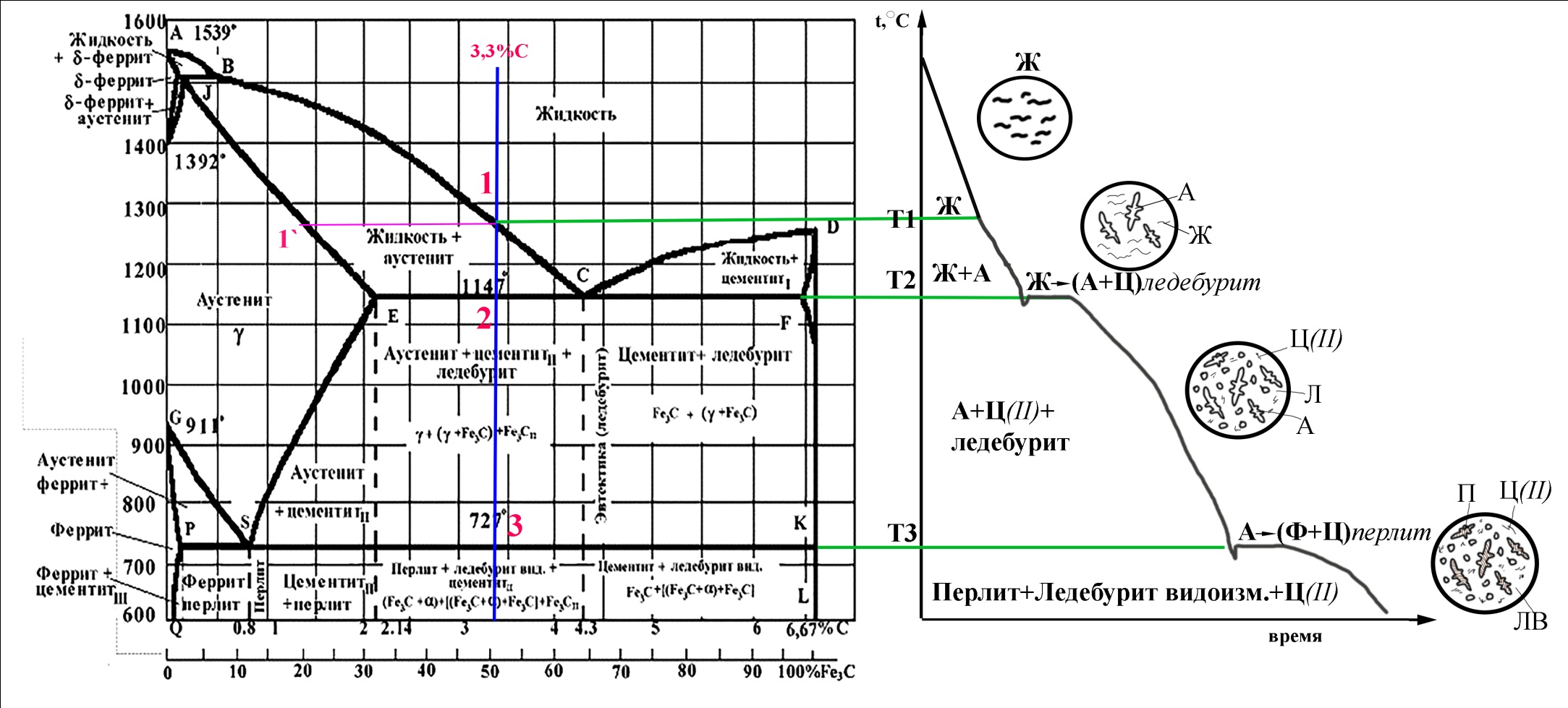 а) б) Рис. 2.1 – Положение сплава с 3,3%С на диаграмме состояние Fe-C (а) и кривая его охлаждения (б) Чугун с 3,3%С относится к доэвтектическим. Рассмотрим процессы, происходящие при охлаждении его расплава. Положение сплава на диаграмма и кривая его охлаждения представлены на рис. 2.1. Вначале сплав находится в виде расплава. При некотором переохлаждении ниже температуры точки 1 начинается кристаллизация: из жидкости появляются первые кристаллы аустенита. Как правило, аустенит кристаллизуется в виде дендритов, что показано на схеме микроструктуры (возле кривой охлаждения на рис. 2.1 б). При охлаждении ниже Т1 из жидкости начинают выпадать первые кристаллы Аустенита. Нужно подчеркнуть условной такой формулировки, поскольку кристаллизация в принципе не может начаться при температуре T1, т.к. для этого не обходимо переохлаждение расплава ниже кривой ликвидуса. Правильнее было бы говорить о том, что при понижении температуры ниже T1 на ΔT первые кристаллы выделятся из жидкости, состав которых будет отличаться от т.1. Изложенное справедливо и для твердофазных превращений. В условиях равновесия кристаллизация сплава не начнется при температуре T1 и не закончится при T2. Для протекания процесса кристаллизации рассматриваемую систему необходимо все время выводить из состояния равновесия, т.е. переохлаждать жидкую фазу ниже кривой ликвидуса, обеспечивая тем самым термодинамический стимул превращения Ж→А. Только в этих условиях процесс кристаллизации будет реакцией системы на нарушение равновесия. При дальнейшем анализе сплава это рассуждение не приводится, но справедливо в любом случае. В температурном интервале T1-T2 сплав находится в двухфазной области. Равновесный состав жидкости изменяется в этом интервале по линии 1С – по ликвидусу (т.е. падает содержание железа в жидкости и увеличивается содержание углерода), а равновесный состав твердого раствора аустенита изменяется по линии 1`Е – по солидусу. На кривой охлаждения сплава будет перегиб при переходе в двухфазную область. Это можно объяснить правилом фаз. Связь между числами компонентов k, количеством равновесных фаз ф, температурой, давлением и вариантностью в (или числом степеней свободы) любо равновесной системы устанавливает правило фаз Гиббса: в=k-ф+n где n – внешние факторы равновесия, т.е. температура и давление. Таким образом, равновесие Ж↔А моновариантно и реализуется в интервале температур кристаллизации: в= k -ф+1=2-2+1=1 В процессе охлаждения сплав достигает температура т.2, которая лежит на линии ЕCF – линии эвтектического равновесия. В этой точке наблюдается равновесие жидкости, аустенита и цементита, т.е. в этой точке система находится в нонвариантном равновесии: в= k -ф+1=2-3+1=0 а на кривой охлаждения наблюдается площадка. Поскольку для начала превращения требуется термодинамический стимул, то на кривой охлаждения может наблюдаться участок возврата от более низкой температуры к площадке с постоянной температурой. При температуре 1147С реализуется эвтектическая реакция: LC→AC+Fe3C Результатом реакция является образование из жидкости эвтектической смеси: мелкие зерна аустенита равномерно распределены в объеме цементита. Эвтектика носит специальное название – ледебурит. При охлаждении в интервале Т2-Т3 состав аустенита изменятся по сольвусу ES, т.е. содержание углерода в нем уменьшается, поэтому избыточный углерод образует вторичный цементит. Следовательно, структурный состав в этом интервале температур – аустенит (не участвовавший в эвтектической реакции), ледебурит, цементит вторичный. При температуре т.3 727ºС сплав находится в точке эвтектоидного равновесия. Это превращение также нонвариантное. При некотором переохлаждении относительно т.3 происходит превращение аустенита (и свободного, и в ледебурите) в перлит – колонии феррита и цементита. Ледебурит после превращения аустенита, входящего в него в перлит, носит название видоизменённого ледебурита. При охлаждении до комнатной температуры химический состав феррита изменяется в соответствии с сольвусом PQ – т.е. содержание углерода в нем незначительно снижается, поэтому создаются условия для выпадения мельчайший выделений третичного цементита, но увидеть его в оптический микроскоп нельзя. Поэтому часто его не обозначают на схемах микроструктур. Коечный состав чугуна: фазовый – цементит + феррит, структурный – перлит + цементит вторичный + видоизмененный ледебурит. По правилу отрезков легко установить содержание этих компонент. Фазовый состав: Структурный состав: На рис. 2.2 приведена фотография доэвтектического белого чугуна.  Рис. 2.2 – Фотография микроструктуры белого чугуна с 3,3%С Белый чугун не маркируют, он малопластичен, имеет твердость 35-55 HRC и используется для деталей, работающих в условиях абразивного износа без ударных нагрузок. 2.2 Сплав с 0,6% углеродаСплав, содержащий 0,6%С называется доэвтектоидной сталью. На рис. 2.3 представлено положение этой стали на диаграмме состояния Fе-Fe3C и кривая его охлаждения. Выше температуры т.1 сплав находится в жидком состоянии. При охлаждении из жидкого состояния кривая охлаждения идет достаточно резко вниз (охлаждение идет интенсивно), по достижении температуры точки т.1 на кривой охлаждения наблюдается перегиб и далее кривая становится более пологой. Природа этого перегиба на кривой охлаждения объясняется с помощью правила фаз. Связь между числами компонентов k, количеством равновесных фаз ф, температурой, давлением и вариантностью в (или числом степеней свободы) любо равновесной системы устанавливает правило фаз Гиббса:  а) б) Рис. 2.3 – Положение сплава с 0,6%С на диаграмме состояние Fe-C (а) и кривая его охлаждения (б) в=k-ф+n где n – внешние факторы равновесия, т.е. температура и давление. Согласно этому правилу, равновесие Ж↔А при температуре т.1 моновариантно: в= k -ф+1=2-2+1=1 При охлаждении ниже т.1 из жидкости начинают выпадать первые кристаллы твердого раствора аустенита. Нужно подчеркнуть условной такой формулировки, поскольку кристаллизация в принципе не может начаться при температуре т.1, т.к. для этого не обходимо переохлаждение расплава ниже кривой ликвидуса. Правильнее было бы говорить о том, что при понижении температуры ниже т.1 на ΔT первые кристаллы выделятся из жидкости, состав которых будет отличаться от т.1. Изложенное справедливо и для твердофазных превращений. В условиях равновесия кристаллизация сплава не начнется при температуре т.1 и не закончится при т.2. Для протекания процесса кристаллизации рассматриваемую систему необходимо все время выводить из состояния равновесия, т.е. переохлаждать жидкую фазу ниже кривой ликвидуса, обеспечивая тем самым термодинамический стимул превращения Ж→А. Только в этих условиях процесс кристаллизации будет реакцией системы на нарушение равновесия. При дальнейшем анализе сплавов это рассуждение не приводится, но справедливо в любом случае. В температурном интервале т.1-т.2 сплав находится в двухфазной области. Равновесный состав жидкости изменяется в этом интервале по линии 12` – по ликвидусу (т.е. падает содержание Fe в жидкости и увеличивается содержание C, а равновесный состав твердого раствора изменяется по линии J2– по солидусу. Аустенита – это твердый раствор углерода в γ-железе По достижении т.2 кристаллизация завершена, а жидкость полностью кристаллизуется в аустенит. На кривой охлаждения снова наблюдается перегиб (моновариантное равновесие). В температурном интервале т.2-т.3 сплав однофазен, структура состоит только из аустенита. По достижении температуры т.3 из аустенита начинают выделяться частицы α-феррита. В интервале температур т.3-.т.4 сплав находится в двухфазной области. Состав аустенита изменятся по линии 3S. В т.4 сплав находится на линии нонвариантного эвтектоидного равновесия PSK=723°С, поэтому на кривой охлаждения наблюдается температурная остановка: в= k -ф+1=2-3+1=0 Следовательно, такое равновесие возможно только при постоянной температуре. При некотором переохлаждении ниже т.4 происходит эвтектоидное превращение А→(Ф+Ц)перлит, в результате которого образуется эвтектоид – смесь феррита и цементита, которая в стали названа перлитом. После полного остывания фазовый состав стали с 0,6%С – феррит и цементит, структурный состав – феррит и перлит. При комнатной температуре сталь с 0,6%С имеет структурный состав: феррит и перлит, фазовый состав: феррит и цементит. На рис. 2.4 приведена фотография микроструктуры стали 0,6 %С.  Рис. 2.4 – Сталь с 0,6%С после медленного охлаждения По правилу отрезков легко установить содержание этих компонентов. Фазовый состав: Структурный состав: Схемы микроструктур приведены на рис. 2.3 (б). Вопрос 3. Для заданных материалов приведите состав, свойства и примеры применения: 36) 30ХН2МФА, Р18, 08Х18Н10Т, ЮНДК15, ЛМцА-57-3-1, АК4, капрон.Сталь 30ХН2МФА – сталь конструкционная, содержит 0,3% углерода, легированная хромом, никелем, молибденом и ванадием, высококачественная. Химический состав приведен в таблице 3.1. Таблица 3.1 - Химический состав в % стали 30ХН2МФА по ГОСТ 4543 - 71 C Si Mn Ni S P Cr Mo V Cu |
