Гидролиз. По катиону, по аниону или нет гидролиза
 Скачать 483.71 Kb. Скачать 483.71 Kb.
|
|
Гидролиз Гидролиз (греч. hydor - вода и lysis - разрушение) - процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды. В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает "слабое" - это правило вам очень пригодится.  Любая соль состоит из остатка основания и кислоты. Абсолютно любая: NaCl - производное основания NaOH и кислоты HCl KNO3 - производное основания KOH и кислоты HNO3 CuSO4 - производное основания Cu(OH)2 и кислоты H2SO4 Al3PO4 - производное основания Al(OH)3 и кислоты H3PO4 Ca(NO2)2 - производное основания Ca(OH)2 и кислоты HNO2 Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие - сильными. При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт - она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем ;-) 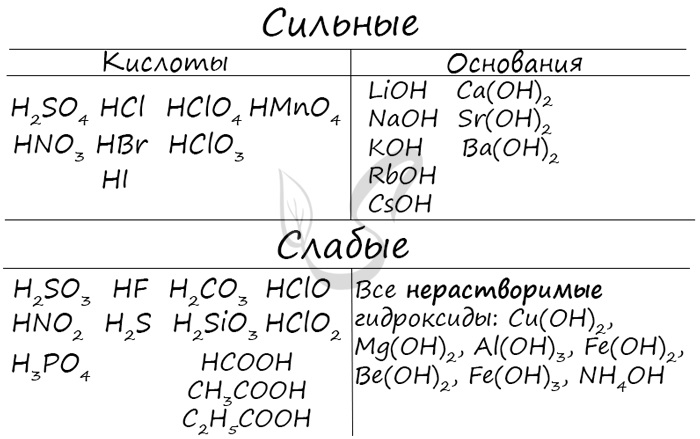 По катиону, по аниону или нет гидролиза? Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты - гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3. Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае - катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3. Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит. Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3. Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4. 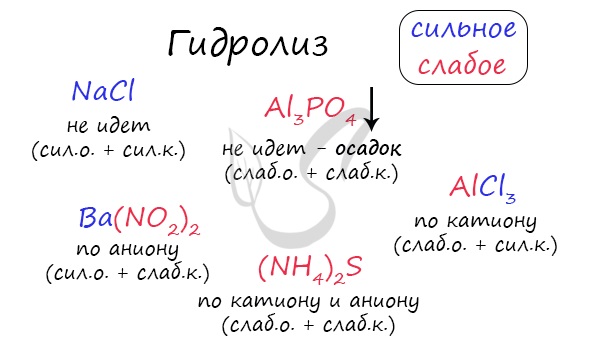 Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2. Ниже вы найдете решение. 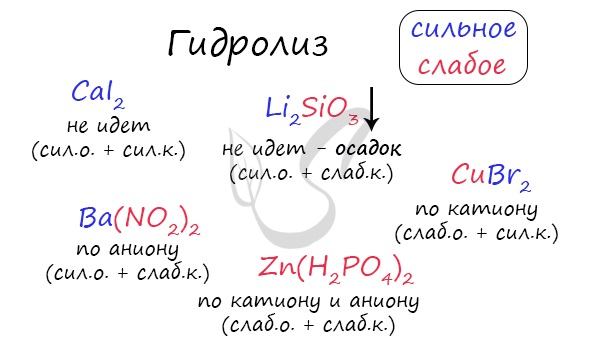 Среда раствора Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора. Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора - нейтральная. Если гидролиз идет по катиону (разрушается остаток основания) среда - кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры. Однако замечу, что в дигидрофосфатах, гидрофосфатах гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, NaHSO3, LiHSO4. 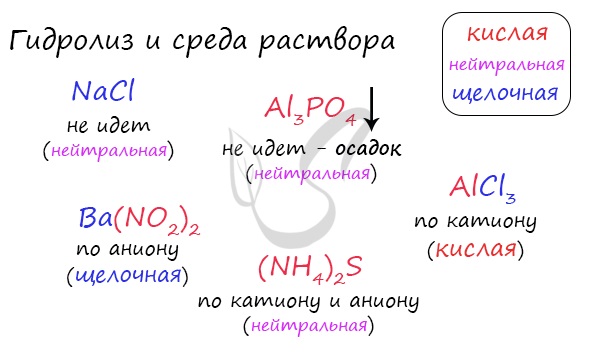 Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.  С целью запутать в заданиях часто бывают даны синонимы. Так "среду раствора" могут заменить водородным показателем pH. Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7. 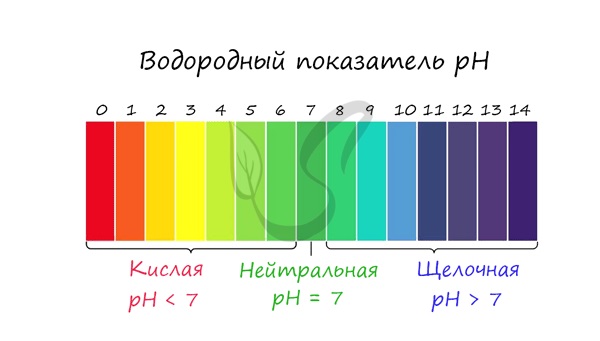 Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 - кислой (pH < 7). Индикаторы (лат. indicator - указатель) Индикатор - вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен менять его цвет, что наглядно отражает характер среды в определенный момент времени. Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды раствора их окраска меняется, что отражает приведенная ниже таблица. 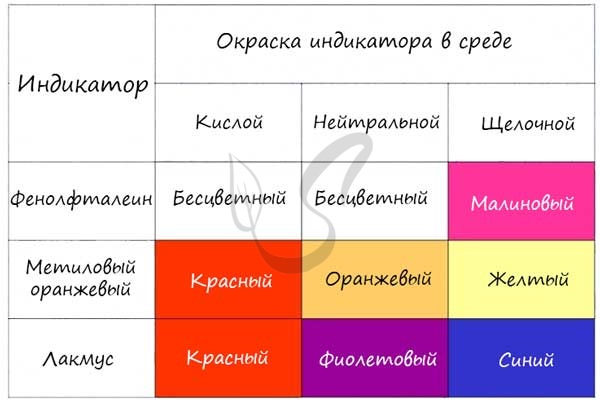 Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? :) От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую запомнить индикаторы по стихам. Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет настроение ;) Лакмус Индикатор лакмус красный Кислоту укажет ясно. Индикатор лакмус синий - Щелочь здесь, не будь разиней! Когда ж нейтральная среда, Он фиолетовый всегда. Фенолфталеин Фенолфталеиновый В щелочах малиновый Несмотря на это - В кислотах он без цвета. Метиловый оранжевый От щелочи я желт как в лихорадке Я розовею от кислот, как от стыда И я бросаюсь в воду без оглядки - Здесь я оранжевый практически всегда!  |
