Химия менделеев реферат. Химия реферат 17 декабря. Почему периодическая таблица элементов Д. И. Менделеева называется квантовомеханической моделью строения атома
 Скачать 98.68 Kb. Скачать 98.68 Kb.
|
|
НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ АРХИТЕКРУНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ. КАФЕДРА ВОДОСНАБЖЕНИЯ, ВОДООТВЕДЕНИЯ, ИНЖЕНЕРНОЙ ЭКОЛОГИИ И ХИМИИ. Реферат по химии. Тема : Почему периодическая таблица элементов Д.И.Менделеева называется квантово-механической моделью строения атома? Выполнил студент Группа: ТЭ-12 Донской К.Д Введение: Таблица Менделеева - первое, с чем сталкивается любой изучающий химию. Периодический закон позволил не только объяснить корреляцию химических свойств элементов, но и предсказать существование новых, не открытых ещё элементов. Несмотря на то, что не всеми учёными Периодический закон был воспринят сразу же, в очень скором времени он был всемирно признан, как и заслуги Дмитрия Ивановича. И в настоящее время его закон пользуется всемирной популярностью; он не только не устарел, но продолжает находить применение при интерпретации сравнительно недавно установленных экспериментально явлений и развитии новых научных теорий, в полном соответствии со словами . В то же время, все химические явления, для описания которых привлекается Периодический закон, могут быть описаны и объяснены с позиции современных представлений о строении атома. Как известно, теоретической основой современной химии является квантовая механика – раздел физики, описывающий поведение микрочастиц. Гениальность прозрения Менделеева заключается в том, что он открыл Периодический закон эмпирическим путем; на основании сопоставления свойств различных элементов. Когда Менделеев открыл свой закон, квантовая механика ещё не существовала, по крайней мере, в виде законченной, стройной теории. Таблица Менделеева с точки зрения квантово-механической модели атома: 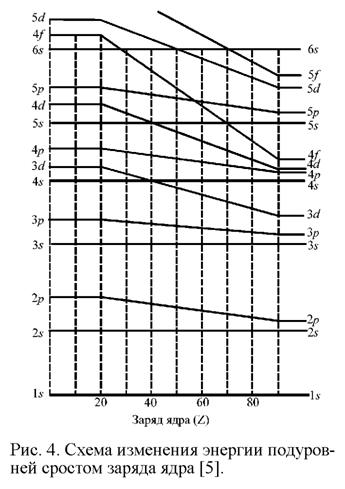 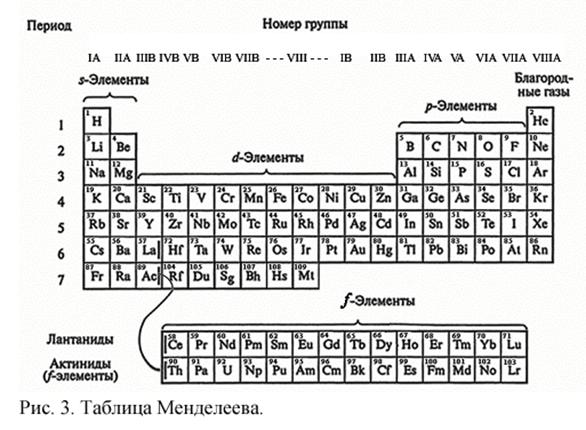 На рис. 3 показана длиннопериодная форма таблицы Менделеева, более удобная для квантово-механической интерпретации Периодического закона. Как упоминалось выше, состояние электрона в многоэлектронном атоме описывается четырьмя квантовыми числами – n, l, m и s. Кроме того, электроны в многоэлектронном атоме подчиняются принципу Паули и правилу Хунда. Принцип Паули гласит, что в одном атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Правило Хунда утверждает, что в пределах одного подуровня электроны располагаются по орбиталям таким образом, чтобы их суммарный спин был максимальным, иными словами, в пределах одного подуровня электроны распределяются так, чтобы число неспаренных электронов было максимальным. И, наконец, третьим принципом, в соответствии с которым происходит распределение электронов по орбиталям, является принцип наименьшей энергии (правило Клечковского): в атоме каждый электрон занимает тот подуровень, на котором его энергия будет минимальной. На рис. 4 представлена схема изменения энергии подуровней в зависимости от заряда ядра. Энергия электрона в многоэлектронном атоме определяется в основном главным квантовым числом n, в меньшей степени она зависит от орбитального квантового числа l. В отсутствие внешнего магнитного поля орбитали с одним и тем же значением n и l, если их несколько, имеют одинаковую энергию – говорят, что они вырождены. Рассмотрим, каким образом происходит заполнение электронами энергетических уровней атомов по мере роста заряда ядра. У элементов первого периода электроны располагаются на уровне с главным квантовым числом n = 1. Орбитальное квантовое число l при этом может принимать только одно значение, равное нулю, т. е. у элементов первого периода все электроны расположены на 1s орбитали, причем их не может быть более двух в соответствии с принципом Паули. Электронные формулы для водорода и гелия выглядят следующим образом: 1s1 и 1s2, т. е. у водорода на 1s орбитали расположен один электрон, а у гелия – два. У элементов второго периода происходит заполнение энергетических уровней, соответствующих главному квантовому числу n = 2. При n = 2 орбитальное квантовое число l может принимать уже два значения: 0 и 1, что соответствует s - и p-орбиталям, причем p-орбиталей три. Восемь элементов второго периода как раз соответствуют последовательному заполнению электронами энергетического уровня с n = 2. В пределах одно подуровня (одного и того же значения l = 1, соответствующего трем p-орбиталям) электроны распределяются таким образом, чтобы их суммарный спин был максимален, т. е. сначала по одному электрону занимают px-, py - и pz-орбитали (у азота), а затем уже к ним добавляется по второму электрону, причем спин второго электрона антипараллелен спину первого, в соответствии с принципом Паули. Таким образом, видно, что номер периода в таблице Менделеева соответствует главному квантовому числу верхнего уровня, на котором имеются электроны – поразительное совпадение, ведь Менделеев открыл Периодический закон на век раньше, чем была создана квантовая механика. Однако почему в третьем периоде всего восемь элементов, тогда как при n = 3 максимальное количество электронов равно 18? Объяснение этого дает схема, приведенная на рис. 4 и правило Клечковского: энергия 4s-орбитали ниже, чем энергии 3d-орбиталей, поэтому сначала происходит заполнение 4s-орбитали, а затем уже заполняются 3d-орбитали. 3d-орбитали лежат глубже, чем 4s-орбитали, поэтому свойства переходных элементов во многом сходны; так, все они проявляют химические и физические свойства, характерные для металлов. Именно поэтому Менделеев поместил их в побочные группы периодической системы. Еще сильнее «запаздывает» заполнение f-орбиталей, поэтому f-элементы выделены в два семейства – лантаноиды и актиноиды, химические свойства которых очень сходны. Квантовая механика объясняет, почему химические свойства элементов одной и той же группы сходны в пределах подгруппы – очевидно, потому, что в пределах одной и той же подгруппы элементы имеют одну и ту же конфигурацию внешних электронных оболочек, которые как раз и наиболее важны для химии, поскольку именно перераспределение электронов внешних электронных оболочек атомов и позволяет им объединяться в молекулы. Объясняет она и изменение свойств элементов в пределах одного периода или одной группы. Поскольку все элементы стремятся к получению стабильной внешней электронной оболочки, подобной электронной оболочке инертных газов, те из элементов главных подгрупп, которые расположены ближе к концу периода, легче достраивают свои электронные оболочки, принимая электроны от других атомов, те же из них, что расположены ближе к началу периода, легче обнажают свои внутренние заполненные оболочки, отдавая электроны. В пределах главной подгруппы металлические свойства увеличиваются, а неметаллические ослабляются сверху вниз, что связано с тем, что электроны внешних оболочек все сильнее экранируются внутренними электронными оболочками. При детальном изучении распределения электронов у d - и f-элементов оказалось, что полностью и наполовину заполненные d - и f-подуровни обладают повышенной стабильностью, поэтому электронная конфигурация меди описывается формулой [Ar]4s13d10 ([Ar] показывает, что под 4s и 3d-орбиталями электроны расположены так же, как у аргона), серебра - [Kr]4s13d10, золота - [Xe]4s13d10. Поэтому эти элементы в различных соединениях часто одновалентны, и поэтому Менделеев расположил их в первой побочной подгруппе. Цинк же, кадмий и ртуть чаще всего двухвалентны, в связи со стабильностью полностью заполненного d-подуровня, и Менделеев расположил их во второй побочной подгруппе. Кроме того, видно, что максимальное количество электронов на внешних s - и d-орбиталях переходных элементов вплоть до первого элемента триады как раз совпадает с номером группы. Как видно, таблица Менделеева не только хорошо согласуется с квантовой механикой, но даже не пасует тогда, когда заполнение электронных оболочек в рамках квантовой механики рассматривается как аномальное – у меди, серебра и золота. ЗАКЛЮЧЕНИЕ Итак, несмотря на то, что Менделеев открыл свой закон задолго до появления квантовой механики, Периодический закон отлично согласуется с положениями квантовой механики и может быть последовательно из них выведен. Вероятно, не будет большого преувеличения, если сказать, что Менделеев создал инструмент, позволивший ученым использовать некоторые следствия из квантово-механического описания атома задолго до появления самой квантовой механики; Периодический закон Менделеева – это как бы взгляд в будущее химии из XIX в. Именно необычность взглядов Менделеева, отсутствие в современной ему науке теоретических предпосылок, вызвало поначалу недоверие к Периодическому закону. Однако Периодический закон обладал не только объяснительной, но и предсказательной силой, он позволил не только упорядочить существующие элементы по химическим и физическим свойствам, но и предсказать существование новых, еще не открытых элементов, что и определило его триумф. Список литературы: Герман Смирнов «Менделеев». Серия биографий «ЖЗЛ».М.: «Молодая Гвардия»,1974 г. К. Манолов «Великие химики»,в 2-х томах. М.: «Мир»,1986 г. Коренев и неорганическая химия, в 3-х частях. М.:, «Издательство Московского университета», 2002 г. |
