Строение атома, методич. указание (3). Практическая работа Строение атома
 Скачать 465 Kb. Скачать 465 Kb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «ОМСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» КАФЕДРА ХИМИЯ ПРАКТИЧЕСКАЯ РАБОТА«Строение атома» Д. И. Менделеев в 1869 году открыл периодический закон, а позднее на его основе создал периодическую систему элементов (ПСЭ), которая служит ключом к познанию строения вещества. Периодический закон, по сути, является основным законом химии неорганических соединений. Формулировка периодического закона: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра атома. Химический элемент – это совокупность атомов с одинаковым зарядом ядра Zя. Изотопы – это атомы с одинаковым зарядом ядра, но с разными массовыми числами Аr.  В ПСЭ каждый элемент имеет свой порядковый номер и занимает одну клетку таблицы, химические элементы (ХЭ) расположены в направлении увеличения их порядкового номера по периодам, группам и подгруппам. У каждого элемента указаны его атомная масса. Порядковый номер химического элемента в ПСЭ – это важная характеристика атома: 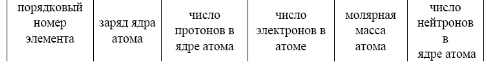 Период – горизонтальный ряд ХЭ, расположенных в порядке увеличения заряда ядра и числа электронов в атоме. Атомы одного периода имеют одинаковое число энергетических уровней, которое равно номеру периода, обозначенному арабской цифрой. В таблице имеется 7 периодов. Группа – вертикальный ряд ХЭ, атомы, которых имеют одинаковое число валентных электронов, но разное число энергетических уровней. Номера групп обозначены римскими цифрами. В таблице имеется 8 групп. Подгруппа – часть группы, в состав которой входят ХЭ с одинаковым распределением валентных электронов в атоме. В результате смещения ХЭ влево и вправо каждая группа делится на две подгруппы: главную А и побочную Б.  Лантаноиды и актиноиды – два семейства f-элементов, которые в виде двух отдельных рядов вынесены за пределы таблицы. В последние годы в эти ряды часто включают лантан и актиний.  Число валентных электронов у атомов этих химических элементов может быть больше или меньше трех за счет провала электронов с f-подуровня на d-подуровень или наоборот. Пример 1:  Квантовые числа. Атомные орбитали. Вся совокупность сложных движений электрона в атоме описывается четырьмя квантовыми числами: главным п, побочным l, магнитным mеи спиновым s. Главное квантовое число попределяет общую энергию электрона на данной орбитали и его удаленность от ядра. Оно может принимать любые целые значения, начиная с единицы: 1,2,3,4...∞ . Под главным квантовым числом, равным ∞, подразумевают, что атому сообщена энергия, достаточная для полного отделения электрона от ядра (ионизация атома). Максимальное число электронов, которое находится на каждом энергетическом уровне: N= 2п2 N (периода) = N (энерг. ур.) = n  Энергетические уровни представляют собой совокупность некоторых энергетических подуровней. Существование различий в энергетическом состоянии электронов отражается побочным (орбитальным) квантовым числом l. Это квантовое число может принимать целочисленное значение от 0 до п-1 (l = 0, I, 2... n-1). Численные значения lпринято обозначать буквенными символами значение l0 1 2 3 4 буквенное обозначение s р d f g В этом случае говорят о s р d f g- состояниях электронов, или s р d f g орбиталях. Орбиталь - совокупность положений электрона в атоме, т.е. область пространства, где энергетически выгоднее всего находиться электрону. l- определяет форму электронного облака, а также орбитальный момент - момент количества движения электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа – орбитальное). Если l=0 (s -орбиталь), то электронное облако имеет сферическую форму и не обладает направленностью в пространстве. При l= 1 (р-орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из "восьмерки". При l=2 (d - opбиталь) электронное облако имеет четырехлепестковую фигуру. Формы fи g электронных облаков намного сложнее. Максимальное число, электронов на подуровне рассчитывается по формуле 2(2l+ I). Ориентация электронного облака в пространстве не может быть произвольной. Она определяется значением третьего, так называемого магнитного квантового числа ml. mlможет принимать значения любых целых чисел, как положительных так и отрицательных от - l до + l, включая 0, т.е. всего (2l+1) значений. Например, при (l= 0 ml = 0; при l= 1 ml = -1, 0,+1; при l равном 3 mlимеет семь значений (2l+1=2∙3+1=7): -3, -2, -I, 0, +1,+2,+3 - семь различных ориентации -fэлектронных облаков в пространстве. S - спиновое квантовое число определяет собственное состояние электрона, результат вращения электрона вокруг своей оси. Спиновое квантовое число может иметь два значения: +1/2 или -1/2. Число орбиталей на подуровне
Следовательно, состояние электронов можно описать набором четырех квантовых чисел, но для объяснения строения электронных оболочек атомов нужно знать еще три основных положения: принцип Паули, правило Хунда, принцип наименьшей энергии. Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Правило Хунда. При данном значении l(т.е. в пределах определенного подуровня), электроны располагаются таким образом, чтобы суммарный спин был максимальным. Принцип наименьшей энергии (правило Клечковского) в атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей его связи с ядром). Энергия электронов в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений n+l являетcя меньшей (энергия электрона на подуровне 4s < , чем на подуровни 3d, т.к. n+l=4 + 0 = 4 для 4s n+l =3+2=5 для 3d. Когда для двух подуровней суммы n+lравны, сначала идет заполнение с меньшим значением n(на подуровнях, 3d 4p, 5s,n+l=5 в этом случае происходит заполнение подуровней сначала с меньшим значением n, т.е. 3 d→ 4 р →5S ). Электронное строение атома Электроны в атоме располагаются по энергетическим уровням и подуровням, что изображается чаще всего двумя способами: в виде электронной конфигурации атома или энергетической диаграммой. Электронная конфигурация атома отображает расположение электронов в атоме по уровням и подуровням. При этом следует помнить, что в соответствии с принципом Паули максимально может быть на s-подуровне любого уровня 2 электрона, на p- подуровне – 6 электронов, на d-подуровне – 10 электронов, на f-подуровне – 14 электронов. Электронную конфигурацию атома принято изображать в виде электронной формулы, которая записывается в порядке возрастания номера энергетического уровня, т.е. без учета последовательности заполнения подуровней электронами. Пример 2. Электронная формула химического элемента 5-го периода, IV группы, подгруппы Б циркония Zr с порядковым номером 40 имеет вид Тогда как электронная конфигурация атома 40Zr с учетом последовательности заполнения подуровней записывается следующим образом: Энергетическая диаграмма уровней и подуровней – это наглядная схема электронной структуры атома имеет вид: 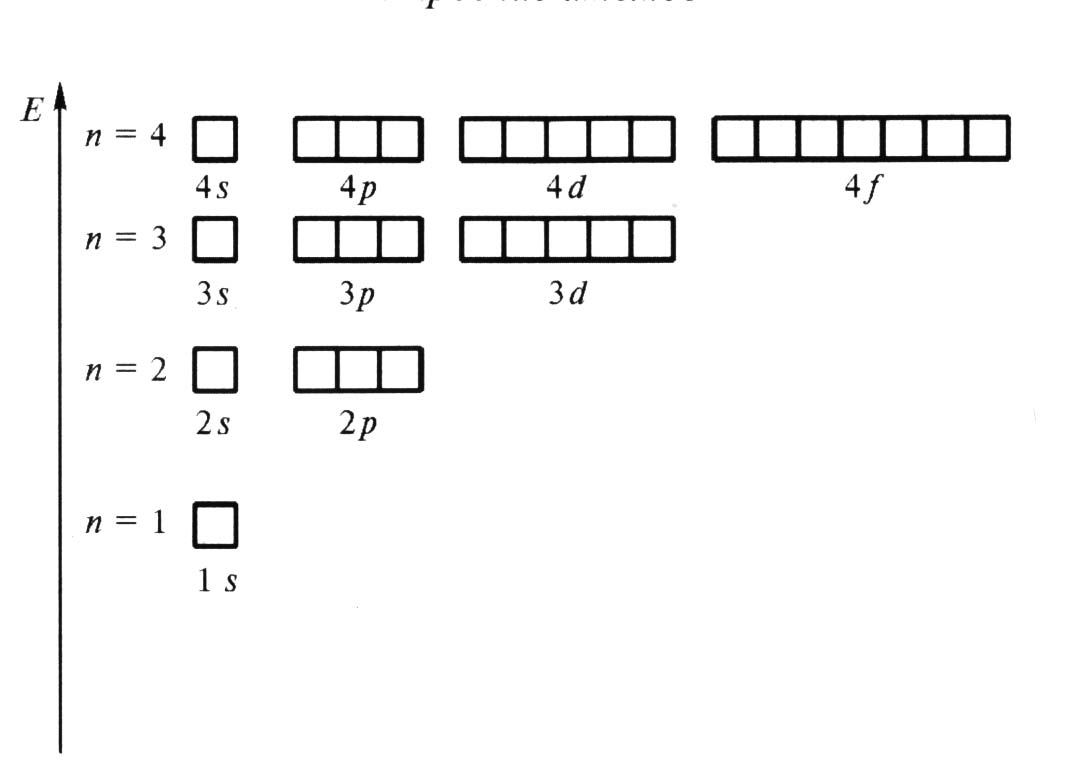  Пример 2:  !!!!!!!! Найди ошибку в примере!!!! Принципы построения электронной структуры атомов элементов. Последовательность АО в порядке возрастания их энергии имеет вид Порядок возрастания энергии АО в сложных атомах описывается правилом (n+l) (или правилом Клечковского): энергия АО возрастает в соответствии с увеличением суммы n+l главного и орбитального квантовых чисел. При одинаковом значении суммы, энергии меньше у АО с меньшим значением главного квантового числа. Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d-орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния. В четвертом периоде, в соответствии с правилом (n+l), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4s-подуровень, а не 3d.Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение 3d-подуровня: В ряду 3d-элементов у хрома Сr (Z=24) наблюдается отклонение от правила (n+l). В соответствии с этим правилом конфигурация Сr должна выглядеть так: В шестом периоде после заполнения 6s-подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n+l), должен занять 4f-подуровень. Однако у лантана La (Z=57) электрон поступает на 5d-подуровень. Заполненный на половину (4f7) 4f-подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4f-подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d-подуровень, нарушая правило (n+l). У тербия Tb (Z=65) очередной электрон занимает 4f-подуровень и происходит переход электрона с 5d-подуровня (конфигурация 4f96s2). Заполнение 4f-подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5d-подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f-подуровнем. В настоящее время в таблице под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d-элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы ПСЭ. В седьмом периоде 7s-подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n+l), и очередной электрон заселяет 6d-подуровень, а не 5f. Далее следует группа элементов (Th – No) с заполняющимся 5f-подуровнем, которые образуют семейство актиноидов. Отметим, что 6d- и 5f- подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n+l). Но в данном случае значение точной конфигурации 5fт5dmне столь важно, поскольку она довольно слабо влияет на химические свойства элемента. Таблица 1 - Исключения из (n+l) – правила для первых 86 элементов
Задание: Написать электронную структуру ХЭ по образцу, представленному в таблицах 2 и 3. Таблица 2  Таблица 3
| |||||||||||||||||||||||||||||||||||||||||||||||
