Получение биогумаса на основе субстрата из перегноя КРС и опавшей листвы. Получение биогумаса на основе субстрата из перегноя КРС и опавше. Получение биогумуса из субстрата на основе перегноя крс и опавшей листвы
 Скачать 281.65 Kb. Скачать 281.65 Kb.
|
|
Управление образования г. Пензы Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №7 г. Пензы» Исследовательская работа на тему: «Получение биогумуса из субстрата на основе перегноя КРС и опавшей листвы» Выполнил: Проверил: Содержание: I.Введение: II.Материалы и методы исследования: 1.Материальная база исследования. (Академия МНЭПУ) 2.Культура «Владимирского старателя». 3.Ферминтация и апробация субстрата. III.Результаты исследования. IV.Заключения. Введение Биогумус - концентрированное удобрение, содержит в сбалансированном сочетании целый комплекс необходимых питательных веществ и микроэлементов, ферменты, почвенные антибиотики, витамины, гормоны роста и развития растений. В нем большое количество гуминовых веществ. Это также и микробиологическое удобрение, в нем обитает уникальное сообщество микроорганизмов, создающих почвенное плодородие. Биогумус не содержит патогенную микрофлору, яйца гельминтов, цисты патогенных простейших, личинки синантропных мух, семян сорняков. Удобрение легко и постепенно усваивается растениями в течение всего цикла своего развития. Биогумус используется как основное органическое удобрение при посадке, подкормке всех видов сельскохозяйственных культур, в лесоводстве, цветоводстве, а также при реанимации и рекультивации почв. Вносить биогумусв открытый грунт можно с ранней весны до поздней осени. Он является органическим удобрением пролонгированного действия. Его эффективность сохраняется в течение 4 - 7 лет. Кроме того, биогумус можно использовать для борьбы с насекомыми, поскольку в нем концентрация микроорганизмов-продуцентов хитиназы, расщепляющей хитин (вещество, из которого состоит наружный скелет насекомых) очень высока. Для защиты растений от насекомых биогумус вносят в почву вокруг растений или готовят из него водный настой в виде вермикомпостного «чая», или собирают жидкость, оттекающую из червеложа, для обработки листовой поверхности растений опрыскиванием в период вегетации. Итак, актуальность биогумуса будет связана с его производством, а точнее с компонентами входящими в состав этого удобрения. Главной задачей, является в первую очередь наладить производство данного удобрения, не нанося вред экологии. В связи с указом Президента РФ Владимира Путина от 5 января 2016, 2017 год в России объявлен годом экологии. Следовательно, возрастет популярность экологическичистых удобрений. Основной целью данного исследования выявление субстратов, на основе которых можно произвести биогумус. Основной задачей исследования является производство экологически чистого биогумуса из субстрата на основе перегноя КРС и опавшей листвы. Компоненты этого субстрата доступны для любого фермера. Опавшая листва может стать полезным компонентом данного субстрата. Зачастую опавшую листву утилизируют за ненадобностью в применении в производстве экологически чистых удобрений. Стоит ли так не рационально использовать природный ресурс? Объектом исследования является культура дождевых червей «Владимирский старатель». Предметом исследования является субстрат, созданный на основе отходов КРС и органосодержащих отходов из которого производится биогумус при помощи компостных червей. Разведение этих червей позволяет производить на основе субстратов экологически чистых удобрения. Научная новизна данной работы заключается в создании экологически чистых удобрений на основе экологически чистых почти неисчерпаемых ресурсов. Опавшая листва может стать очень выгодным приобретением в сельскохозяйственной отрасли. Практическое значение данного исследования заключается в применении биогумуса как экологически чистого удобрения произведенного из субстрата на основе перегноя КРС и органосодержащих отходов. Органосодержащих отходы, в нашем случае листья являются важной составляющей данного субстрата, сегодня особо не используется в производстве экологически чистых удобрений, следовательно, использование данного субстрата на основе вышеперечисленных компонентов поможет сэкономить важные природные ресурсы, зачастую недоступные для простого фермера. I.Материалы и методы исследования. 1.Материальная база исследования (Академия МНЭПУ): Международный независимый эколого-политологический университет создан специальным постановлением Правительства РФ в 1992 году при поддержке Государственного комитета по экологии. Инициатором создания вуза и его первым президентом был действительный член Российской академии наук, президент национальной организации «Международный Зеленый Крест» в России, президент Российского национального комитета программы ООН по охране окружающей среды Никита Николаевич Мосеев. Филиал МНЭПУ открытый в 1995 году при поддержке областной администрации стал первым негосударственным вузом в Пензе. Сейчас Пензенский филиал «МНЭПУ» - это вуз со своими традициями, хорошо известный в России и за рубежом. Возглавляет Филиал кандидат биологических наук, доцент, член-корреспондент Международной академии наук экологии и безопасности жизнедеятельности Людмила Михайловна Хурнова. При Пензенском филиале академии МНЭПУ имеется теплица, изготовленная из поликарбоната и утепленной эковаты, собственной разработкой академии. В этой теплице располагается червятник. В нем выращиваются дождевые черви культуры «Владимирский старатель». Помещение червятника располагающееся в теплице представляет собой группу двуярусных стеллажей, на которых располагаются контейнеры с субстратом, в которые производится червей. 2.Культура «Владимирского старателя»: Компостные, они же дождевые, они же земляные черви играют большую роль в обогащении почвы кислородом и удобрением. Они делают в земле норки, способствуя ее увлажнению и разрыхлению. Червей разводят для того, чтобы они перерабатывали органические отходы в биогумус. Поскольку компостные черви быстро размножаются, их применяют в качестве корма для домашней птицы. Небольших по размеру червячков используют рыбаки для наживки. Компостные черви могут восстанавливать земли от химических ожогов, возвращать им плодородность. Пропуская через себя землю, они превращают ее в полезное удобрение, которое можно назвать концентрированным черноземом. Этим удобрением нельзя испортить землю, оно делает ее только лучше, полезнее для растений. Разведение червей называется вермикультивированием. Фермы по вермикультивированию есть во многих развитых европейских странах, в США и в России. Способ размножения и виды червей: Земляные черви живут везде, где позволяет температурный режим. Есть они в Азии, Африке, Америке и Европе. Их также называют дождевыми червями, поскольку во время дождей они поднимаются наверх из почвы из-за недостатка кислорода. Всего насчитывается около 300 видов. Виды отличаются по: длине; числу колец на теле; по числу щетинок, с помощью которых они передвигаются. Все земляные черви – гермафродиты. Они оплодотворяют друг друга перекрестно половым путем. Оплодотворяются яйца, расположенные в пояске на теле. Через 3-4 недели из пояса выходят маленькие черви в коконе, взрослеющие за 3 месяца. Земляных червей разделяют на два типа: постоянно живущие на поверхности; добывающие пищу в глубине почвы. Ко второму типу относятся норные черви, способные проникать в почву на глубину 1 метр. К нему также относятся подстилочные, почвенно-подстилочные и роющие черви. В сельском хозяйстве используют первый тип, а именно относящийся к нему вид Eisenia foetida. Это известные компостные черви. Особенность обычных компостных червей состоит в том, что они привыкают к какому-то одному виду питания и впоследствии трудом его меняют. Калифорнийский червь Наука разведение подвидов земляных червей зародилась в США. Ее основоположником считается Томас Баррет. Он убеждал всех фермеров в пользе червей, которые живут в компосте. В 50-х годах XX века в Калифорнии вывели гибрид красных компостных червей, которые быстро размножаются, долго остаются на одном месте и усиленно перерабатывают почву. Поскольку Калифорнийские черви были выведены в теплом климате, они не переносят сильных морозов и гибнут при низких температурах. В Советском Союзе и в России знаменитым ученым, посвятившем себя изучению компостных червей, является профессор А.М. Игонин. Он же вывел путем скрещивания новый подвид, адаптированный к суровому российскому климату. Позднее этому подвиду дали название «Старатель». 3.Ферментация и апробация субстрата: Ферментация Кормом (субстратом) для компостных червей являются различные органические отходы с высоким содержимым целлюлозы, которые прошли процесс ферментации. Основой рациона для червей является навозная масса, к которой добавляют определенное количество других органических отходов. Для получения качественного органического субстрата для червей существуют следующие требования: влажность 70-80 %, рН 6,8-7,2, содержимое окислов железа не больше 10 %, отсутствие твердых частей - металлических, деревянных, камней, стекла, пластмасс и тому подобное. Для проведения ферментации органические отходы буртуют на ровной площадке с допустимым наклоном 1-3. Бурты могут иметь разные размеры: ширина - 1,7-2 м, длина, - 15-80 и высота - 1,5-2 м. Это зависит от имеющейся рабочей силы и средств механизации. Бурты должны быть вытянуты из севера на юг для лучшего прогревания субстрата1. В условиях доступа воды и кислорода под воздействием редуцентов, которые есть на субстрате (грибов, актиномицетов, бактерий), органические отходы подвергаются частичному разрушению с окислением активной органики. Основные компоненты мертвого органического вещества, используемого редуцентами, можно расположить в порядке возрастания устойчивости к разложению: сахара, крахмал, гемицеллюлоза, пектины и белки, целлюлоза, лигнины, кутины. В соответствии с этим в разлагающемся растительном субстрате наблюдается смена сообществ редуцентов, потребляющих данные компоненты. Таким образом, в результате гидролитического расщепления высокомолекулярных органических соединений (белков, жиров и углеводов) образуются промежуточные и конечные низкомолекулярные продукты, которые могут потребляться червями. Процесс ферментации субстрата проходит в двух температурных режимах. После закладки буртов температура внутри субстрата повышается к термофильным величинам (50-60 °С), а затем уменьшается к мезофильным значениям (25-35 °С) и через несколько месяцев снижается к температуре окружающей среды. Стабильность этого показателя свидетельствует об окончании ферментации и пригодности субстрата для кормления червей. Биотермические процессы, которые происходят при температуре 50-60°С, пагубно действуют на патогенную микрофлору, яйца и личинки гельминтов, семян сорняков, а мочевина и гипуровая кислота, которые содержатся в перегное, окисляются до аммиака, двуокиси углерода и воды Кроме аммиака, выделяется также определенное количество метана. Содержание аммиака зависит от наличия в навозе белковых компонентов и условий аэрации. Учитывая высокое содержание активной органики в навозной массе и то, что для ускоренной ферментации требуется высокая влажность, условия аэрации внутри буртов изменяются от аэробных - близко к поверхности до полностью анаэробных в глубине. В анаэробных условиях образуются продукты неполного разложения - спирты, кетоны, альдегиды, аммиак, метан и др., что обуславливает появляющийся при этом неприятный запах. При аэробном разложении конечными продуктами распада обычно выступают углекислый газ, соли азотной кислоты и молекулярный азот и вода2. В летний период при высоких температурах бурты периодически поливают водой, перегноевой жидкостью или стоками, для поддержки влажности на уровне 70 %. В условиях мелкофермерского производства и в зимний период вместо буртового способа ферментации можно использовать имеющиеся герметичные емкости. Так в наших условиях для этого использовались вышедшие из употребления бытовые ванны. Сухой лежалый навоз КРС в количестве 100 л (1 загрузка ванны) замачивался 25 литрами отстоянной водопроводной воды. Спустя 2 дня комья навоза подвергались предварительному измельчению штыковой лопатой. После этого визуально наблюдались признаки ферментации, выражавшиеся в появлении запаха и выделении газов. Для обеспечения достаточной аэрации ферментируемого субстрата, а также активизации микробиологических процессов, выравнивания влажности субстрата по всему объему, устранения анаэробных загнивающих зон в глубине ванны, он перемешивался с использованием строительного миксера СМ-1000 в режиме работы II. Неравномерность перемешивания субстрата не превышала 10 % (коэффициент вариации влажности в массе). Во время прохождения ферментации в субстрате контролировался рН среды. Незначительное колебание рН от оптимального (6,8-7,2) негативно влияет на рост и развитие аэробной микрофлоры, а, следовательно, и на интенсивность процессов ферментации. В условиях ванны значительного отклонения рН от нейтрального не наблюдалось. В больших объемах буртов избыточную кислотность нейтрализуют путем добавления необходимого количества извести, мела, сахарного дефеката, сланцевой золы, мергеля и других веществ, которые одновременно выступают и минеральными добавками. Высокая остаточная влажность устранялась внесением в ванну в конце ферментации сухих лежалых опилок смешанных пород дерева. Количество вносимых опилок зависит от уровня влажности. Так, максимальный объем загружаемых опилок составил 30-40 л/ванну, при визуальных условиях влажности - наличия воды на поверхности субстрата. После внесения опилок производится перемешивание субстрата миксером. Спустя неделю субстрат готов к использованию. Полный срок ферментации субстрата в буртах при естественном режиме ферментации зависит от вида органических отходов и температуры и может длиться до 6-12 мес. Ускорить этот процесс до 1-3 мес. можно путем вдувания горячего пара через трубы в субстрат. В наших условиях использовался лежалый навоз (зимнее накопление фермы КРС) в сухой форме. Срок ферментации составлял 2 недели при средних температурах от 15 до 25 °С. Визуально субстрат, готовый к потреблению червями, имеет вид слабоперепревшей массы (солома имеет темно-коричневый цвет и легко разрывается) или перепревшей массы (имеет вид черноватой маслянистой смеси и наличия соломы в ней не заметно). Показателем готовности субстрата есть соотношение углерода к азоту (С: N), которое должно быть в пределах 20. Визуально это выражается в уменьшении количества выделяемых газов на поверхности замоченного навоза . Апробация субстратов В субстрате для компостных червей не должно содержаться пестицидов, большого количества протеина (не больше 25-30 %), аммиака, метана, патогенной микрофлоры, яиц и личинок гельминтов. При содержании в корме 40 % протеина черви погибают. Анализ литературных источников о культивировании калифорнийского червя предлагает следующее: Перегной коней является хорошим кормом для червей, поскольку содержит значительное количество целлюлозы. Процессы ферментации в нем длятся 5-6 мес. Перегной КРС имеет высокую влажность и после 6-8 мес. ферментации в смеси с 20-25 % измельченной соломы является хорошим кормом для червей. Перегной молодняка КРС может иметь в зависимости от особенностей кормления повышенное содержание протеина через неполное его усвоение животными. Для снижения уровня протеина в навозной биомассе к ней добавляют измельченные солому или картон и увеличивают срок ферментации с 7-8 до 13 мес. Перегной овец является высокощелочным. В овчарнях он утрамбовывается животными. Для применения его вырезают пластами, их увлажняют и рыхлят, а затем буртуют для ферментации (до 8 мес.). Перегной свиней имеет высокую кислотность и содержит значительное количество протеина. В связи с этим к нему добавляют 30-40 % соломы или листвы и ферментируют 9-10 мес. Установлено, что твердую фракцию перегноя свиней, удаленного гидросмывом, можно добавлять в корм червям в свежем виде без предыдущей ферментации, а жидкую фракцию использовать для увлажнения буртов. При переработке жидкого перегноя методом вермикультивирования его сначала подвергают механической сепарации, а из твердой фракции формируют бурты, траншеи или лотки. Перегной кроликов можно скармливать червям в свежем виде, но при условии, что экскременты будут отделяться от мочи. В другом случае его подвергают ферментации в течение 5-7 мес. В некоторых хозяйствах при выращивании кроликов утилизация перегноя методом вермикультуры проводится таким образом: под клетки с кроликами ставят ящики с уложенной на дне смесью почвы, измельченной бумаги и песка, в которую запускают червей. Свежие экскременты, которые поступают из клеток, перерабатываются червями. Добавление песка необходимо для нормального пищеварения червей. Куриный помет принадлежит к высококислотным субстратам, потому к нему нужно добавлять отходы растениеводства или листву в соотношении 1:1 и ферментировать в течение 15-16 мес. При использовании навозной биомассы необходимо придерживаться некоторых условий: нельзя использовать в качестве базового субстрата перегной, который не прошел процесс ферментации, а для кормления червей перегной, который пролежал больше 2-х лет после ферментации, также смешанный с мочой, выделяющий аммиак или сероводород. Установлено, что для подкормки червей можно использовать неферментированный навоз, который хорошо проверен на пригодность (кислотность, температура, влажность, проба 50-ти червей). Поскольку он вносится слоем всего 5 см, то опасности ферментации нет. Независимо от вида ферментируемого субстрата, корм должен содержать 20-25 % целлюлозы в виде сечки из соломы, бумаги, картона и др.3 Как свидетельствует практика, кормом для червей могут быть разные органические отходы как сельскохозяйственного, так и промышленного производства. Но лучше всего, чтобы основой любого рациона для червей был перегной, к которому добавляют в определенной пропорции другие органические компоненты. В рекомендациях указано, что большие органические частицы отходов нужно измельчить (до 1 мм, не больше), потому что они не поедают червями. В нашем случае самые крупные частицы субстрата достигали размера 5 см. Несмотря на это они спустя месяц распадались на мелкие фракции и потреблялись червями. Окончание переработки субстрата определялось визуально по толщине слоя копролитов. Переработка считалась завершенной, когда толщина слоя копролитов равнялась толщине слоя закладки субстрата. Плотность засева червями составляла 4,5 тыс.экз./ящик (18,75 тыс./м2). Скорость переработки субстрата при величине частиц в 5 см. снижалась по отношению к частицам размером в 1 см примерно на 60 %. Изменение скорости утилизации слоя субстрата, толщиной 50 мм при температуре 18-22С в зависимости от степени его измельчения представлено на рис.2. Деградации комочков сахарного дефеката, крупнее 1 см не происходит. 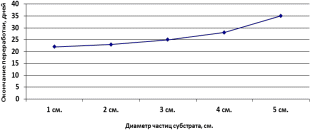 Рисунок 1. Зависимость скорости деградации субстрата от степени его первоначального измельчения Как можно заметить из данного рисунка, зависимость носит или экспоненциальный или параболический характер, и при дальнейшем укрупнении размера частиц субстрата произойдет резкое увеличение времени его переработки. Для экстраполяции исследуемого показателя на промежутке изменения аргумента от 0,1 до 10 см. в контроле предлагаем следующее аппроксимирующее уравнение со среднеквадратическим отклонением функции 0,23: 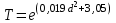 , ,где: Т – время переработки, дней; d – диаметр частиц, см. Для смеси каждого типа было произведено тестирование методом измерения времени ухода 10-ти взрослых червей в субстрат (Т10). При условии положительного теста было заложено по 3 повторности (3 ящика смесей каждого типа). Эксперимент проводился в период сентябрь – декабрь 2010 г. Добавление субстрата производилось через равные промежутки времени 4 раза слоями по 5 см. Температура воздуха в теплице на уровне верхнего ящика колебалась в пределах 18-22 С. Анализ использования смесей производился спустя один цикл ящичного вермикультивирования (4 мес.). Получены следующие результаты. «Опавшая листва измельченная замоченная» Картон использовали из-под ящиков для офисной техники, резанный садовыми ножницами, размер частиц от 1 до 3 см. Подвергался ферментации в течение 14 дней. В процессе ферментации цвет изменяется на темно коричневый (рис. 7). В процессе ферментации наблюдается осклизнение и появление гнилостного запаха. Т10 положительный=1 мин. Утилизация субстрата полная. В период 3 закладки на поверхности присутствуют сухие фракции листвы. В глубине субстрата остатки рыхлые. Степень переработки обрезков листвы зависит от продолжительности вермикультивирования. Биогумус темно коричневого почти черного цвета, наличие характерного блеска. После закладок субстрата количество выползающих из ящика червей незначительное. Высыпания из ящика присутствуют в средних объемах. Скорость обсыхания субстрата в условиях теплицы соответствуют контролю. Скорость переработки крупнофракционных компонентов смесей, таких, как листва довольно высока. Срезы 3-х разовой закладки со сроком вермикультивирования 3 месяца представлены на рис. 2.  Рисунок 2. Срезы трехмесячного возраста. При глубине слежавшихся фракций от 3-х закладок в 15 см. уже на глубине 5 см. присутствуют лишь незначительные фрагменты крупных компонентов. Зависимость степени деградации субстрата от времени вермикультивирования представлена на рис. 3. 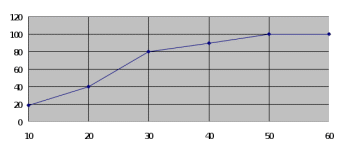 Время культивирования, сут. Доля деградировавшего субстрата. % Листва.   Рисунок 3. Зависимость скорости деградации крупных фракций субстрата от времени вермикультивирования. I-IV – стадии деструкции субстрата. Таким образом, почти полная деструкция крупных фракций субстрата при оптимальных температурах (18-22 С) наступает спустя 2 месяца после закладки в вермиящики. При этом скорость деструкции соломы за период 0-60 суточной культивации на 9,1±2,4 % ниже, чем картона, что связано с высоким содержанием в соломе лигнина, весьма устойчивого к разложению деструкторами и редуцентами. По форме данная зависимость имеет сходство со стандартной логистической кривой динамики плотности популяции, ограниченной внутривидовой конкуренцией, однако сходство только внешнее. Анализ стадий деструкции субстратов позволил выделить 4 этапа, связанных с характером деградации, которые ясно заметны на рис.3. Стадии деструкции субстрата I этап. Время от момента закладки субстрата 15-20 суток. Наблюдается потемнение крупных фракций, свидетельствующее об их окончательной ферментации. Листва приобретает рыхлость, солома становится хрупкой. Скорость деструкции определяется углом наклона касательной к зависимости (рис. 3). Скорость деградации соломы ниже, чем у картона (tg(αI)солома =1, tg(αI)картон =1,25). В вариантах с контролем и сахарным дефекатом ситуация другая, так как в них крупных частиц нет, поэтому I этап отсутствует. Исключение составляет только поверхность субстрата, скорость разложения которого минимальна из-за условий недостаточной увлажненности. Численность червей в пробе в данном слое (табл. 1) составляет в среднем на момент 90 –суточной культивации 124,5±17,5 экз., коллембол – 589,6±42,8 экз. Вариативность численности среди основных деструкторов для червей гораздо выше, чем у коллембол (коэффициенты вариации: коллемболы - 25.2%, черви – 48,6%). Это связано с тем, что у дождевых червей отрицательный фототаксис, и наличие укрытий в поверхностном слое в виде соломы и кусочков картона способствует их расположению в нем постоянно, а не только для совершения акта дефекации. Численность деструкторов в слое субстрата 0-3 см., экз.
II этап. Время от момента закладки субстрата 20-30 суток. Субстрат достаточно рыхлый с преобладанием мелких фракций. Картон и солома темного, почти черного цвета. Как и на предыдущем этапе, скорость деградации соломы ниже, чем у картона (tg(αII)солома =3,0 , tg(αII)картон =4,0). В целом на данном этапе скорость деструкции максимальна. Численность червей в пробе в данном слое (табл. 3) составляет в среднем на момент 90 –суточной культивации 247,5±25,2 экз., коллембол – 152,1±52,3 экз. В отличие от вышележащего слоя вариативность численности среди основных деструкторов для червей здесь ниже, чем для коллембол (коэффициенты вариации: коллемболы – 119,3%, черви – 35,2%). Как свидетельствуют данные табл.3 высокую вариацию коллембол определяет контроль, где коллембол в пробе на порядок выше, чем в остальных видах субстрата. Это связано с достаточной рыхлостью данного субстрата, по отношению к другим. Исключение составляет солома, но питательная ценность соломы для микрофауны, к которой относятся коллемболы, невысокая, данный тип субстрата имеет значительный размер, и, видимо, степень деструкции для нее недостаточна для ее потребления коллемболами. В контроле частицы перегноя КРС имеют мелкодисперсный характер и в потреблении организмами микрофауны имеют значительный удельный вес. Численность деструкторов в слое субстрата 4-7 см., экз.
В целом, самые высокие концентрации коллембол были зафиксированы при подкармливании червей вареным картофелем в процессе переманивания червей из ящиков с готовым биогумусом в расположенные сверху, согласно технологии вермикультивирования ящичным методом. При этом численность коллембол на вареном картофеле настолько высока, что они покрывают частицы сплошным слоем. В наших опытах такой операции не производилось. III этап. Время от момента закладки субстрата 30-70 суток. Субстрат становится плотнее, крупные фракции незначительны. Картон практически в кусковой форме не встречается, оставшиеся не разложенными частицы соломы черного цвета. Сахарный дефекат приобретает вид однородной белесой массы. Скорость деградации с течением времени начинает падать. Так, угол касательной с момента 30 суток до момента 70 суток уменьшается на порядок и для картона в момент 60-суточного культивирования становится равным 0, т.е. визуально его деградация прекращается. Соответственно времени уменьшение наклона касательной составляет: (tg(αIII)солома =2,0-0,5 , tg(αIII)картон =1,0-0). Численность червей в пробе в данном слое (табл. 1) составляет в среднем на момент 90–суточной культивации 338,8±17,0 экз., коллембол – 24,7±2,9 экз. Вариативность численности среди основных деструкторов для червей как и в предыдущем случае ниже, чем для коллембол (коэффициенты вариации: коллемболы – 41,3%, черви – 17,3 %). Так же как и в предыдущем варианте, относительно высокая численность коллембол наблюдается в более рыхлых субстратах, таких как контроль и солома. Причем разница средней численности коллембол между ними не достоверна (разность по Стьюденту 0,9 при стандартных значениях {2,1-2,8-3,8}). Это свидетельствует о том, что степень деструкции соломы в этот период вермикультивации достигает уровня контроля. Численность деструкторов в слое субстрата 8-11 см., экз.
IV этап. Время от момента закладки субстрата 70-90 суток. Субстрат приобретает вид плотной слежавшейся массы черного цвета, крупные фракции отсутствуют. Исключение составляет сахарный дефекат, в котором плотные камневидные включения, размером не менее 1 см практически не подверглись деструкции и сохранили первоначальную консистенцию. Скорость деградации определить невозможно, вследствие приобретения всей массой субстрата однородности. Угол касательной к кривой зависимости скорости деградации крупных фракций субстрата от времени вермикультивирования с момента 70 суток до конца культивирования равен 0. Наличие червей в данном слое свидетельствует о том, что питательные целлюлозосодержащие компоненты еще сохранились. Численность червей в пробе (табл. 4) составляет в среднем на момент 90–суточной культивации 110,9±13,6 экз., живых коллембол не обнаружено. В незначительном количестве встречаются мертвые коллемболы, предположительно погибшие из-за кислородного голодания и невозможности выбраться из плотного субстрата. Коэффициент вариации численности червей – 42,5 %. Наиболее высокие численности были зафиксированы в грубодисперсных субстратах – картоне и соломе, что свидетельствует о том, что скорость деструкции данных субстратов ниже, чем в контроле и с сахарным дефекатом. Численность деструкторов в слое субстрата 11-15 см., экз.
II.Результаты исследования. Исходная плотность загрузки червей во всех вермиящиках составляла 4,5 тыс. особей (18,8 тыс. экз./м2). На момент 90 суточного культивирования плотность червей в различных субстратах увеличилась от 15,8 до 35,3 тыс. экз./м2 (табл.5). Известно, что компостные черви в благоприятных условиях способны дать 3-4 поколения в год4. В пересчете на 3 мес. культивирования в нашем случае данная величина составляет примерно 1 поколение. Следовательно, максимальная плотность, которую можно достичь в период 3-х месячного культивирования составляет 37,6 тыс. экз./м2 (прирост численности 100%. Плотность червей на момент 90 суточного культивирования, тыс. экз./м2.
Таким образом, наиболее благоприятными условиями вермикультивирования отличались среды с добавками резаной ферментированной соломы и листвы. По-сравнению с контролем увеличение численности червей, при неизменности всех остальных параметров (влажность, температура и т.п.) увеличение репродуктивной функции составило 44,1% для соломы и 34,5% для картона. Во 2 и 3 ящиках с сахарным дефекатом численность червей вообще снизилась, что свидетельствует о том, что, несмотря на возможность его использования в приготовлении субстратом, он является по существу балластом. Анализ отхода сахарный дефекат показал, что он состоит в основном из мелового порошка с незначительными примесями целлюлозных волокон. Как будет показано ниже средняя плотность различных стадий онтогенеза червей в самом благоприятном слое вермиящика самая низкая. Обращает на себя внимание тот факт, что практически во всех субстратах наблюдается уменьшение плотности в верхних ящиках, по сравнению с нижними (рис. 3). В 4-х стеллажах с различными субстратами нумерация ящиков начиналась с нижнего. Незначительное повышение плотности в нижних ящиках связано с тем, что при выпадении червей их ящиков они попадают на нижерасположенные. Исключение составляет вариант с листвой. Видимо расположение пластин резаного картона позволяет червям лучше удерживаться на субстрате. Интенсивное расползание всегда наблюдалось непосредственно после закладки следующей порции корма, при которой ящики перемещались, что вызывало беспокойство червей.  Рисунок 3. Изменение плотности червей в зависимости от номера ящика в стеллаже. Анализ средней плотности (табл.6) показал, что достоверных отличий не имеется только при сравнении соломы и листвы. Во всех остальных случаях разность была достоверна для порогов вероятности от 0,95 до 0,999. Самые высокие отличия были обнаружены при сравнении плотности червей в ящиках с сахарным дефекатом и остальными субстратами. Низкие значения воспроизводства в случае культивации червей в среде с сахарным дефекатом, видимо, связаны с группой причин. Это: Низкая питательная ценность сахарного дефеката. Визуально данный компонент напоминает грязный мел, чем, по сути, и является. Изменением кислотности субстрата в сторону повышения шелочных свойств среды из-за наличия в ней остатков извести. Увеличения плотности субстрата из-за проявления связующих свойств меловой массы при ее высыхании. Это доказывается и низкой численностью червей в придонном слое ящика (см. табл. 4). Оценка разности средней плотности червей в различных субстратах на момент 90-суточной культивации по критерию Стьюдента.
Примечание: Стандартные значения критерия разности по Стьюденту составляют {2.1-2,8-3,8}. В скобках приведены пороги вероятности для достоверной разности. Распределение плотности червей на различных стадиях развития по слоям вермиящиков представлено на рис. 4. В слое 0-3 см. взрослых особей немного, в основном обитают ювенальные стадии, коконов не обнаружено. В слое 4-7 см. тоже преобладают ювенальные стадии, встречаются коконы, взрослых червей больше, чем в вышележащем слое. 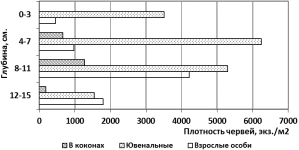 Рисунок 4. Распределение средней плотности червей по глубине вермиящика для всех субстратов. Глубже плотность ювенальных стадий червей начинает сокращаться, хотя количество обнаруженных коконов растет, также растет и плотность взрослых особей. Часто обнаруживаются скопления червей в момент оплодотворения. Видимо, данная глубина наиболее благоприятна для размножения червей благодаря подходящему уровню деструкции субстрата, влажности и рыхлости. Самая высокая плотность коконов и взрослых особей обнаружена в вермиящиках с субстратом «Листва» (табл. 7). Средняя плотность различных стадий онтогенеза червей на глубине 8-11 см., тыс. экз./м2
При вылуплении из коконов молодь направляется в более высокие уровни ящиков, туда, где имеется свежий и более рыхлый субстрат. В более низких уровнях численность молоди и коконов снижается. Там обитают в основном взрослые особи, так как они могут передвигаться в более плотном и слежавшемся субстрате. Однако здесь плотность взрослых особей ниже, чем в слое 8-11 см., так как питательная ценность субстрата уже незначительна, и он представляет собой готовый продукт, состоящий, в основном из копролитов. Выводы: I.При использовании субстрата с крупными фракциями выделяются 4 стадии, деструкции, отличающиеся скоростью разложения и степенью деградации. 1 стадия. Наблюдается при добавлении в стандартный субстрат измельченных листвы и соломы. Характеризуется завершением их ферментации и началом деструкции. Продолжительность этапа для смесей данного типа 15-20 суток, для смесей, не содержащих крупных фракций (стандартных) – 5 суток. 2 стадия. Скорость деструкции субстрата максимальна. Продолжительность для крупнофракционных смесей 20-30 суток, для стандартных смесей 5-25 суток. Наблюдается массовый вынос копролитов на поверхность субстрата. 3 стадия. Скорость деструкции снижается, наблюдается уплотнение субстрата и приобретение им однородности. Продолжительность 30-70 суток. 4 стадия. За исключением субстратов с добавлением сахарного дефеката остальные исследуемые варианты субстратов приобретают вид плотной слежавшейся массы черного цвета, крупные фракции отсутствуют. Деструкция целлюлозосодержащего органического вещества практически завершается. Продолжительность 70-90 суток. II.Зависимость времени агротехнически приемлемой деструкции субстрата от степени его первоначального измельчения выражается функцией 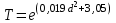 , где: , где:Т- время достижения субстратом 4-ой стадии деструкции, суток; d – средний диаметр комков субстрата, см. Модель адекватна на промежутке изменения аргумента от 1 до 5 см. III. При вермикультивировании с использованием 2-х и 3-х ярусных стеллажей рекомендуется менять положение вермиящиков по вертикали 1 раз в 2 мес. IV. Наибольшая концентрация червей культуры «Старатель» на различных стадиях онтогенеза выявлена на следующих глубинах от поверхности: взрослые особи 8-11 см, ювенальные стадии и коконы – 4-7 см. V. Полная переработка субстрата при вермикультивировании ящичным способом завершается для крупнофракционных (солома, картон) – за 90 суток. VI. Наибольший прирост численности червей наблюдается при использовании в субстратных смесях измельченной ферментированной соломы и листвы в количестве не более 15% по объему. VII. Наибольший прирост массы биогумуса – сырца в единицу времени наблюдается при использовании в субстратных смесях в качестве основных компонентов навоза КРС и опавшей листвы. III.Заключения: 1 2 3 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
