|
|
Получение, собирание и распознавание газов (аммиак, кислород, во. Получение, собирание и распознавание газов (аммиак, кислород, водород, углекислый газ, хлороводород, хлор)
Индивидуальное задание по неорганической химии
Тема: Получение, собирание и распознавание газов (аммиак, кислород, водород, углекислый газ, хлороводород, хлор)
УМК: Габриелян О.С.
Класс:
Цель: закрепить на практике способы получения, собирания и распознавания газов.
Оборудование и реактивы: штатив с пробирками, химический стаканчик, штатив лабораторный, прибор Кирюшкина, сухое горючее, универсальная индикаторная бумага, фарфоровая ступка, стеклянная палочка, мокрая вата, лучинка, гранулы цинка – Zn, соляная кислота – HCl; хлорид аммония - NH4Cl, гидроксид кальция – Са(ОН)2, раствор фенолфталеина; пероксид водорода Н2О2, оксид марганца (IV) – MnO2, кусочки мрамора или мела – СаСО3, известковая вода – Са(ОН)2.
Правила техники безопасности:
Запрещается брать вещества руками
Запрещается оставлять открытыми склянки с реактивами
Кислота и щелочь- едкие вещества! Разрушают и раздражают кожу, слизистые оболочки
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды
Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором уксусной кислоты
Определяя вещество по запаху, не наклоняйтесь к сосуду, а направляйте к себе газ рукой, не делайте глубокого вдоха
Пробирку закрепляйте в пробиркодержателе у отверстия
Зажигайте спиртовку спичкой. Гасите спиртовку, накрывая пламя колпачком
Нагревайте вещества в верхней части пламени, так как она самая горячая
Используйте для удержания нагреваемых предметов (фарфоровой чашки, металлической, стеклянной и фарфоровой пластинок) тигельные щипцы
Используйте шпатель для твёрдых веществ
Перемешивание растворов в пробирке проводите быстрым энергичным встряхиванием или постукиванием
Для перемешивания веществ в химическом стакане используйте стеклянную палочку, на которую надет небольшой отрезок резиновой трубки, совершая ею круговые движения, чтобы не разбить дно сосуда
Содержание и порядок выполнения работы:
№п/п
|
Что делали
|
Уравнения химических реакций
|
Что наблюдали
|
Опыт 1 Получение, собирание и распознавание водорода
|
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1-2 гранулы цинка и прилейте в неё 1-2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 76) и наденьте на кончик трубки ещё одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом. Снимите пробирку с газоотводной трубки и, не переворачивая её, немного наклонив, поднесите отверстием к горящей спиртовке. Если в пробирке находится чистый водород, то раздастся глухой хлопок, если "лающий" звук – водород собран в смеси с воздухом, т. е. в пробирке собран "гремучий газ".
|
Zn + 2HCl ⟶ ZnCl2 + H2↑
|
Водород при нормальных условиях – газ, не имеющий цвета и запаха, который легче воздуха
Распознать водород можно по звуку горения в пробирке, если в пробирке находится чистый водород, то раздастся глухой хлопок, если "лающий" звук – водород собран в смеси с воздухом, т. е. в пробирке собран "гремучий газ"
|
Опыт 2 Получение, собирание и распознавание аммиака
|
Соберите прибор, как показано на рисунке 168, и проверьте его на герметичность. В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объёмом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте её пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстая!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака. Сначала 2-3 движениями пламени прогрейте всю пробирку со смесью хлорида аммония и гидроксида кальция, а затем нагревайте только в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку. Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты. Немедленно закройте отверстие снятой пробирки большим пальцем, погрузите пробирку отверстием вниз в сосуд с водой и освободите отверстие пробирки. Что вы наблюдаете? Почему вода в пробирке поднялась? Закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Переверните пробирку и добавьте в неё 2-3 капли раствора фенолфталеина. Что наблюдаете? Проведите аналогичную реакцию между растворами щёлочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку
|
2NH4Cl + Ca(OH)2 ⟶ CaCl2 + 2NH3↑ + 2H2O
|
Аммиак при нормальных условиях – газ, который легче воздуха, не имеющий цвета, обладающий резким запахом.
Распознать аммиак можно по запаху и с помощью раствора фенолфталеина, в при растворении аммиак окрасит его в малиновый цвет.
|
Опыт 3 Получение, собирание и распознавание кислорода.
|
Соберите прибор, как показано на рисунке 109, и проверьте его на герметичность. Пробирку примерно на ¼ объёма заполните перманганатом калия KMnO4, у отверстия пробирки расположите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда для сбора кислорода. Сначала 2-3 движениями пламени прогрейте всю пробирку с KMnO4, а затем нагревайте только в том месте, где находится вещество. Наличие кислорода в сосуде проверяйте тлеющей лучинкой.
|
2KMnO4 ⟶ K2MnO4 + MnO2 + O2↑
|
Кислород при нормальных условиях – газ, не имеющий цвета и запаха, который тяжелее воздуха
Наличие кислорода в сосуде подтвердили с помощью тлеющей лучинкой, она вспыхнула.
|
Опыт 4 Получение, собирание и распознавание оксида углерода (IV).
|
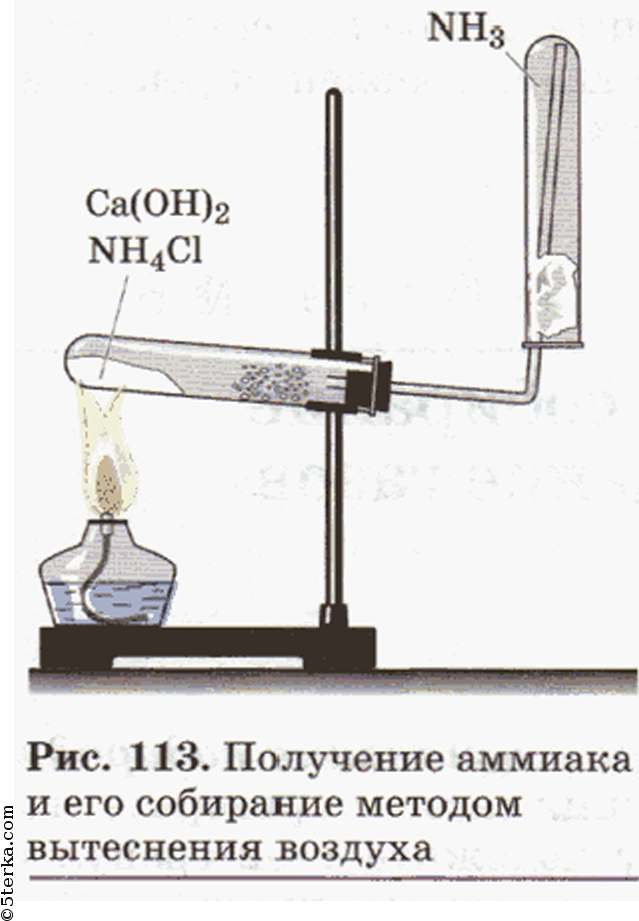
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1-2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку с 2-3 мл известковой воды. Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
|
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CO2 + Ca(OH)2 ⟶ CaCO3 + H2O
|
Оксид углерода (IV) при нормальных условиях – газ, не имеющий цвета и запаха, который тяжелее воздуха.
Распознали оксид углерода (IV) с помощью известковой воды, в результате реакции образовался осадок белого цвета
|
Опыт 5. Получение хлора.
|
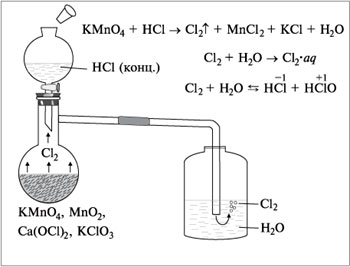
Соберите прибор для получения хлора в лабораторных условиях по фото-инструкции, если исходными веществами являются концентрированная соляная кислота и оксид марганца (IV) (кристаллический). Вспоминаем, что хлор ядовит, следовательно, опыт будем проводить под тягой!
Собираем хлор вытеснением воздуха из реакционной колбы, одновременно пропуская в реагирующие вещества. Он тяжелее воздуха, заполняет объем колбы и поднимается по насадкам.
|
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
|
Выделяется газ жёлто-зелёного цвета.
|
Опыт 6. Получение хлороводорода.
|
Собрали прибор для получения хлороводорода. Смешали в пробирке твердый хлорид натрия и концентрированную серную кислоту и нагрели.
|
NaCl + H2SO4(конц.) ⟶ NaНSO4 + HCl↑
|
В пробирке образуется обильная пена.
Распознали хлороводород влажной лакмусовой бумагой, она покраснела.
|
Прибор для получения водорода:
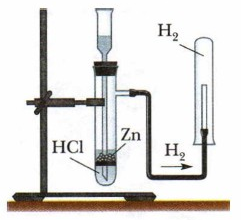
Прибор для получения аммиака:
Прибор для получения кислорода:

Прибор для получения углекислого газа:
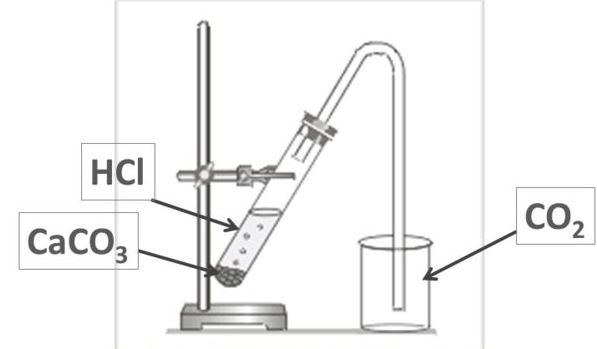
Прибор для получения хлора:
Прибор для получения хлороводорода:

Вывод: Мы научились получать, собирать и распознавать различные газы, убедились в правильности наших суждений и доказали правильность химических уравнений реакций.
Ссылки: https://www.youtube.com/watch?time_continue=203&v=_yI8K5I_QeI&feature=emb_logo
https://5terka.com/node/10693
Индивидуальное задание по органической химии
Тема: Изучение физических и химических свойств лекарственных препаратов
УМК: Габриелян О.С.
Класс: 10
Цель: познакомиться со свойствами лекарственных препаратов и установить их качество с помощью химического анализа.
Оборудование и реактивы: анальгин, парацетамол, аспирин, аналитические весы, ступка, пестик, дистиллированная вода, этиловый спирт, фарфоровая чашка, соляная кислота, хлорид железа (III), спиртовка, штатив.
Правила техники безопасности:
Запрещается брать вещества руками
Запрещается оставлять открытыми склянки с реактивами
Кислота и щелочь- едкие вещества! Разрушают и раздражают кожу, слизистые оболочки
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды
Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором уксусной кислоты
Определяя вещество по запаху, не наклоняйтесь к сосуду, а направляйте к себе газ рукой, не делайте глубокого вдоха
Пробирку закрепляйте в пробиркодержателе у отверстия
Зажигайте спиртовку спичкой. Гасите спиртовку, накрывая пламя колпачком
Нагревайте вещества в верхней части пламени, так как она самая горячая
Используйте для удержания нагреваемых предметов (фарфоровой чашки, металлической, стеклянной и фарфоровой пластинок) тигельные щипцы
Используйте шпатель для твёрдых веществ
Перемешивание растворов в пробирке проводите быстрым энергичным встряхиванием или постукиванием
Для перемешивания веществ в химическом стакане используйте стеклянную палочку, на которую надет небольшой отрезок резиновой трубки, совершая ею круговые движения, чтобы не разбить дно сосуда
Содержание и порядок выполнения работы:
№п/п
|
Что делали
|
Уравнения химических реакций
|
Что наблюдали
|
1. Определение растворимости анальгина.
|
Растворили 0,5 таблетки анальгина (0,25 г) в 5 мл воды, а вторую половину таблетки в 5 мл этилового спирта.
|
|
анальгин хорошо растворился в воде, однако практически не растворился в спирте
|
2. Определение наличия группы СН2SO3Na в анальгине
|
Нагрели 0,25 г препарата (полтаблетки) в 8 мл разбавленной соляной кислоты
|
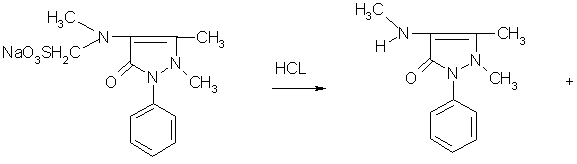
|
сначала почувствовали запах сернистого ангидрида, затем формальдегида.
Это помогае тдоказать, что в состав анальгина входит группа формальде-гидсульфоната
|
3. Определение свойств хамелеона
|
1 мл полученного раствора анальгина добавляли 3—4 капли 10 % раствора хлорида железа (III).
|
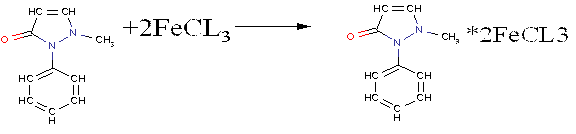
|
При взаимодействии анальгина с Fe3+ образуются продукты окисления, окрашенные в синий цвет, который потом переходит в темно-зеленый, а далее оранжевый, т.е. проявляет свойства хамелеона. Это означает, что препарат качественный.
|
4. Определение уксусной кислоты в составе парацетамола
|
К 1 мл раствора парацетамола добавили 0,5 мл соляной кислоты, нагрели смесь до кипения и кипятили ее в течение 1 минуты. Затем охладили пробирку и осторожно понюхали ее содержимое.
|
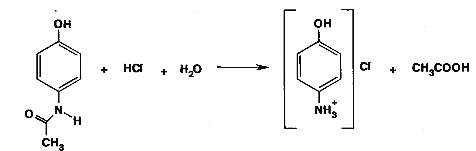
|
Появился запах уксусной кислоты, который означает, что данный препарат действительно является парацетамолом.
|
5. Определение фенолпроизводного парацетамола.
|
К 1 мл раствора парацетамола добавили несколько капель 10 % -ного раствора хлорида железа (III).
|

|
Появилось синее окрашивание, свидетельствует о наличии в составе вещества фенолпро-изводного.
|
6. Определение растворимости аспирина в этаноле
|
Внесли в пробирки по 0,1 г лекарственных препаратов и добавили 10 мл этанола. При этом наблюдали частичную растворимость аспирина. Нагрели на спиртовке пробирки с веществами. Сравнили растворимость лекарственных препаратов в воде и этаноле.
|
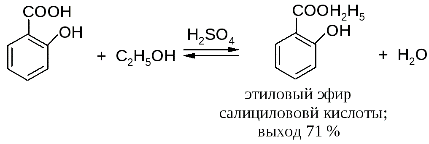
|
Результаты эксперимента показали, что аспирин лучше растворяется в этаноле, чем в воде, но выпадает в осадок в виде игольчатых кристаллов. Поэтому недопустимо применение аспирина совместно с этанолом. Следует сделать вывод о недопустимости применения алкогольсодержащих лекарств совместно с аспирином, а тем более с алкоголем.
|
Вывод: Установлено, что в настоящее время создается огромное количество лекарственных веществ, но также много подделки. Тема качества лекарственных препаратов всегда будет актуальна, так как от потребления этих веществ зависит наше здоровье. Качество лекарственных препаратов определено ГОСТ Р 52249 – 09. В определении Всемирной организации здравоохранения под фальсифицированным (контрафактным) лекарственным средством (ФЛС) подразумевается продукт, преднамеренно и противоправно снабженный этикеткой, неверно указывающей подлинность препарата и (или) изготовителя.
Нами были проанализированы и определены химические составы препаратов: анальгин, парацетамол, аспирин. Все лекарства прошли проверку на качество.
Ссылки: https://infourok.ru/issledovatelskaya-rabota-analiz-lekarstvennih-preparatov-1043856.html
|
|
|
 Скачать 0.87 Mb.
Скачать 0.87 Mb.








