Получение водорода Химическая технология реферат. Рефера получение водорода. Получение водорода
 Скачать 427.73 Kb. Скачать 427.73 Kb.
|
|
| Выполнил: ст. гр. БТП-19-03 | |
| Проверил: доцент, к.т.н. | |
 Уфа 2022
Уфа 2022Содержание
| Введение……………………………………………………………………… | 3 |
| Промышленные способы получения водорода……………………………. | 4 |
| Паровая конверсия метана………………………………………………….. | 4 |
| Химизм процесса……………………………………………………………. | 5 |
| Параметры процесса………………………………………………………… | 6 |
| Катализаторы процесса……………………………………………………. | 7 |
| Технологическая схема и ее описание……………………………………. | 10 |
| Технологии паровой конверсии…………………………………………... | 12 |
| Список использованной литературы……………………………………… | 16 |
Введение
Водород широко применяется во многих отраслях народногоихозяйства, в основном при производстве таких важнейших химических продуктов, как аммиак и метанол, на которые приходятся 80 % от общего объема его потребления. В нефтепереработке водород активно используют при гидроочистке для удаления серосодержащих соединений и гидрокрекинге для повышения глубины переработки нефти, увеличения спектра получаемых нефтепродуктов и их качества. Он также находит применение в автомобильном транспорте, пищевой промышленности, в качестве ракетного топлива, при сварочных работах и в ряде других областей.
В настоящее время только в качестве сырья для химической и нефтехимической промышленности в мире производится около 45–65 млн т водорода в год, что эквивалентно 1% мировых поставок энергии, не говоря уже об остальных отраслях. Кроме того, из-за наблюдаемой в последние годы тенденции перехода к низкоуглеродной энергетике значительно активизировались исследования возможности перехода от невозобновляемых источников энергии (нефти, природного газа, угля) на водород, в связи с чем обсуждается возможность альтернативной области миро вой энергетики – водородной энергетики. В перспективе водород может стать универсальным экологически чистым энергоносителем, так как при его горении образуется только вода, а в атмосферу не выделяются такие загрязнители воздуха, как аэрозоли выхлопных газов или диоксид углерода, которые ответственны за усиление парникового эффекта. Все чаще водород стал использоваться в автономных источниках электроэнергии мощностью от одного до нескольких тысяч кВт: это портативные приборы и аккумуляторы, резервные генераторы, системы энергообеспечения небольших энергоустановок, цеховая транспортная техника, беспилотные аппараты, генераторы для постоянного снабжения теплом и электричеством частных домов. К 2050 г., согласно прогнозам, на водород придется около 18 % от всего мирового энергопотребления. По прогнозам, потребление водорода к этому времени увеличится до 370 млн т в год, а к 2100 г. – до 800 млн т. Полагают, что благодаря переходу на водородную энергетику к 2050 г. эмиссия СО2 снизится на 60 %, при этом спрос на водород может вырасти в 10 раз.
Промышленные способы получения водорода
1) Физический – извлечение водорода из коксового газа методом глубокого охлаждения (фракционно-термическая конденсация).
2) Электрохимический метод – электролиз воды. Чистота получаемого водорода – 99,8%. Недостаток метода – большой расход электроэнергии.
3) Химический метод – конверсия углеводородных газов. В качестве исходного сырья применяются: углеводородный газ – метан или углеводороды бензиновой фракции нефти.
4) Газификация угля является универсальной технологией конверсии. В реакторах газификации исходное сырье превращается в синтез-газ - смесь H2, CO и CO2, который позволяет производить различные энергоносители.
Паровая конверсия метана
Наиболее распространенным промышленным процессом, на основе которого сейчас производится почти 95% синтез-газа, является паровая конверсия метана, которая в сочетании с реакцией «водяного газа» может служить эффективным источником водорода. Этот сильно эндотермический процесс, в котором получают богатый водородом синтез-газ с отношением Н2/СО = 3/1, начал широко внедряться в промышленных масштабах начиная с 1960-х гг., когда в качестве исходного сырья вместо угля стали использовать природный газ. Этот процесс также и наиболее популярный и дешевый способ производства водорода. По сравнению с электролизом воды на единицу потребляемой энергии в нем образуется намного больше Н2
Химизм процесса
В качестве сырья в процессах ПКК преимущественно используются природные и заводские газы, а также прямогонные бензины.
Конверсия углеводородного сырья Сn Нm протекает по уравнениям:
Сn Нm + n Н2О ↔ n СО + (n + 0,5m) Н2 – Q (1)
СО + Н2О ↔СО2 + Н2 + 42,4 кДж/моль, (2)
где n и m – число атомов соответственно углерода и водорода в молекуле углерода.
Выход водорода будет тем больше, чем выше содержание его в молекуле углеводородного сырья. С этой точки зрения наиболее благоприятное сырьё – метан, в молекуле которого содержится 25 % масс. водорода.
Источником метана является природные газы с концентрацией 94 - 99 % об. СН4. Для производства водорода выгодно также использовать дешёвые сухие газы нефтепереработки.
Реакция (1) является сильно эндотермической и, следовательно, термодинамически высокотемпературной. Вторая стадия процесса ПКК углеводородов (2) протекает с выделением тепла и термодинамически для неё более благоприятны низкие температуры. На практике процессы ПКК проводят в две ступени при оптимальных для каждой из стадий температурах.
Параметры процесса
Давление оказывает отрицательное влияние на равновесие основной реакции конверсии метана и поэтому требуется более высокая температура для достижения одинаковой степени превращения углеводородного сырья.
Предпочтительно проводить процесс под повышенным давлением, поскольку полученный водород используется затем в гидрогенизационных процессах, проводимых под давлением. При этом снижаются затраты на компримирование газа, и кроме того, повышается производительность установки.
Помимо температуры и давления на равновесие реакций существенное влияние оказывает мольное отношение водяной пар (окислитель): углерод сырья. При увеличении отношения сверх стехиометрического равновесия концентрация метана в газах конверсии будет снижаться.
В процессах конверсии углеводородов, помимо основных реакций при определённых условиях возможно выделение элементарного углерода, в следствии термического распада углеводородов
Сn Нm ↔ n С + 0,5m Н2 - Q
Вероятность выделения этого углерода возрастает при увеличении числа углеродных атомов углеводорода, повышении давления и уменьшения соотношения водяной пар: углеводород сырья. При этом наиболее опасным является температурный режим 500-750℃. При температурах свыше 700℃ углеобразование менее вероятно в результате усиления реакции газификации образовавшегося углерода. В этой связи промышленные процессы ПКК углеводородов проводят при двух и более кратном избытке водяного пара против стехиометрически необходимого соотношения.
Паровая конверсия метана с приемлемой скоростью и глубиной превращения протекает без катализатора при 1250-1350℃. Катализаторы конверсии углеводородов предназначены не только для ускорения основной реакции, но и для подавления побочных реакций пиролиза путём снижения температуры конверсии до 800 - 900℃.
Катализаторы процесса
Хотя водород можно получить путем риформинга природного газа, нафты, тяжелого мазута или угля, более высокое атомное отношение водород/углерод в метане по сравнению с другими молекулами позволяет предположить, что природный газ, содержащий большое количество метана в своем составе, является лучшим углеводородным сырьем.
Природный газ реагирует с паром на никелевом катализаторе при температуре 1200 K и общем давлении 20-30 атмосфер. Учитывая, что природный газ содержит сернистые примеси, во избежание деградации катализатора необходима предварительная очистка. Чистый поток метана затем проходит поступает в реактор, загруженный никелевым катализатором. Образующийся газ отличается высоким содержанием водорода, но содержит часть окиси углерода, которая, в свою очередь, преобразуется во втором или третьем реакторе для получения дополнительного водорода в результате реакции с водяным паром. Получаемый газ в основном состоит из водорода, содержит также двуокись углерода и небольшое количество неконвертированного метана, а также следы окиси углерода (обычно 1% по объему). Действующие установки производства водорода включают блоки компрессии/абсорбции/десорбции, позволяющие получать водород высокой чистоты (99.999% по объему).
Поскольку природный газ содержит небольшую долю других углеводородов, таких как этан, пропан и бутан, которые легко разлагаются для образования углеродных остатков в процессе риформинга метана (метан является основным компонентом), то для преобразования части углеводородов, присутствующих в природном газе, в смесь CO/H2 необходима предварительная стадия риформинга (дореформинга). Этот процесс проводится перед установкой риформинга и позволяет работать с разнообразным сырьем, обеспечивая постоянную подачу сырья. Предварительный риформинг оказывает большое влияние на состав газа, подаваемого на установку парового риформинга. Таким образом, при конверсии фракции метана полностью удаляются длинноцепочечные углеводороды. Учитывая, что эти длинноцепочечные углеводороды имеют тенденцию к образованию углерода, данный процесс предварительного реформирования сводит к минимуму образование кокса при реформировании метана. Это приводит к увеличению срока службы используемых каталитических систем.
Пар, используемый в реакции парового риформинга, может быть заменен углекислым газом, кислородом или их смесью. Также возможно использовать метанол для промышленного производства водорода вместо метана. В этом процессе метанол вступает в реакцию с паром над катализатором для получения H2. Это эндотермическая реакция, поэтому необходимое тепло образуется при сжигании хвостового газа вместе с небольшой фракцией метанола. Поток водорода, как и в случае метанового риформинга, очищается в абсорбционной установке.
В общем, реакции риформинга катализируются металлами 8-10 группы, причем никель является предпочтительным металлом для промышленного применения из-за его доступности и низкой стоимости.
Никелевые катализаторы, обладающие достаточно высокой каталитической активностью и дешевой стоимостью, получили широкое распространение используется в метановом риформинге. Никелевые системы могут использовать в качестве носителей различные оксиды металлов, такие как Al2O3, MgO, CeO2, или La2O3. Как сообщалось, катализаторы на основе Ni в процессе риформинга склонны к спеканию при высокой температуре и под воздействием осаждения углерода, что может привести к их дезактивации во время реакции.
Катализаторы риформинга должны отвечать строгим требованиям, таким как высокая активность, разумный срок службы, хорошая теплопередача, низкий перепад давления, высокая термическая стабильность и отличная механическая прочность. Кроме того, необходимо снижать затраты на разработку процессов парового риформинга метана.
Паровую конверсию оксида углерода проводят в две стадии: сначала при температуре 480-530℃ на среднетемпературном железохромовом катализаторе, затем при 400-450℃ на низкотемпературном цинкхроммедном катализаторе.
Традиционный процесс производства водорода этим методом включает следующие основные стадии:
-очистку сырья от сероводорода и сероорганических соединений;
-каталитическую конверсию сырья;
-двухступенчатую конверсию оксида углерода;
-очистку технологического газа от оксида углерода абсорбцией водным раствором карбоната калия;
-метанирование остатков оксида углерода.
Технологическая схема и ее описание

I – сырьё; II – водяной пар; III – водород; IV – двуокись углерода; V – вода; VI – водный раствор карбоната калия.
Рисунок 1 – Принципиальная схема установки производства водорода
Сырьё (природный газ или нефтезаводской газ) сжимается компрессором до 2,5 МПа, подогревается в пароподогревателе, в конвекционной секции печи - реакторе до 300 - 400℃ и направляется в реакторы Р1 и Р2 для очистки от сернистых соединений. В Р1, заполненном алюмокобальтмолибденовом катализатором осуществляется гидрогинолиз сернистых соединений, а в Р2 - адсорбция образующегося сероводорода на гранулированном поглотителе, состоящем в основном из оксида цинка (481 - Zn, ГИАП - 10) до остаточного содержания серы в сырье до < 1 ррm. В случае использования в качестве сырья бензина последний подают насосом и на вход в Р1 смешивают с водородосодержащим газом (ВСГ).
К очищенному газу в смесители добавляют перегретый до 400 -500℃ водяной пар, и полученную парогазовую смесь подают в печь паровой конверсии. Конверсия углеводородов проводится при 800 - 900 0С и давлении 2,2 - 2,4 МПа в вертикальных трубчатых реакторах, заполненных никелевым катализатором и размещённых в радиантной секции печи в несколько рядов и обогреваемых с двух сторон теплом сжигаемого отопительного газа. Отопительный газ подогревают до 70 - 100 0С, чтобы предотвратить конденсацию воды и углеводородов в горелках. Дымовые газы с температурой 950 - 1100 0С переходят из радиантной секции в конвекционную, где установлены подогреватель сырья и котёл-утилизатор для производства и перегрева водяного пара.
Конвертированный газ направляется в котёл-утилизатор, где охлаждается до 400-450℃ и подаётся на первую ступень среднетемпературной конверсии оксида углерода на железохромовым катализаторе Р3. После охлаждения до 230 - 260℃ в котле-утилизаторе и подогревателе воды парогазовая смесь далее поступает на вторую ступень низкотемпературной конверсии монооксида углерода в реакторе Р4 на цинкхроммедном катализаторе.
Смесь водорода, диоксида углерода и водяного пара охлаждается затем в теплообменниках до 104℃ и направляется на очистку от СО2 в абсорбере К1 горячим раствором К2СО3.
Диоксид углерода удаляют регенерированным раствором карбоната кальция в две стадии.
На 1 ступени для абсорбции основной части СО2 подают более горячий раствор К2СО3 в середину абсорбера. Доочистку от СО2 проводят в верхней части абсорбера, куда подаётся охлаждённый в теплообменниках до 60 - 80℃ раствор К2СО3.
Насыщенный диоксидом углерода раствор К2СО3 поступает в турбину, где давление его снижается с 2,0 до 0,2 – 0,4 МПа и направляется в регенератор К2. В результате снижения давления и дополнительного подвода тепла в куб К2 из раствора десорбируется диоксид углерода. Регенерированный раствор К2СО3 возвращается в цикл.
Водородосодержащий газ из абсорбера К1, подогретый в теплообменнике до 300℃, поступает в реактор метанирования Р5, заполненный никелевым катализатором, промотированный оксидом Mg и Cr. После метанирования водород охлаждается в теплообменниках и холодильниках до 30 - 40℃ и компрессором подаётся потребителю.
Технологии паровой конверсии
В установках парового риформинга природного газа обычно используются реакционные аппараты с внешним обогревом и нанесенными металлическими катализаторами. В паровых риформерах метана обычно используют недорогие никелевые катализаторы, а двумя важнейшими параметрами парового риформинга являются соотношение пара к углероду и температура процесса. С точки зрения энергетической эффективности предпочтительны их низкие значения, однако они повышают риск образования углерода в слое катализатора и его отравления.
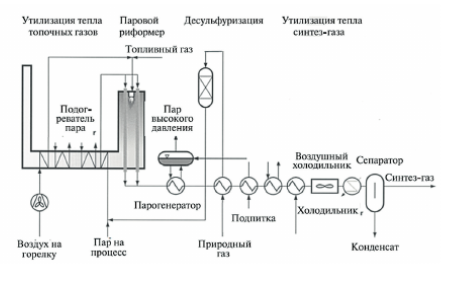
Рисунок 2 – Схема парового риформинга компании Lurgi
Проблема отравления катализатора серой при реализации паровой конверсии метана была успешно решена компанией Haldor Topsoe (Дания) за счет снижения общей активности катализатора или использования предриформера для предварительной конверсии в мягких условиях более тяжелых гомологов метана. Сейчас основные усилия разработчиков направлена на улучшение тепло- и массообмена, оптимизацию процесса и минимизацию размеров реактора. На рис. 2 представлена схема установки парового риформинга компании Lurgi с утилизацией тепла топочных газов и полученного синтез-газа. Процесс парового риформинга осуществляют в трубных печах, при этом в конструкциях реакторных печей (риформеров) разных компаний, например таких, как Howe-Baker (США), Haldor Topsoe (Дания), Foster Wheeler Corp. (США), Technip (Франция), используются различные схемы нагрева реакторных труб с катализатором. Тем не менее, во всех вариантах конструкции печей тепло дымовых газов используется для производства пара, а также для предварительного подогрева сырья и воздуха, подаваемого на горелки. Расположение горелок может быть вертикальным (наиболее распространенный вариант), боковым и террасным. Для установок малой производительности ряд компаний предлагает трубчатые печи с нижним подводом сырья и нижним расположением горелок. В варианте риформера HTCR (Haldor Topsoe Convection Reformer™) компании Haldor Topsoe осуществляется конвективный нагрев катализаторных труб дымовыми газами (рис. 3), а реактор представляет собой цилиндрическую печь с отдельной камерой сгорания в нижней секции, с вертикальными теплообменно-реакционными комплексами, состоящими из трех концентрических трубок.
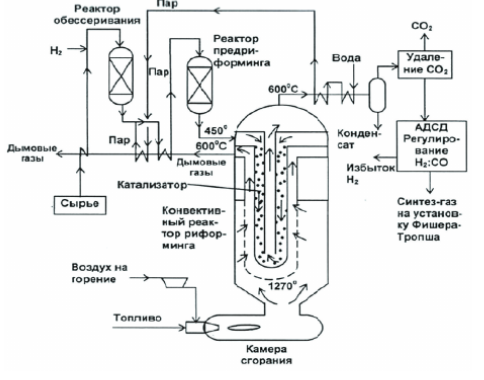
Рисунок 2 – Схема процесса HTCR (Haldor Topsoe Convection Reformer) компании Haldor Topsoe
Если в составе сырья много тяжелых гомологов метана, приводящих к ускоренному закоксовыванию катализатора, то в схему процесса включают реактор предварительного риформинга, в котором при температуре до 600℃ проводят паровую конверсию тяжелых гомологов метана в метан и частично в синтез-газ. Важным элементом технологической схемы конверсии природного газа в синтез-газ является компрессор синтез-газа. Компримирование синтез-газа приводит к его значительному разогреву, а присутствие в синтез-газе до 70% водорода ведет к необходимости использования для изготовления риформеров специальных сплавов, устойчивых к охрупчиванию водородом. Поэтому в некоторых случаях компрессор синтез-газа может оказаться самым дорогим агрегатом во всей технологической цепочке. К недостаткам метода парового риформинга можно отнести и то, что состав получаемого синтез-газа не всегда соответствует требуемым показателям для его последующей переработки, а также тот факт, что на наружный обогрев реакционных трубок расходуется большое количество природного газа.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Магарил, Р.З. Теоретические основы химических процессов переработки нефти: учебник для ВУЗов / Р.З. Магарил. – М.: КДУ, 2008. – 280 с.
2. Ахметов, С.А. Технология глубокой переработки нефти и газа: учеб.пособие для ВУЗов / С.А. Ахметов. – Уфа: «Гилем», 2002. – 672 с.
3. И.А. Макарян, И.В. Седов, А.В. Никитин, В.С. Арутюнов / Современные подходы к получению водорода из углеводородного сырья / Научный журнал российского газового сообщества / №1 (24) 2020
4. Основные производства / Учебное пособие. Чабан Н.Г. –М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2008.- 25 с
5. Матковский П.Е., Седов И.В., Савченко В.И. Технологии получения и переработки синтез-газа / Газохимия. – 2011 С. 77-84.
6. Степанов А. В. Получение водорода и водород содержащих газов. -Киев: Наук. Думка, 1982 -312 с.
7. Водород как перспективный энергоноситель. Современные методы получения водорода 2015 / Солодова Н.Л., Минигулов Р.Р., Емельянычева Е.А.
