Порядок оформления лабораторной работы
 Скачать 74.82 Kb. Скачать 74.82 Kb.
|
|
Порядок оформления лабораторной работы Каждому студенту на лабораторных работах необходимо иметь лабораторный журнал для записей. Записывайте в лабораторный журнал наблюдения в ходе опытов и уравнения химических реакций с указанием реагентов и продуктов реакции и уравнивающих коэффициентов. Для написания уравнений реакций следует использовать графические формулы органических веществ. К каждому опыту должно быть дано пояснение тех наблюдений, которые сопровождали эксперимент. Завершается выполнение лабораторной работы ее защитой у преподавателя, который оценивает полноту и правильность приведенных данных. В лабораторном журнале должны находиться записи в следующем порядке: - название лабораторной работы; - цель работы; - посуда и оборудование; - описание проведенных опытов: уравнение протекающей реакции, наблюдения в ходе опыта, объяснения наблюдаемых явлений. - ответы на задания к лабораторной работе. Лабораторная работа №1. Изучение свойств углеводородов и их производных В лабораторной работе представлены опыты, экспериментально подтверждающие и иллюстрирующие свойства УВ различных классов. Цель работы: изучить физико-химические свойства углеводородов; научиться правильной работе с использованием лабораторного оборудования; научиться записывать уравнения реакций и наблюдения в ходе эксперимента. Приборы и оборудование: пробирки в штативе, снабженные пробкой с газоотводной трубкой; пробиркодержатель, фарфоровая чашка, горелка. Реактивы: ацетат натрия кристаллический, гидроксид натрия кр., гексан, крекинг-бензин, этанол, концентрированная и 2 н. серная кислота, бензол, толуол, хлороформ, хлорбензол, бензилхлорид, иод крист., раствор перманганата калия, 1% раствор AgNO3, 0,5 М KI, 5% раствор брома. Опыт 1. Получение метана и исследование его свойств Метан в лаборатории получают реакцией декарбоксилирования при сплавлении солей карбоновых кислот со щелочами: СН3СООК+ КОН = СН4↑+ К2СО3 Методика. Предварительно тщательно перемешивают кристаллический ацетат натрия и гидроксид натрия в фарфоровой чашке и растирают смесь пестиком до однородной массы. Полученную смесь насыпают в пробирку и нагревают на пламени горелки. Внимание! Сначала нужно равномерно прогреть всю пробирку, а затем нагревать твердую смесь. Выделяющийся газ пропускают последовательно через растворы перманганата калия и бромной воды. Запишите наблюдения. Объясните происходящее. Опыт 2. Изучение свойств жидких алканов. Опыт 2.1. Изучение растворимости предельных УВ в различных растворителях. В две пробирки наливают по 10-12 капель воды (полярный растворитель) и бензола (неполярный растворитель). К жидкостям в двух пробирках добавляют по 5-6 капель гексана. Пробирки встряхивают и ставят рядом в штатив. Отмечают, в каком растворителе гексан растворяется, а в каком нет. Объясните причину наблюдаемых явлений. В случае нерастворения отметьте, в каком слое (верхнем или нижнем) окажется гексан после смешивания с растворителем? Объясните, почему так происходит. Опыт 2.2. Восстановительные свойства алканов. В одну пробирку наливают 5-6 капель бромной воды, а в другую – 5-6 капель раствора перманганата калия. В каждую пробирку добавляют по 2-3 капли гексана и встряхивают пробирки. Изменяется ли окраска растворов? Почему? Опыт 3. Получение этилена и исследование его свойств В лаборатории этилен можно получить реакцией дегидратации этанола в присутствии катализатора – концентрированной серной кислоты. Реактивы: кислота серная концентрированная (плотность=l,84), спирт этиловый 96%, кипелки (песок). Оборудование: спиртовка, газоотводная трубка с пробкой, пробирки, держатель для пробирок. Опыт 3.1. Получение этилена из этилового спирта. В пробирку помещают 5-6 капель этилового спирта, 15-20 капель концентрированной серной кислоты и 2 «кипелки» (добавляются для равномерности процесса кипения). Закрывают пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени спиртовки. 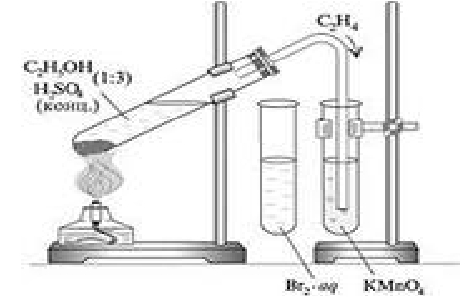 Рис.1. Получение этилена дегидратацией этанола Уравнения протекающих реакций: СН3-СН2-ОН+ HO-SO3H → СН3-СН2-О-SO3H + H2O СН3-СН2-O-SO3H → CH2=CH2 + H2SO4 Опыт 3.2. Присоединение брома к этилену (реакция Байера) Реактивы: вода бромная, насыщенный раствор. Не прекращая нагревания пробирки со смесью спирта и серной кислоты, опускают конец газоотводной трубки в пробирку с 20 каплями бромной воды. Что наблюдаете? Напишите уравнение реакции взаимодействия этилена с бромной водой. Опыт 3.3. Окисление этилена (реакция Е.Е. Вагнера) Реактивы: перманганат калия 1%. Не прекращая нагревания пробирки со смесью спирта и серной кислоты, опускают конец газоотводной трубки в пробирку с 10-12 каплями раствора перманганата калия. Что наблюдаете? Напишите реакцию взаимодействия этилена с водным раствором перманганата калия и уравняйте ее. Сделайте вывод о возможности качественного определения алкенов и о возможности использовать реакции с бромной водой и раствором перманганата калия для отличия предельных и непредельных углеводородов. Опыт 4. Свойства жидких алкенов Крекинг-бензин, то есть бензин, дополнительно переработанный крекингом, содержит жидкие алкены С6 – С9, которые взаимодействуют с бромной водой и раствором KMnO4. В две пробирки наливают 5-6 капель крекинг-бензина. В первую добавляют такое же количество бромной воды, а во вторую перманганата калия. Запишите наблюдения и уравнения соответствующих реакций, используя в качестве субстрата гексен-2. Уравняйте реакции. Опыт 5. Изучение растворимости бензола в различных растворителях В три пробирки наливают по 8-10 капель воды, этилового спирта и диэтилового эфира. К жидкостям добавляют по 5-6 капель бензола. Пробирки встряхивают и ставят рядом в штатив. В каких жидкостях бензол растворяется? Почему? В случае отсутствия растворения отметьте, в каком слое (верхнем или нижнем) он окажется после расслаивания смеси с растворителем? Объясните, почему так происходит. Опыт 6. Бензол как растворитель Бензол является распространенным неполярным органическим растворителем для неполярных веществ. Реактивы: бензол, животный жир (или растительное масло), иод кристаллический Опыт 6.1. Растворимость жиров в бензоле. В одну пробирку наливают 10-12 капель бензола, в другую — столько же дистиллированной воды. В пробирки помещают по маленькому кусочку жира или 4-5 капель растительного масла. Пробирки взбалтывают. Что наблюдается? Опыт 6.2. Растворимость иода в бензоле. В одну пробирку наливают 10-12 капель бензола, а в другую – столько же дистиллированной воды. В каждую пробирку микрошпателем помещают маленький кристалл иода и, как следует, перемешивают. Запишите в лабораторный журнал ваши наблюдения. Объясните наблюдаемые явления. Опыт 6.3. Растворимость хлорида натрия в бензоле. В одну пробирку наливают 10-12 капель бензола, в другую – столько же дистиллированной воды. В каждую пробирку вносят несколько кристаллов хлорида натрия и, как следует, перемешивают. Запишите наблюдения в лабораторный журнал. Сделайте вывод о растворимости в бензоле веществ разной природы. Опыт 7. Горение бензола Бензол горит коптящим пламенем вследствие высокого содержания углерода в молекуле бензола. Возьмите две фарфоровые чашки. В одну из них поместите небольшой кусочек фильтровальной бумаги, а в другую – такой же кусочек бумаги, смоченный бензолом. Внимание! Фильтровальную бумагу лучше немного смять для улучшения процесса горения. Сжигание бензола в фарфоровой чашечке всегда дает много копоти. В чем причины образования копоти при сгорании бензола? Объясните наблюдаемое явление. Рассчитайте массовую долю углерода в составе молекулы бензола. Опыт 8. Окисление бензола и толуола раствором перманганата калия В одну пробирку добавляют 8-10 капель бензола, а в другую пробирку 8-10 капель толуола (или ксилола). В обе пробирки добавляют 2-3 капли раствора перманганата калия и 2-3 капли 2н. раствора серной кислотой. Смесь в обеих пробирках взбалтывают и нагревают. Запишите в лабораторный журнал наблюдения. Запишите уравнение реакции. Отметьте разницу в поведении бензола и его гомологов по отношению к растворам окислителей. С чем это связано? Опыт 9. Открытие хлора по Бельштейну Реактивы: хлороформ, медная проволока. Методика. В пробирку наливают 10-15 капель хлороформа. Прокаливают медную проволоку в пламени горелки (спиртовки), опускают в раствор хлороформа и снова прокаливают. Пламя спиртовки окрашивается в красивый зеленый цвет. Прокаленная медная проволока, смоченная хлороформом, окрашивает бесцветное пламя горелки в зеленый цвет вследствие образования летучих галоидных солей меди: 5 CuO+ 2CHCl3 =2 Cu+3CuCl2 + 2CO2+ H2O Опыт 10. Определение примесей хлороводорода и хлора в хлороформе Хлороформ — один из первых препаратов, предложенных в качестве средства для наркоза. Однако в связи с тем, что была выявлена высокая токсичность хлороформа, это вещество было исключено из списка средств для общей анестезии. В настоящее время хлороформ в смеси с другими веществами используют для растирания при невралгиях и миозитах. Поэтому очень важно следить за химической чистотой этого вещества. Под влиянием света и кислорода воздуха хлороформ постепенно разлагается с образованием хлороводорода и чрезвычайно ядовитого вещества фосген (COCl2): СНСl3+[O] = COCl2 + HCl Опыт 10.1. Открытие хлороводорода в хлороформе. Для открытия в хлороформе хлороводорода в пробирку вносят 2 капли хлороформа, 3 капли воды и 1 каплю 0,2М раствора нитрата серебра. При наличии в хлороформе хлороводорода содержимое пробирки становится мутным от выпавшего осадка хлорида серебра: AgNO3 + HCl → AgCl↓ + HNO3 Эта проба свидетельствует о непригодности хлороформа для использования в медицинских целях. При дальнейшем окислении фосген разлагается с выделением свободного хлора: СОСl2+[O]=Cl2 +СО2 Наличие положительной пробы на свободный хлор также свидетельствует о недоброкачественности хлороформа. Опыт 10.2. Открытие хлора в хлороформе. В пробирку вносят 3 капли хлороформа, 5 капель воды и 1 каплю 0,5М раствора иодида калия. Содержимое пробирки перемешивают. Розовая окраска нижнего слоя свидетельствует о наличии хлора: 2KI + Сl2 → I2 + 2KC1 Выделяющийся в реакции йод окрашивает хлороформ в розовый цвет. По окончании опытов сделайте вывод о наличии примесей в хлороформе. Можно ли применить данный раствор для медицинских целей? Опыт 11. Сравнение реакционной способности галогенидов в реакциях нуклеофильного замещения Берут две пробирки и наливают по 15-20 капель дистиллированной воды. В одну добавляют на кончике шпателя нитрохлорбензола, в другую столько же нитробензилхлорида. Обе пробирки осторожно нагревают до кипения на пламени горелки. После небольшого охлаждения растворов в пробирках в каждую из них добавляют по 2-3 капли нитрата серебра. Запишите наблюдения. Напишите уравнения реакций, которые протекали. Почему в одном случае реакция гидролиза протекает, а в другом нет? Объясните это с точки зрения электронных эффектов в молекулах хлорбензола и бензилхлорида. |
