ЛФ_1_Химия_Поверхностные явления. Адсорбция_лекция. Поверхностные явления. Адсорбция
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
«Поверхностные явления. Адсорбция». Биологические системы являются гетерогенными, т.е. состоят из нескольких фаз, отделенных друг от друга поверхностью раздела. Процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного (пограничного) слоя, называются поверхностными явлениями. Общую энергию Гиббса можно разделить на два слагаемых – энергию Гиббса объемной фазы G = Поверхностная энергия Гиббса. Gs = σ*s, где Gs – поверхностная энергия Гиббса системы, Дж; σ – коэффициент пропорциональности, называемый поверхностным натяжением, Дж/м2; s – межфазная поверхность, м2. Поверхностное натяжение (σ) - величина, численно равная энергии Гиббса, приходящейся на единицу площади поверхностного слоя и численно равная работе, которую необходимо совершить для образования единицы поверхности раздела фаз при постоянной температуре. Это стремление вещества (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Поверхностное натяжение зависит от природы жидкости и температуры (уменьшается с ростом t). Вода имеет самое высокое значение поверхностного натяжения. Поверхностная активность (g)– способность растворенных веществ изменять поверхностное натяжение растворителя. Уравнение, устанавливающее связь между всеми параметрами адсорбции - величиной поверхностного натяжения σ, концентрацией компонента C в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Оно является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз: где С - концентрация компонента, σ - поверхностное натяжение. Это уравнение показывает, что если при адсорбции поверхностное натяжение σ уменьшается с ростом концентрации C, т.е. d σ /dC<0, то адсорбция Г>0. Это соответствует поверхностно-активным веществам. Наоборот, если σ растет с ростом C, то d σ /dC>0 и Г<0. Это соответствует поверхностно-инактивным веществам. Из адсорбционного уравнения Гиббса следует, что концентрирование вещества в поверхностном слое или переход его в объемную фазу определяется знаком производной Предельное значение этой производной при С→0, взятой со знаком «минус», называется поверхностной активностью (g): 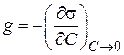 Поверхностную активность рассчитывают как тангенс угла наклона касательной, проведенной к изотерме поверхностного натяжения исследуемого ПАВ при С→0, взятой с обратным знаком. 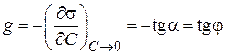 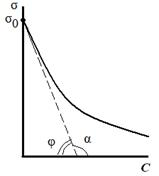 Исследуя поверхностное натяжение водных растворов, Дюкло и Траубе установили зависимость между поверхностной активностью и числом атомов углерода. Правило Дюкло – Траубе: при увеличении углеводородного радикала на группу –СН2–, поверхностная активность увеличивается в 3–3,5 раза 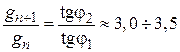 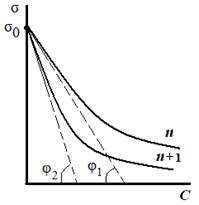 Причина зависимости Дюкло – Траубе заключается в том, что с увеличением длины углеводородной цепи уменьшается растворимость ПАВ и тем самым увеличивается стремление его молекул перейти из объема в поверхностный слой. 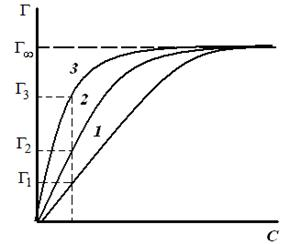
Таким образом, поверхностное натяжение раствора ПАВ уменьшается (σ1 > σ2 > σ3) по мере увеличения длины углеводородного радикала на группу –СН2– (рис. 3.26). При этом величины гиббсовской адсорбции будут возрастать по мере увеличения длины углеводородного радикала в гомологическом ряду (Г1 < Г2 < Г3) и стремиться к одному и тому же предельному значению Г∞ («молекулярный частокол Ленгмюра»). Чем длиннее углеводородный радикал молекулы ПАВ, тем больше молекул в поверхностном слое, тем больше величина адсорбции. Классификация веществ по влиянию на поверхностное натяжение растворителя 1. Поверхностно-активные вещества (ПАВ) – понижают поверхностное натяжение растворителя g > 0, Г>0 (по отношению к воде – органические соединения дифильного строения). 2. Поверхностно-инактивные вещества (ПИВ) – незначительно повышают поверхностное натяжение растворителя g < 0, (неорганические кислоты, основания, соли, глицерин, и др). 3. Поверхностно-неактивные вещества (ПНВ) – практически не изменяют поверхностного натяжения растворителя g = 0. Пример ПНВ – раствор сахара в воде. Ориентация молекул в поверхностном слое и структура биомембран. Поскольку только полярная головка ПАВ растворима в воде, а гидрофобный хвост нет, то такие молекулы выталкиваются на поверхность, где и накапливаются - это пример положительной адсорбции. Пределом такой адсорбции служит полное насыщение поверхностного слоя адсорбируемыми веществами. Если вещество увеличивает поверхностное натяжение, то оно втягивается во внутренние слои жидкости. Это отрицательная адсорбция, поскольку поверхностные слои обедняются растворенным веществом. Лэнгмюр выдвинул предположение, что при максимальных величинах сорбции поверхность раствора покрыта слоем толщиной в одну молекулу ПАВ (мономолекулярным слоем), гидрофобные хвосты молекул ПАВ направлены перпендикулярно поверхности, образуя подобие частокола. При вертикальной ориентации длина цепи молекулы не влияет на площадь, занятую молекулой в поверхностном слое. Структура плазматической мембраны Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6 нм, в которые встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные с липидами и белками. Соотношение липиды : белки : углеводы является характерным для клетки или мембраны и существенно варьирует в зависимости от типа клеток или мембран. Компоненты мембран удерживаются нековалентными связями, вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть мембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру. В то время как «дрейф» в плоскости мембраны происходит достаточно легко, переход белков с внешней стороны мембраны на внутреннюю невозможен, а переход липидов происходит крайне редко. Для «перескока» липидов необходимы специальные белки–транслокаторы. Исключение составляет холестерин, который может легко переходить с одной стороны мембраны на другую. Мембранные липиды На рисунке схематически изображена биомембрана. В мембранах содержатся липиды трех классов: фосфолипиды, холестерин и гликолипиды. Холестерин присутствует во внутриклеточных мембранах животных клеток (за исключением внутренней мембраны митохондрий). Гликолипиды входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводные функциональные группы, которые ориентируются в водную фазу. 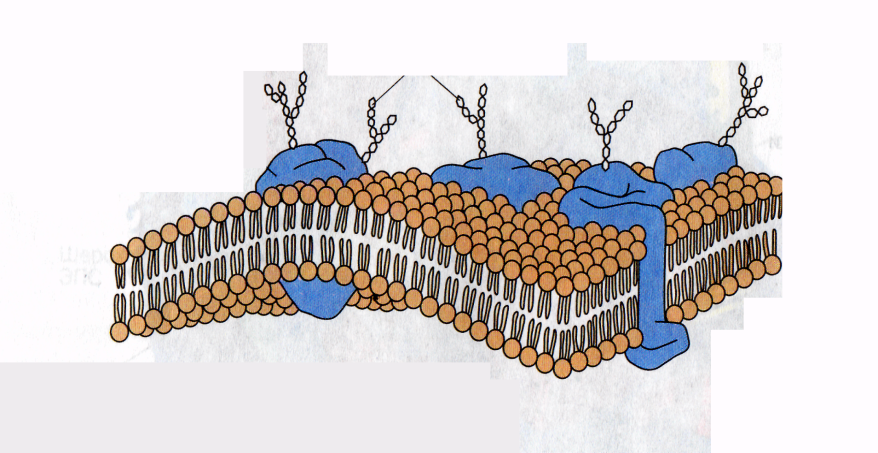 Уравнение Ленгмюра Ленгмюр предложил уравнение адсорбции: Г = Г∞ Где Г∞ - значение предельной адсорбции; с – равновесная концентрация адсорбента в системе; К – константа адсорбционного равновесия. Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид:  На кривой четко видны три участка: I - ый участок – это прямая линия, выходящая из начала координат. Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞∙Кс, т.е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата. III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой). II – ой участок соответствует криволинейной части графика и описывается полным уравнением Ленгмюра. Адсорбционные процессы в организме человека. Применение ионитов в медицине. Явления адсорбции играют очень большую роль в жизнедеятельности животных организмов. Роль адсорбции обусловлена наличием в организме огромного количества самых разнообразных поверхностей раздела — стенок сосудов, поверхности клеток, клеточных ядер и вакуолей, коллоидных частиц протоплазмы и, наконец, поверхности раздела между организмом и средой. Особенно важна функция поверхности раздела между организмом и средой у низших организмов и организмов, живущих в воде, так как этой поверхности принадлежит существенная роль в процессах питания и обмена веществ. Исследования последних лет показали, что пищевые вещества, как правило, являются поверхностно-активными, и потому первым этапом их усвоения является адсорбция, а процесс их химического превращения уже вторичен. Чтобы наглядно представить роль и значение адсорбционных процессов, протекающих в животном организме, рассмотрим адсорбционные возможности эритроцитов крови человека. Исследования показали, что эритроциты являются переносчиками различных веществ, в том числе аминокислот, которые они разносят и передают клеткам и различным тканям организма. Количество эритроцитов в крови взрослого человека примерно 5 000 000 в 1 нм3. У здорового мужчины в среднем на 1 кг массы приходится 450 миллиардов эритроцитов, 27 триллионов на весь организм. Учитывая, что диаметр эритроцита 7—8 мкм, можно легко подсчитать, что общая поверхность эритроцитов всей крови человека составит примерно 3200 м2. Большинство реакций, протекающих в организме, совершается при непосредственном участии ферментов-катализаторов. Исследования показали, что первые стадии действия любого фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. ИОНИТЫ (син. ионообменники) — вещества, способные вступать в реакции обмена ионов при контакте с растворами электролитов. Находят широкое применение в биохимических исследованиях при фракционировании путем хроматографии различных низкомолекулярных метаболитов и биополимеров. Используются для удаления ионов кальция из плазмы крови перед ее консервацией. В клинической практике применяются для нормализации электролитного баланса и удаления из организма некоторых вредных продуктов обмена или токсических экзогенных веществ. С помощью ионитов успешно выделяют ценные лекарственные вещества и антибиотики, в частности стрептомицин. Важной областью применения ионитов является получение деминерализованной воды как в лабораторных, так и в промышленных масштабах, а также очистка сточных вод. |
